Редокс - Redox
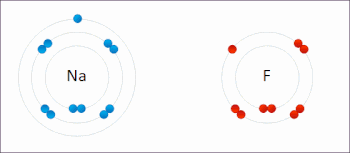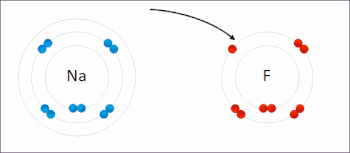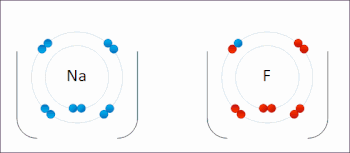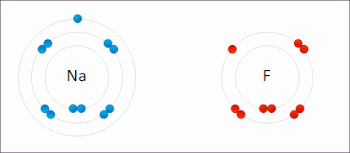
Редокс (восстановление – окисление, произношение: /ˈрɛdɒks/ переделывает или /ˈряdɒks/ Reedoks[1]) является разновидностью химическая реакция в которой состояния окисления из атомы изменены. Окислительно-восстановительные реакции характеризуются фактическим или формальным переносом электроны между химические вещества, чаще всего, когда одна разновидность (восстановитель) подвергается окислению (теряет электроны), в то время как другая разновидность (окислитель) подвергается восстановлению (приобретает электроны).[2] Говорят, что химические частицы, из которых удален электрон, были окисленными, тогда как химические частицы, к которым добавлен электрон, были восстановлены. Другими словами:
- Окисление это потеря электронов или увеличение в степени окисления атома ион, или некоторых атомов в молекула.
- Сокращение это усиление электронов или уменьшение в степени окисления атома, иона или определенных атомов в молекуле (снижение степени окисления).
Много реакции в органической химии являются окислительно-восстановительными реакциями из-за изменений в степени окисления, но без явного переноса электронов. Например, во время горение древесины с молекулярным кислородом, степень окисления атомов углерода в древесине увеличивается, а степень окисления кислород атомов уменьшается по мере образования диоксида углерода и воды. Атомы кислорода подвергаются восстановлению, формально приобретая электроны, в то время как атомы углерода подвергаются окислению, теряя электроны. Таким образом, кислород является окислителем, а углерод - восстановителем в этой реакции.[3]
Хотя реакции окисления обычно связаны с образованием оксидов из молекул кислорода, кислород не обязательно включается в такие реакции, поскольку другие химические соединения могут выполнять ту же функцию.[3]
Редокс-реакции могут протекать относительно медленно, так как при образовании ржавчина, или намного быстрее, как в случае сгорания топлива. Существуют простые окислительно-восстановительные процессы, такие как окисление углерод уступить углекислый газ (CO2) или уменьшение углерода на водород уступить метан (CH4) и более сложные процессы, такие как окисление глюкоза (C6ЧАС12О6) в теле человека. Анализ энергий связи и энергий ионизации в воде позволяет рассчитать окислительно-восстановительные потенциалы.[4][5]
Этимология
«Редокс» - это чемодан слов «восстановление» и «окисление». Слово окисление первоначально подразумевали реакцию с кислородом с образованием оксида, поскольку дикислород (O2(г)) был исторически первым признанным окислитель. Позже этот термин был расширен и теперь включает кислородоподобные вещества, которые совершают параллельные химические реакции. В конце концов, смысл был обобщен, чтобы включить все процессы, связанные с потерей электронов.
Слово сокращение первоначально относилось к потере веса при нагревании металлического руда например, оксид металла извлечь металл. Другими словами, руда «превращалась» в металл. Антуан Лавуазье продемонстрировали, что эта потеря веса произошла из-за потери кислорода в виде газа. Позже ученые поняли, что в этом процессе атом металла приобретает электроны. Значение сокращение затем стал обобщенным, чтобы включить все процессы, связанные с усилением электронов.
Электрохимик Джон Бокрис использовал слова электронизация и деэлектронация для описания процессов восстановления и окисления, соответственно, когда они происходят при электроды.[6] Эти слова аналогичны протонирование и депротонирование,[7] но они не получили широкого распространения среди химиков всего мира.
Термин «гидрирование» часто может использоваться вместо восстановления, поскольку водород является восстановителем в большом количестве реакций, особенно в органической химии и биохимии. Однако, в отличие от окисления, которое распространяется не только на его корневой элемент, гидрирование сохранило свою специфическую связь с реакциями, которые Добавить водород в другое вещество (например, гидрирование ненасыщенных жиров в насыщенные жиры, R − CH = CH − R + H2 → R − CH2-CH2-R). Слово «редокс» впервые было использовано в 1928 году.[8]
Определения
Процессы окисления и восстановления происходят одновременно и не могут происходить независимо друг от друга, как кислотно-основные реакции.[3] Одно только окисление и одно только восстановление называют полуреакция потому что две половинные реакции всегда происходят вместе, образуя целую реакцию. При написании полуреакций полученные или потерянные электроны обычно включаются явно, чтобы полуреакция была сбалансированный относительно электрического заряда. Электроны нейтрализуются, когда половинные реакции объединяются, чтобы создать чистую химическое уравнение.
Хотя этих общих описаний достаточно для многих целей, они не совсем верны. Хотя окисление и восстановление правильно относятся к изменение в степень окисления, фактический перенос электронов может никогда не произойти. Степень окисления атома - это фиктивный заряд, который атом имел бы, если бы все связи между атомами различных элементов были на 100% ионными. Таким образом, окисление лучше всего определить как повышение степени окисления, и редукция как снижение степени окисления. На практике перенос электронов всегда вызывает изменение степени окисления, но есть много реакций, которые классифицируются как «окислительно-восстановительные», даже если перенос электронов не происходит (например, с участием ковалентный облигации). В результате невозможно записать простые полуреакции для отдельных атомов, претерпевающих окислительно-восстановительный процесс.
Окислители и восстановители
В окислительно-восстановительных процессах восстановитель передает электроны окислителю. Таким образом, в реакции восстановитель или Восстановитель теряет электроны и окисляется, а окислитель или окислитель получает электроны и уменьшается. Пара окислителя и восстановителя, которая участвует в конкретной реакции, называется окислительно-восстановительная пара. А редокс пара представляет собой восстанавливающий вид и его соответствующую окисляющую форму, например, Fe2+
/ Fe3+
.
Окислители

Вещества, которые обладают способностью окислять другие вещества (заставляют их терять электроны) называются окислительный или окисляющий и известны как окислители, окислители или окислители. То есть окислитель (окислитель) удаляет электроны из другого вещества и, таким образом, сам восстанавливается. И, поскольку он «принимает» электроны, окислитель также называют акцептор электронов. Кислород является основным окислителем.
Окислители обычно представляют собой химические вещества с элементами в высокой степени окисления (например, ЧАС
2О
2, MnO−
4, CrO
3, Cr
2О2−
7, OsO
4), или иначе электроотрицательный элементы (О2, F2, Cl2, Br2 ), которые могут получить дополнительные электроны, окисляя другое вещество.
Редукторы
Вещества, которые обладают способностью уменьшить другие вещества (заставляют их приобретать электроны) называются редуктивный или сокращение и известны как восстановители, восстановители или восстановители. Восстановитель (восстановитель) переносит электроны на другое вещество и, таким образом, сам окисляется. И, поскольку он отдает электроны, восстановитель также называют донор электронов. Доноры электронов также могут образовывать комплексы с переносом заряда с акцепторами электронов.
Восстановители в химии очень разнообразны. Электроположительный элементаль металлы, такие как литий, натрий, магний, утюг, цинк, и алюминий, являются хорошими восстановителями. Эти металлы жертвуют или отдавать электроны относительно легко. Реагенты для переноса гидрида, такие как NaBH4 и LiAlH4, широко используются в органическая химия,[9][10] прежде всего в сокращении карбонил соединения с спирты. Другой метод восстановления включает использование газообразного водорода (H2) с палладий, платина, или никель катализатор. Эти каталитическое восстановление используются в основном для восстановления двойных или тройных связей углерод-углерод.
Стандартные электродные потенциалы (восстановительные потенциалы)
Каждая полуреакция имеет стандарт электродный потенциал (E0
ячейка), что равно разности потенциалов или Напряжение в равновесии под стандартные условия из электрохимическая ячейка в которой катод реакция - это полуреакция считается, и анод это стандартный водородный электрод где водород окислен:
- 1⁄2 ЧАС2 → H+ + е−.
Электродный потенциал каждой полуреакции также известен как его потенциал сокращения E0
красный, или потенциальный, когда полуреакция происходит на катоде. Потенциал восстановления - это мера тенденции окислителя к восстановлению. Его значение равно нулю для H+ + е− → 1⁄2 ЧАС2 по определению положительно для окислителей сильнее, чем H+ (например, +2,866 В для F2) и отрицательный для окислителей, которые слабее H+ (например, −0,763 В для Zn2+).[11]
Для окислительно-восстановительной реакции, происходящей в клетке, разность потенциалов равна:
- E0
ячейка = E0
катод – E0
анод
Однако потенциал реакции на аноде иногда выражается как окислительный потенциал:
- E0
бык = –E0
красный.
Потенциал окисления является мерой тенденции восстановителя к окислению, но не представляет собой физический потенциал на электроде. В этих обозначениях уравнение напряжения ячейки записывается со знаком плюс
- E0
ячейка = E0
красный (катод) + E0
вол (анод)
Примеры окислительно-восстановительных реакций

В реакции между водород и фтор, происходит окисление водорода и восстановление фтора:
- ЧАС
2 + F
2 → 2 ВЧ
Эта реакция является спонтанной и выделяет 542 кДж на 2 г водорода, потому что связь H-F намного прочнее, чем слабая, высокоэнергетическая связь F-F. Мы можем записать эту общую реакцию в виде двух полуреакции:
реакция окисления:
и реакция восстановления:
- F
2 + 2 е− → 2 F−
Анализ каждой полуреакции по отдельности часто может прояснить общий химический процесс. Поскольку нет никакого чистого изменения заряда во время окислительно-восстановительной реакции, количество электронов, избыточное в реакции окисления, должно равняться количеству, потребляемому реакцией восстановления (как показано выше).
Элементы, даже в молекулярной форме, всегда имеют нулевую степень окисления. В первой полуреакции водород окисляется от нулевой степени окисления до степени окисления +1. Во второй полуреакции фтор восстанавливается от степени окисления нуля до степени окисления -1.
При сложении реакций электроны аннулируются:
ЧАС
2→ 2 ч+ + 2 е− F
2 + 2 е−→ 2 F− ЧАС2 + F2 → 2 ч+ + 2 Ж−
И ионы объединяются, чтобы сформировать фтороводород:
- 2 ч+ + 2 Ж− → 2 ВЧ
Общая реакция такова:
- ЧАС
2 + F
2 → 2 ВЧ
Смещение металла

В реакции этого типа атом металла в соединении (или в растворе) заменяется атомом другого металла. Например, медь депонируется, когда цинк металл помещается в сульфат меди (II) решение:
Zn (ы) + CuSO4(водн.) → ZnSO4(водн.) + Cu (s)
В указанной выше реакции металлический цинк вытесняет ион меди (II) из раствора сульфата меди и, таким образом, высвобождает свободную металлическую медь. Реакция является спонтанной и выделяет 213 кДж на 65 г цинка, потому что по сравнению с цинком металлическая медь имеет меньшую энергию из-за связывания через свои частично заполненные d-орбитали.[4]
Ионное уравнение этой реакции:
- Zn + Cu2+ → Zn2+ + Cu
Как два полуреакции, видно, что цинк окисляется:
- Zn → Zn2+ + 2 е−
И медь снижается:
- Cu2+ + 2 е− → Cu
Другие примеры
- Уменьшение нитрат к азот в присутствии кислоты (денитрификация ):
- 2 Нет−
3 + 10 e− + 12 часов+ → N2 + 6 часов2О
- 2 Нет−
- В горение из углеводороды, например, в двигатель внутреннего сгорания, производит воды, углекислый газ, некоторые частично окисленные формы, такие как монооксид углерода, и тепло энергия. Полное окисление материалов, содержащих углерод производит двуокись углерода.
- В органическая химия, при ступенчатом окислении углеводорода кислородом образуется вода и, соответственно, алкоголь, альдегид или кетон, а карбоновая кислота, а затем перекись.
Коррозия и ржавчина


- Период, термин коррозия относится к электрохимическому окислению металлов в реакции с окислителем, таким как кислород. Ржавчина, формирование оксиды железа, является хорошо известным примером электрохимической коррозии; образуется в результате окисления утюг металл. Обычная ржавчина часто относится к оксид железа (III), образуется в следующей химической реакции:
- 4 Fe + 3 O2 → 2 Fe2О3
- Окисление железа (II) до железа (III) путем пероксид водорода в присутствии кислоты:
- Fe2+ → Fe3+ + е−
- ЧАС2О2 + 2 е− → 2 ОН−
- Общее уравнение:
- 2 Fe2+ + H2О2 + 2 часа+ → 2 Fe3+ + 2 часа2О
Диспропорционирование
А непропорциональность реакция - это реакция, в которой одно вещество одновременно окисляется и восстанавливается. Например, тиосульфат ион с серой в степени окисления +2 может реагировать в присутствии кислоты с образованием элементарной серы (степень окисления 0) и диоксид серы (степень окисления +4).
- S2О32-(водн.) + 2 H+(водный) → S (s) + SO2(г) + H2О (л)
Таким образом, один атом серы восстанавливается с +2 до 0, а другой окисляется с +2 до +4.[12]
Окислительно-восстановительные реакции в промышленности
Катодная защита это метод, используемый для контроля коррозии металлической поверхности путем превращения ее в катод электрохимической ячейки. Простой метод защиты соединяет защищенный металл с более легко подверженным коррозии.жертвенный анод "действовать как анод. Жертвенный металл вместо защищаемого металла, таким образом, подвергается коррозии. Обычно катодная защита применяется в оцинкованный сталь, в которой защитное покрытие из цинка на стальных деталях защищает их от ржавчины.
Окисление используется в самых разных отраслях промышленности, например, при производстве чистящие средства и окисляющий аммиак производить азотная кислота, который используется в большинстве удобрения.
Редокс-реакции являются основой электрохимические ячейки, которые могут генерировать электроэнергию или поддерживать электросинтез. Металл руды часто содержат металлы в окисленном состоянии, такие как оксиды или сульфиды, из которых чистые металлы извлекаются путем плавка при высокой температуре в присутствии восстановителя. Процесс гальваника использует окислительно-восстановительные реакции для покрытия объектов тонким слоем материала, как в хромированный автомобильный части серебряное покрытие столовые приборы, гальванизация и позолоченный Ювелирные изделия.
Редокс-реакции в биологии
 |
 |
Дно: дегидроаскорбиновая кислота (окисленная форма из Витамин C )
Многие важные биологический процессы включают окислительно-восстановительные реакции.
Клеточное дыхание, например, окисление глюкоза (C6ЧАС12О6) к CO2 и сокращение кислород к воды. Итоговое уравнение клеточного дыхания:
- C6ЧАС12О6 + 6 O2 → 6 СО2 + 6 часов2О
Процесс клеточного дыхания также сильно зависит от снижения НАД+ в НАДН и обратная реакция (окисление НАДН до НАД+). Фотосинтез и клеточное дыхание дополняют друг друга, но фотосинтез не является обратной реакцией окислительно-восстановительного процесса при клеточном дыхании:
- 6 CO2 + 6 часов2O + энергия света → С6ЧАС12О6 + 6 O2
Биологическая энергия часто сохраняется и высвобождается в результате окислительно-восстановительных реакций. Фотосинтез предполагает уменьшение углекислый газ в сахара и окисление воды в молекулярный кислород. Обратная реакция, дыхание, окисляет сахара с образованием углекислого газа и воды. В качестве промежуточных этапов восстановленные углеродные соединения используются для уменьшения никотинамид аденин динуклеотид (НАД+) в НАДН, который затем способствует созданию протонный градиент, что стимулирует синтез аденозинтрифосфат (АТФ) и поддерживается за счет восстановления кислорода. митохондрии выполняют аналогичные функции. Увидеть Мембранный потенциал статья.
Свободный радикал реакции - это окислительно-восстановительные реакции, которые происходят как часть гомеостаз и убийство микроорганизмов, когда электрон отделяется от молекулы, а затем снова присоединяется почти мгновенно. Свободные радикалы являются частью окислительно-восстановительных молекул и могут стать вредными для человеческого организма, если они не присоединятся к окислительно-восстановительной молекуле или окислительно-восстановительной молекуле. антиоксидант. Неудовлетворенные свободные радикалы могут стимулировать мутацию клеток, с которыми они сталкиваются, и, таким образом, являются причинами рака.
Период, термин окислительно-восстановительное состояние часто используется для описания баланса GSH / GSSG, НАД+/ НАДН и НАДФ+/ НАДФН в биологической системе, такой как клетка или орган. Окислительно-восстановительное состояние отражается в балансе нескольких наборов метаболитов (например, лактат и пируват, бета-гидроксибутират, и ацетоацетат ), взаимное преобразование которых зависит от этих соотношений. Аномальное окислительно-восстановительное состояние может развиваться в различных опасных ситуациях, например: гипоксия, шок, и сепсис. Редокс-механизм также контролирует некоторые клеточные процессы. Редокс-белки и их гены должны быть расположены вместе для редокс-регуляции в соответствии с Гипотеза CoRR для функции ДНК в митохондриях и хлоропластах.
Редокс-цикл
Широкие разновидности ароматические соединения находятся ферментативно сводится к форме свободные радикалы которые содержат на один электрон больше, чем их родительские соединения. Как правило, донор электронов - это любой из множества флавоэнзимов и их коферменты. После образования эти свободные радикалы аниона восстанавливают молекулярный кислород до супероксид и регенерируют неизмененное исходное соединение. Итоговая реакция - это окисление коферментов флавоэнзима и восстановление молекулярного кислорода с образованием супероксида. Это каталитическое поведение было описано как бесполезный цикл или окислительно-восстановительный цикл.
Редокс-реакции в геологии

В геология окислительно-восстановительный потенциал важен как для образования минералов, так и для их мобилизации, а также важен для некоторых осадочные среды. В общем, окислительно-восстановительное состояние большинства горных пород можно увидеть по цвету горных пород. Порода образуется в окислительных условиях, придавая ей красный цвет. Затем он «обесцвечивается» до зеленой или иногда белой формы, когда восстанавливающая жидкость проходит через породу. Восстановленная жидкость также может содержать урансодержащие минералы. Известные примеры окислительно-восстановительных условий, влияющих на геологические процессы, включают: урановые месторождения и Мрамор Moqui.
Балансировка окислительно-восстановительных реакций
Описание общей электрохимической реакции окислительно-восстановительного процесса требует балансировка компонента полуреакции для окисления и восстановления. Как правило, для реакций в водном растворе это включает добавление ЧАС+, ОЙ−, ЧАС2О, и электроны для компенсации окислительных изменений.
Кислая среда
В кислой водной среде H+ ионы и вода добавляются к полуреакциям, чтобы сбалансировать общую реакцию.
Например, когда марганец (II) реагирует с висмутат натрия:
Несбалансированная реакция: Mn2+(водн.) + NaBiO3(s) → Bi3+(водн.) + MnO−
4 (водн.)Окисление: 4 ч2O (l) + Mn2+(водн.) → MnO−
4(водн.) + 8 H+(водн.) + 5 e−Снижение: 2 е− + 6 часов+ + BiO−
3(s) → Bi3+(водн.) + 3 H2О (л)
Реакция уравновешивается путем масштабирования двух реакций полуячейки, чтобы задействовать одинаковое количество электронов (умножение реакции окисления на количество электронов на стадии восстановления и наоборот):
- 8 часов2O (l) + 2 млн.2+(водн.) → 2MnO−
4(водн.) + 16 H+(водн.) + 10 е− - 10 е− + 30 часов+ + 5 BiO−
3(s) → 5 Bi3+(водн.) + 15 H2О (л)
Добавление этих двух реакций исключает электроны и дает сбалансированную реакцию:
- 14 часов+(водн.) + 2 Mn2+(водн.) + 5 NaBiO3(с) → 7 H2О (л) + 2MnO−
4(водн.) + 5 Bi3+(водн.) + 5Na+
(водн.)
Основные СМИ
В основных водных средах ОЙ− ионы и вода добавляются к полуреакциям, чтобы сбалансировать общую реакцию.
Например, в реакции между перманганат калия и сульфит натрия:
Несбалансированная реакция: KMnO4 + Na2ТАК3 + H2O → MnO2 + Na2ТАК4 + КОН Снижение: 3 е− + 2 часа2O + MnO−
4 → MnO2 + 4 ОН−Окисление: 2 ОН− + ТАК2−
3 → ТАК2−
4 + H2O + 2 e−
Уравновешивание количества электронов в двух реакциях полуячейки дает:
- 6 e− + 4 часа2O + 2MnO−
4 → 2 MnO2 + 8 ОН− - 6 ОН− + 3 ТАК2−
3 → 3 ТАК2−
4 + 3 часа2O + 6 e−
Сложение этих двух полуэлементных реакций вместе дает сбалансированное уравнение:
- 2 КМно4 + 3 Na2ТАК3 + H2O → 2 MnO2 + 3 Na2ТАК4 + 2 КОН
Мнемоника
Ключевые термины, относящиеся к окислительно-восстановительному потенциалу, часто сбивают с толку.[13][14] Например, реагент, который окисляется, теряет электроны; однако этот реагент называется восстанавливающим агентом. Точно так же восстановленный реагент приобретает электроны и называется окислителем.[15] Эти мнемоника обычно используются учащимися, чтобы помочь запомнить терминологию:[16]
- "OIL RIG" - окисление - это потеря электронов, восстановление - это получение электронов.[13][14][15][16]
- «Лев говорит GER» - потеря электронов - это окисление, их рост - уменьшение.[13][14][15][16]
- «ЛЕОРА говорит ГЕРОА» - потеря электронов называется окислением (восстановителем); прирост электронов называется восстановлением (окислитель).[15]
- «RED CAT» и «AN OX» или «AnOx RedCat» («бычий красный кот») - восстановление происходит на катоде, а анод предназначен для окисления.
- «RED CAT получает то, что теряет AN OX» - уменьшение на катоде приобретений (электронов) того, что теряет анодное окисление (электроны)
- «ПАНИКА» - положительный анод, а отрицательный - катод. Это относится к электролитические ячейки которые высвобождают накопленную электроэнергию и могут заряжаться электричеством. ПАНИКА не распространяется на клетки, которые можно перезаряжать окислительно-восстановительными материалами. Эти гальванические или гальванические элементы, такие как топливные элементы, производят электричество в результате внутренних окислительно-восстановительных реакций. Здесь положительный электрод - это катод, а отрицательный - анод.
Смотрите также
- Анаэробное дыхание
- Бессемеровский процесс
- Биоремедиация
- Цикл Кальвина
- Химическое уравнение
- Химическое петлевое горение
- Цикл лимонной кислоты
- Электрохимическая серия
- Электрохимия
- Электролиз
- Электронный эквивалент
- Электронная транспортная цепь
- Электросинтез
- Гальванический элемент
- Гидрирование
- Мембранный потенциал
- Микробный топливный элемент
- Нуклеофильная абстракция
- Органическая окислительно-восстановительная реакция
- Окислительное добавление и восстановительное удаление
- Окислительного фосфорилирования
- Частичное окисление
- Прооксидант
- Пониженный газ
- Восстановитель
- Восстановительная атмосфера
- Потенциал снижения
- Термическая реакция
- Трансметалляция
- Серный цикл
использованная литература
- ^ "окислительно-восстановительный потенциал - определение окислительно-восстановительного потенциала в английском | Оксфордские словари". Оксфордские словари | английский. В архиве с оригинала на 2017-10-01. Получено 2017-05-15.
- ^ «Редокс-реакции». wiley.com. В архиве из оригинала 30.05.2012. Получено 2012-05-09.
- ^ а б c Хаустейн, Кэтрин Хинга (2014). «Окислительно-восстановительная реакция». У К. Ли Лернера; Бренда Уилмот Лернер (ред.). Энциклопедия науки Гейла (5-е изд.). Фармингтон-Хиллз, Мичиган: Gale Group.
- ^ а б Шмидт-Рор, К. (2018). «Как аккумуляторы накапливают и выделяют энергию: объяснение основ электрохимии». J. Chem. Образовательный. 95 (10): 1801–1810. Дои:10.1021 / acs.jchemed.8b00479.
- ^ Шмидт-Рор, К. (2015). «Почему процессы сгорания всегда экзотермичны, давая около 418 кДж на моль O2". J. Chem. Образовательный. 92 (12): 2094–2099. Дои:10.1021 / acs.jchemed.5b00333.
- ^ Бокрис, Джон О'М .; Редди, Амуля К. Н. (1970). Современная электрохимия. Пленум Пресс. С. 352–3.
- ^ Бокрис, Джон О'М .; Редди, Амуля К. (2013) [1970]. Современная электрохимия. Том 1. Springer Science & Business Media. п. 494. ISBN 9781461574675. Получено 29 марта 2020.
Описанные гомогенные реакции переноса протона аналогичны реакциям гомогенного переноса электрона в том, что общая реакция переноса электрона может быть разложена на одну реакцию электронирования и одну реакцию деэлектронирования.
- ^ Харпер, Дуглас. "редокс". Интернет-словарь этимологии.
- ^ Худлицкий, Милош (1996). Уменьшение в органической химии. Вашингтон, округ Колумбия: Американское химическое общество. п. 429. ISBN 978-0-8412-3344-7.
- ^ Худлицкий, Милош (1990). Окисления в органической химии. Вашингтон, округ Колумбия: Американское химическое общество. стр.456. ISBN 978-0-8412-1780-5.
- ^ Значения электродного потенциала от: Petrucci, Ralph H .; Харвуд, Уильям S .; Херринг, Ф. Джеффри (2002). Общая химия: принципы и современные приложения (8-е изд.). Река Аппер Сэдл, штат Нью-Джерси: Prentice Hall. п.832. ISBN 978-0-13-014329-7. LCCN 2001032331. OCLC 46872308.CS1 maint: ref = harv (ссылка на сайт)
- ^ Petrucci, Ralph H .; Харвуд, Уильям S .; Херринг, Ф. Джеффри (2002). Общая химия. Принципы и современные приложения (8-е изд.). Прентис Холл. п. 158. ISBN 0-13-014329-4.
- ^ а б c Робертсон, Уильям (2010). Больше основ химии. Национальная ассоциация учителей естественных наук. п. 82. ISBN 978-1-936137-74-9.
- ^ а б c Филлипс, Джон; Строзак, Виктор; Вистром, Шерил (2000). Химия: концепции и приложения. Гленко МакГроу-Хилл. п. 558. ISBN 978-0-02-828210-7.
- ^ а б c d Роджерс, Глен (2012). Описательная неорганическая, координационная химия и химия твердого тела. Брукс / Коул, Cengage Learning. п. 330. ISBN 978-0-8400-6846-0.
- ^ а б c Зумдал, Стивен; Зумдал, Сьюзен (2009). Химия. Хоутон Миффлин. п. 160. ISBN 978-0-547-05405-6.
дальнейшее чтение
- Schüring, J .; Schulz, H.D .; Fischer, W. R .; Böttcher, J .; Duijnisveld, W.H., ред. (1999). Редокс: основы, процессы и приложения. Гейдельберг: Springer-Verlag. п. 246. HDL:10013 / epic.31694.d001. ISBN 978-3-540-66528-1.CS1 maint: ref = harv (ссылка на сайт)
- Tratnyek, Paul G .; Грундл, Тимоти Дж .; Хадерлейн, Стефан Б., ред. (2011). Водная окислительно-восстановительная химия. Серия симпозиумов ACS. 1071. Дои:10.1021 / bk-2011-1071. ISBN 978-0-8412-2652-4.CS1 maint: ref = harv (ссылка на сайт)
внешние ссылки
- Балансир химического уравнения - Балансировщик химических уравнений с открытым исходным кодом, который обрабатывает окислительно-восстановительные реакции.
- Калькулятор окислительно-восстановительных реакций
- Редокс-реакции в Chemguide
- Онлайн-балансировщик уравнений окислительно-восстановительной реакции, балансирует уравнения любых полуэлементов и полных реакций

