Тиосульфат - Thiosulfate
 | |
 | |
| Имена | |
|---|---|
Имена ИЮПАК
| |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Характеристики | |
| S 2О2− 3 | |
| Молярная масса | 112,13 г · моль−1 |
| Конъюгированная кислота | тиосерная кислота |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Тиосульфат (S
2О2−
3) (Орфография, рекомендованная IUPAC; иногда тиосульфат в британском английском) является оксианион серы.
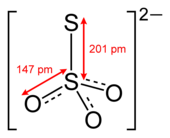
Префикс тио- указывает, что тиосульфат-ион это сульфат ион с одним кислород заменен на сера. Тиосульфат имеет четырехгранный молекулярная форма с C3в симметрия. Тиосульфат возникает в природе и вырабатывается определенными биохимическими процессами. Он быстро дехлорирует воду и известен тем, что предотвращает отбеливание в бумажной промышленности. Тиосульфат также полезен при плавке серебряная руда, при производстве изделий из кожи и для нанесения красок на текстиль.
Тиосульфат натрия, обычно называемый гипо (от «гипосульфит»), широко использовался в фотографии для исправить черно-белые негативы и отпечатки после стадии проявки; современные «быстрые» фиксаторы используют тиосульфат аммония как фиксирующая соль, потому что действует в три-четыре раза быстрее.[2] Некоторые бактерии могут метаболизировать тиосульфаты.[3]
Формирование
Тиосульфат образуется в результате реакции сульфит ион с элементарной серой, а при неполном окислении сульфиды (пирит окисление), тиосульфат натрия может образовываться путем диспропорционирования серы, растворяющейся в гидроксиде натрия (аналогично фосфор ).
Реакции
Тиосульфаты стабильны только в нейтральном или щелочной растворах, но не в кислых растворах из-за непропорциональность до сульфита и серы, сульфит дегидратируется до диоксид серы:
- S
2О2−
3 (водн.) + 2 H+ (водн.) → SO2 (г) + S (s) + H2О (л)
Эта реакция может быть использована для получения водного приостановка серы и продемонстрировать Рэлеевское рассеяние из свет в физика. Если белый свет светит снизу, синий свет виден сбоку, а оранжевый - сверху, из-за тех же механизмов, которые окрашивают небо в полдень и в сумерки.[нужна цитата ]
Тиосульфаты по-разному реагируют с галогенами, что можно объяснить снижением окислительной способности по галогенной группе:
- 2 S
2О2−
3 (водн.) + I2 (водн.) → S
4О2−
6 (водн.) + 2 I− (водн.)
- S
2О2−
3 (водн.) + 4 Br2 (водн.) + 5 H2О (л) → 2 ТАК2−
4 (водн.) + 8 Br− (водн.) + 10 H+ (водн.)
- S
2О2−
3 (водн.) + 4 Cl2 (водн.) + 5 H2О (л) → 2 ТАК2−
4 (водн.) + 8 Cl− (водн.) + 10 H+ (водн.)
В кислых условиях тиосульфат вызывает быстрое коррозия металлов; сталь и нержавеющая сталь особенно чувствительны к точечная коррозия индуцируется тиосульфатом. Добавление молибден по отношению к нержавеющей стали необходимо для повышения ее устойчивости к питтингу (AISI 316L hMo). В щелочных водных условиях и при средней температуре (60 ° C) углеродистая сталь и нержавеющая сталь (AISI 304L, 316L) не подвергаются воздействию даже при высокой концентрации основания (30% масс. КОН), тиосульфата (10% масс.) И в присутствии фторид-иона (5 мас.% KF).
Встречаемость тиосульфатной группы в природе практически ограничена очень редкими минеральная сидпиетерсит, Pb4(S2О3) O2(ОЙ)2,[4] поскольку наличие этого аниона в минерале баженовит недавно оспаривался.[5]
Тиосульфат широко образует комплексы с переходные металлы следовательно, обычное применение - растворение галогенидов серебра в проявке пленочной фотографии.[6] Тиосульфат также используется для извлечения или выщелачивания золота (тиосульфата натрия) и серебра из руд в качестве менее токсичной альтернативы цианиду.[6]
Номенклатура
Тиосульфат - приемлемое общее название (но используется почти всегда); функциональная замена ИЮПАК имя сульфуротиоат; систематическая добавка ИЮПАК называется триоксидосульфидосульфат (2-) или же триоксидо-1κ3О-дисульфат (S—S)(2−).[1] Внешняя сера имеет степень окисления –2 (−II), в то время как центральный атом серы имеет степень окисления +6 (+ VI).[7]
Биохимия
Фермент роданаза катализирует детоксикацию цианид тиосульфатом: CN− + S
2О2−
3 → SCN− + ТАК2−
3.
Тиосульфат натрия считается эмпирическим средством лечения отравления цианидом, наряду с гидроксокобаламин. Он наиболее эффективен в догоспитальных условиях, поскольку немедленное введение персонала неотложной помощи необходимо для обращения вспять быстрой внутриклеточной гипоксии, вызванной ингибированием клеточное дыхание, в комплекс IV.[8][9][10][11]
Он активирует TST (тиосульфат-серотрансферазу) в митохондриях. ТКП ассоциируется с защитой от ожирения и диабета типа II (инсулинорезистентного).[12][13]
Смотрите также
Рекомендации
- ^ а б Международный союз теоретической и прикладной химии (2005). Номенклатура неорганической химии (Рекомендации ИЮПАК 2005 г.). Кембридж (Великобритания): RSC –ИЮПАК. ISBN 0-85404-438-8. С. 139,329. Электронная версия.
- ^ Сауэрби, А. Л. М., изд. (1961). Словарь по фотографии: справочник для фотографов-любителей и профессиональных фотографов (19-е изд.). Лондон: Illife Books Ltd.[страница нужна ]
- ^ К. Майкл Хоган. 2011 г. Сера. Энциклопедия Земли, ред. А. Йоргенсен и К. Дж. Кливленд, Национальный совет по науке и окружающей среде, Вашингтон, округ Колумбия
- ^ handbookofmineralogy.org, Справочник по минералам[требуется полная цитата ]
- ^ minsocam.org[требуется полная цитата ]
- ^ а б antoine.frostburg.edu[требуется полная цитата ]
- ^ Описательная неорганическая химия 6.ed. стр.462 ISBN 978-1-319-15411-0
- ^ Холл, Алан Х .; Дарт, Ричард; Богдан, Григорий (2007). «Тиосульфат натрия или гидроксокобаламин для эмпирического лечения отравления цианидом?». Анналы неотложной медицины. 49 (6): 806–13. Дои:10.1016 / j.annemergmed.2006.09.021. PMID 17098327.
- ^ Хамель, Дж. (2011). "Обзор острого отравления цианидом с обновлением лечения" (PDF). Медсестра интенсивной терапии. 31 (1): 72–81, тест 82. Дои:10.4037 / ccn2011799. PMID 21285466.
- ^ Шеперд, G .; Велес, Л. I (2008). «Роль гидроксокобаламина в остром отравлении цианидом». Анналы фармакотерапии. 42 (5): 661–9. Дои:10.1345 / аф. 1К559. PMID 18397973.
- ^ Майлз, Брайант (24 февраля 2003 г.). «Ингибиторы и разобщители» (PDF). Техасский университет A&M. Получено 25 ноября 2015.
- ^ Стилиану, И. М .; и другие. (2005). «Микроматричный анализ экспрессии гена QTL ожирения Fob3b идентифицирует позиционный ген-кандидат Sqle и нарушенные пути холестерина и гликолиза». Physiol. Геномика. 20 (3): 224–232. CiteSeerX 10.1.1.520.5898. Дои:10.1152 / физиолгеномика.00183.2004. PMID 15598878.
- ^ Morton, N.M .; Beltram, J .; Картер, Р. Н .; и другие. (2016). «Генетическая идентификация тиосульфат сертрансферазы как антидиабетической мишени, экспрессируемой адипоцитами, у мышей, отобранных по худобе». Природа Медицина. 22 (7): 771–779. Дои:10,1038 / нм. 4115. ЧВК 5524189. PMID 27270587.
