Бензол - Benzene
| |||
 Модель заполнения пространства | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Бензол[1] | |||
| Другие имена Бензол (исторический / немецкий) Циклогекса-1,3,5-триен; 1,3,5-циклогексатриен [6] Аннулен (не рекомендуется[1]) | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.685 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C6ЧАС6 | |||
| Молярная масса | 78.114 г · моль−1 | ||
| Внешность | Бесцветная жидкость | ||
| Запах | сладкий ароматный | ||
| Плотность | 0,8765 (20) г / см3[2] | ||
| Температура плавления | 5,53 ° С (41,95 ° F, 278,68 К) | ||
| Точка кипения | 80,1 ° С (176,2 ° F, 353,2 К) | ||
| 1,53 г / л (0 ° С) 1,81 г / л (9 ° С) 1,79 г / л (15 ° С)[3][4][5] 1,84 г / л (30 ° С) 2,26 г / л (61 ° С) 3,94 г / л (100 ° С) 21,7 г / кг (200 ° C, 6,5 МПа) 17,8 г / кг (200 ° C, 40 МПа)[6] | |||
| Растворимость | Растворим в алкоголь, CHCl3, CCl4, диэтиловый эфир, ацетон, уксусная кислота[6] | ||
| Растворимость в этандиол | 5,83 г / 100 г (20 ° С) 6,61 г / 100 г (40 ° С) 7,61 г / 100 г (60 ° С)[6] | ||
| Растворимость в этиловый спирт | 20 ° C, раствор в воде: 1,2 мл / л (20% об.)[7] | ||
| Растворимость в ацетон | 20 ° C, раствор в воде: 7,69 мл / л (38,46% об. / Об.) 49,4 мл / л (62,5% об. / Об.)[7] | ||
| Растворимость в диэтиленгликоль гликоль | 52 г / 100 г (20 ° С)[6] | ||
| бревно п | 2.13 | ||
| Давление газа | 12,7 кПа (25 ° C) 24,4 кПа (40 ° C) 181 кПа (100 ° C)[8] | ||
| Конъюгированная кислота | Ион арения | ||
| УФ-видимый (λМаксимум) | 255 нм | ||
| −54.8·10−6 см3/ моль | |||
| 1,5011 (20 ° С) 1,4948 (30 ° С)[6] | |||
| Вязкость | 0.7528 cP (10 ° С) 0,6076 сП (25 ° C) 0,4965 сП (40 ° С) 0,3075 сП (80 ° C) | ||
| Структура | |||
| Тригональный планарный | |||
| 0 D | |||
| Термохимия | |||
Теплоемкость (C) | 134,8 Дж / моль · К | ||
Стандартный моляр энтропия (S | 173,26 Дж / моль · К[8] | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | 48,7 кДж / моль | ||
Станд. Энтальпия горение (ΔcЧАС⦵298) | 3267,6 кДж / моль[8] | ||
| Опасности | |||
| Главный опасности | потенциальный профессиональный канцероген, легковоспламеняющийся | ||
| Паспорт безопасности | Видеть: страница данных HMDB | ||
| Пиктограммы GHS |      [9] [9] | ||
| Сигнальное слово GHS | Опасность | ||
| H225, H304, H315, H319, H340, H350, H372, H410[9] | |||
| P201, P210, P301 + 310, P305 + 351 + 338, P308 + 313, P331[9] | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | -11,63 ° С (11,07 ° F, 261,52 К) | ||
| 497,78 ° С (928,00 ° F, 770,93 К) | |||
| Пределы взрываемости | 1.2–7.8% | ||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза ) | 930 мг / кг (крыса, перорально) | ||
LCLo (самый низкий опубликованный ) | 44000 частей на миллион (кролик, 30 мин) 44,923 частей на миллион (собака) 52 308 частей на миллион (кошка) 20000 частей на миллион (человек, 5 мин)[11] | ||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | TWA 1 ppm, ST 5 ppm[10] | ||
REL (Рекомендуемые) | Ca TWA 0,1 ppm ST 1 ppm[10] | ||
IDLH (Непосредственная опасность) | 500 частей на миллион[10] | ||
| Родственные соединения | |||
Родственные соединения | Толуол Боразин | ||
| Страница дополнительных данных | |||
| Показатель преломления (п), Диэлектрическая постоянная (εр), так далее. | |||
Термодинамический данные | Фазовое поведение твердое тело – жидкость – газ | ||
| УФ, ИК, ЯМР, РС | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Бензол является органический химическое соединение с молекулярная формула C6ЧАС6. Молекула бензола состоит из шести атомов углерода, объединенных в плоское кольцо, к каждому из которых присоединен один атом водорода. Поскольку бензол содержит только атомы углерода и водорода, он классифицируется как углеводород.[12]
Бензол является естественным компонентом сырая нефть и является одним из элементарных нефтехимия. Из-за циклической непрерывности пи-облигации между атомами углерода бензол классифицируется как ароматический углеводород. Иногда его сокращают Ph H. Бензол - это бесцветный и очень легковоспламеняющийся жидкость со сладким запахом, частично отвечает за аромат вокруг бензозаправочных станций. Он используется в основном как предшественник для производства химикатов с более сложной структурой, таких как этилбензол и кумол, из которых миллиарды килограммов производятся ежегодно. Несмотря на то, что бензол является основным промышленным химическим веществом, он находит ограниченное применение в потребительских товарах из-за его токсичности.[13]
История
Открытие
Слово «бензол» происходит от слова «бензоин камеди» (бензоиновая смола ), ароматическая смола, известная европейским фармацевтам и парфюмерам с 16 века как продукт из Юго-Восточной Азии.[14] Кислый материал был получен из бензоина сублимация, и назван «цветками бензоина» или бензойной кислоты. Таким образом, углеводород, полученный из бензойной кислоты, получил название бензин, бензол или бензол.[15] Майкл Фарадей впервые выделил и идентифицировал бензол в 1825 году из маслянистого остатка, полученного при производстве осветительного газа, что дало ему название бикарбюратор водорода.[16][17] В 1833 г. Эйльхард Митчерлих произвел это дистилляция бензойная кислота (из камедь бензоин ) и Лайм. Он дал составу название бензин.[18] В 1836 г. французский химик Огюст Лоран назвал вещество «фен»;[19] это слово стало корнем английского слова "фенол ", который гидроксилированный бензол и "фенил ", радикал, образованный отщеплением атома водорода (свободный радикал H •) из бензола.

В 1845 г. Чарльз Мэнсфилд, работая под Август Вильгельм фон Хофманн, выделил бензол из каменноугольная смола.[20] Четыре года спустя Мэнсфилд начал первое промышленное производство бензола на основе каменноугольного метода.[21][22] Постепенно среди химиков развилось мнение, что ряд веществ химически связаны с бензолом, составляя разнообразное химическое семейство. В 1855 году Хофманн использовал слово «ароматный «для обозначения этой семейной связи по характерному свойству многих ее членов.[23] В 1997 году бензол был обнаружен в глубоком космосе.[24]
Формула кольца
Эмпирическая формула бензола была известна давно, но в высшей степени полиненасыщенный структура, всего с одним водород атом для каждого углерод атом, было сложно определить. Арчибальд Скотт Купер в 1858 г. и Иоганн Йозеф Лошмидт в 1861 г.[31] предположил возможные структуры, содержащие несколько двойных связей или несколько колец, но тогда было доступно слишком мало доказательств, чтобы помочь химикам принять решение о какой-либо конкретной структуре.
В 1865 году немецкий химик Фридрих Август Кекуле опубликовал статью на французском языке (поскольку он тогда преподавал во франкоязычной Бельгии), предполагая, что структура содержит кольцо из шести атомов углерода с чередующимися одинарными и двойными связями. В следующем году он опубликовал на немецком языке гораздо более длинную статью по той же теме.[32][33] Кекуле использовал доказательства, накопленные за прошедшие годы, а именно то, что всегда, казалось, был только один изомер любой однопроизводный бензола, и что всегда было ровно три изомера каждого дизамещенного производного, которые теперь понимаются как соответствующие орто, мета и пара паттернам замена арена - аргументировать поддержку предлагаемой им структуры.[34] Симметричное кольцо Кекуле могло объяснить эти любопытные факты, а также соотношение углерода и водорода бензола 1: 1.
Новое понимание бензола и, следовательно, всех ароматических соединений оказалось настолько важным как для чистой, так и для прикладной химии, что в 1890 году Немецкое химическое общество организовало тщательно продуманное мероприятие в честь Кекуле, отметив двадцать пятую годовщину его первой статьи о бензоле. . Здесь Кекуле говорил о создании теории. Он сказал, что открыл кольцевую форму молекулы бензола после того, как ему приснилась змея, схватившая свой собственный хвост (это общий символ во многих древних культурах, известный как Уроборос или же Бесконечный узел ).[35] По его словам, это видение пришло к нему после многих лет изучения природы углерод-углеродных связей. Это было через 7 лет после того, как он решил проблему того, как атомы углерода могут связываться с четырьмя другими атомами одновременно. Любопытно, что подобное юмористическое изображение бензола появилось в 1886 году в брошюре под названием Berichte der Durstigen Chemischen Gesellschaft (Журнал Жажда химического общества), пародия на Berichte der Deutschen Chemischen Gesellschaft, только в пародии были обезьяны, схватившие друг друга по кругу, а не змеи, как в анекдоте Кекуле.[36] Некоторые историки предположили, что пародия была высмеиванием анекдота о змеях, возможно, уже хорошо известного в устной передаче, даже если она еще не была напечатана.[15] Речь Кекуле 1890 года[37] в котором появился этот анекдот, переведен на английский язык.[38] Если анекдот является воспоминанием о реальном событии, обстоятельства, упомянутые в рассказе, предполагают, что это должно было произойти в начале 1862 года.[39]
Цикличность бензола окончательно подтверждена исследованиями. кристаллограф Кэтлин Лонсдейл в 1929 г.[40][41]
Номенклатура
Немецкий химик Вильгельм Кёрнер предложил приставки орто-, мета-, пара- для различения дизамещенных производных бензола в 1867 г .; однако он не использовал префиксы, чтобы различать относительные положения заместителей в бензольном кольце.[42][43] Это был немецкий химик Карл Гребе которые в 1869 году впервые использовали префиксы орто-, мета-, пара- для обозначения конкретных относительных положений заместителей в дизамещенном ароматическом кольце (а именно, нафталина).[44] В 1870 году немецкий химик Виктор Мейер впервые применил номенклатуру Гребе к бензолу.[45]
Ранние приложения
В XIX и начале XX веков бензол использовали в качестве лосьона после бритья из-за его приятного запаха. До 1920-х годов бензол часто использовался в качестве промышленного растворителя, особенно для обезжиривание металл. Когда его токсичность стала очевидной, бензол был вытеснен другими растворителями, особенно толуол (метилбензол), который имеет аналогичные физические свойства, но не является канцерогенным.
В 1903 г. Людвиг Розелиус популяризировал использование бензола для без кофеина кофе. Это открытие привело к производству Санька. Позже этот процесс был прекращен. Бензол исторически использовался как важный компонент во многих потребительских товарах, таких как Жидкий ключ, несколько инструменты для снятия краски, резиновые цементы, пятновыводители и другие продукты. Производство некоторых из этих бензолсодержащих составов прекратилось примерно в 1950 году, хотя Liquid Wrench продолжала содержать значительные количества бензола до конца 1970-х годов.[46]
Вхождение
Следы бензола содержатся в нефти и угле. Это побочный продукт неполного сгорания многих материалов. Для коммерческого использования до Вторая Мировая Война, большая часть бензола была получена как побочный продукт кокс продукция (или «коксовый мазут») для стали промышленность. Однако в 1950-х годах спрос на бензол увеличился, особенно со стороны растущих полимеры промышленность, потребовала производства бензола из нефти. Сегодня большая часть бензола поступает из нефтехимическая промышленность, при этом лишь небольшая часть производится из угля.[47]
Структура

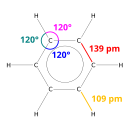
дифракция рентгеновских лучей показывает, что все шесть углерод-углеродных связей в бензоле имеют одинаковую длину - 140 пикометры (вечера).[48] C – C длина облигаций больше, чем двойная связь (135 мкм), но короче, чем одинарная связь (147 мкм). Это промежуточное расстояние соответствует электронному делокализация: электроны для связи C – C равномерно распределяются между каждым из шести атомов углерода. Бензол имеет 6 атомов водорода - меньше, чем соответствующий родительский алкан, гексан. Бензол имеет сходную форму с циклогексаном структурно, только цикл присоединения внутри бензола отличает его от циклогексана. Молекула плоская.[49] Описание молекулярной орбитали включает образование трех делокализованных π орбитали охватывающая все шесть атомов углерода, в то время как описание валентной связи включает суперпозицию резонансные структуры.[50][51][52][53] Вполне вероятно, что эта стабильность способствует специфическим молекулярным и химическим свойствам, известным как ароматичность. Чтобы точно отразить природу связи, бензол часто изображают с кругом внутри гексагонального расположения атомов углерода.
Производные бензола достаточно часто встречаются в составе органических молекул, что Unicode Консорциум выделил символ в Разное Техническое блок с кодом U + 232C (⌬), чтобы представить его с тремя двойными связями,[54] и U + 23E3 (⏣) для делокализованной версии.[55]
Производные бензола
Многие важные химические соединения получают из бензола путем замены одного или нескольких его атомов водорода другим. функциональная группа. Примеры простых производных бензола: фенол, толуол, и анилин, сокращенно PhOH, PhMe и PhNH2, соответственно. Соединение бензольных колец дает бифенил, С6ЧАС5–C6ЧАС5. Дальнейшая потеря водорода дает «плавленые» ароматические углеводороды, такие как нафталин, антрацен, фенантрен, и пирен. Предел процесса синтеза - это безводородный аллотроп углерода, графит.
В гетероциклы, атомы углерода в бензольном кольце замещаются другими элементами. Наиболее важные вариации содержат азот. Замена одного CH на N дает соединение пиридин, С5ЧАС5N. Хотя бензол и пиридин являются структурно связанные, бензол не может быть преобразован в пиридин. Замена второй связи CH на N дает, в зависимости от расположения второй N, пиридазин, пиримидин, или же пиразин.[56]
Производство
Четыре химических процесса способствуют промышленному производству бензола: каталитический риформинг, толуол гидродеалкилирование, диспропорционирование толуола и паровой крекинг. Согласно ATSDR Токсикологический профиль бензола в период с 1978 по 1981 год на долю каталитических продуктов риформинга приходилось примерно 44–50% от общего производства бензола в США.[47]
Каталитический риформинг
При каталитическом риформинге смесь углеводороды с температурой кипения 60–200 ° C смешивается с водород газа, а затем подверглись бифункциональный хлорид платины или же рений хлористый катализатор при 500–525 ° С и давлении 8–50 атм. В этих условиях алифатический углеводороды образуют кольца и теряют водород, превращаясь в ароматические углеводороды. Затем ароматические продукты реакции отделяют от реакционной смеси (или продукта риформинга) с помощью добыча с любым из ряда растворители, включая диэтиленгликоль гликоль или же сульфолан, а бензол затем отделяют от других ароматических углеводородов перегонкой. Стадия экстракции ароматических углеводородов из продукта риформинга предназначена для получения ароматических углеводородов с наименьшим содержанием неароматических компонентов. Извлечение ароматических углеводородов, обычно называемых BTX (бензол, толуол и изомеры ксилола), включает такие стадии экстракции и дистилляции.
Подобно этому каталитическому риформингу, UOP и BP коммерциализировал метод от сжиженного нефтяного газа (в основном пропана и бутана) до ароматики.
Гидродеалкилирование толуола
Толуол гидродеалкилирование обращает толуол к бензолу. В этом водородоемком процессе толуол смешивают с водородом, затем пропускают через хром, молибден, или же платина окись катализатор при 500–650 ° С и давлении 20–60 атм. Иногда вместо катализатора используются более высокие температуры (при аналогичных условиях реакции). В этих условиях толуол деалкилируется до бензола и метан:
- C6ЧАС5CH3 + H2 → С6ЧАС6 + CH4
Эта необратимая реакция сопровождается побочной реакцией равновесия, которая приводит кбифенил (также известный как дифенил) при более высокой температуре:
- 2 C
6ЧАС
6 ⇌ ЧАС
2 + C
6ЧАС
5–C
6ЧАС
5
Если поток сырья содержит много неароматических компонентов (парафинов или нафтенов), они, вероятно, разлагаются до низших углеводородов, таких как метан, что увеличивает потребление водорода.
Типичный выход реакции превышает 95%. Иногда, ксилолы и более тяжелые ароматические углеводороды используются вместо толуола с аналогичной эффективностью.
Это часто называют «целенаправленной» методологией производства бензола по сравнению с обычными процессами экстракции БТК (бензол-толуол-ксилол).
Диспропорционирование толуола
Толуол непропорциональность (TDP) - превращение толуола в бензол и ксилол.
Учитывая этот спрос на параграф-ксилол (п-ксилол ) значительно превышает спрос на другие изомеры ксилола, усовершенствование процесса TDP называется Выборочный TDP (STDP) можно использовать. В этом процессе поток ксилола, выходящий из установки TDP, составляет примерно 90%. п-ксилол. В некоторых системах даже соотношение бензола и ксилолов модифицировано в пользу ксилолов.
Паровой крекинг
Паровой крекинг это процесс производства этилен и другие алкены из алифатические углеводороды. В зависимости от сырья, используемого для производства олефинов, при паровом крекинге может образовываться богатый бензолом жидкий побочный продукт, называемый пиролизный бензин. Пиролизный бензин можно смешивать с другими углеводородами в качестве добавки к бензину или направлять через процесс экстракции для извлечения. BTX ароматические углеводороды (бензол, толуол и ксилолы).
Другие методы
Хотя они не имеют коммерческого значения, существует множество других путей получения бензола. Фенол и галобензолы восстанавливается металлами. Бензойная кислота и его соли подвергаются декарбоксилирование к бензолу. Через реакцию соединение диазония с гипофосфорная кислота анилин дает бензол. Тримеризация из ацетилен дает бензол.
Использует
Бензол используется в основном как промежуточный продукт для производства других химикатов, прежде всего этилбензол, кумол, циклогексан, нитробензол и алкилбензол. Более половины всего производимого бензола перерабатывается в этилбензол, прекурсор стирол, который используется для производства полимеров и пластиков, таких как полистирол и EPS. Около 20% производимого бензола используется для производства кумола, который необходим для производства фенол и ацетон для смол и клеев. Циклогексан потребляет около 10% мирового производства бензола; в основном он используется при производстве нейлоновых волокон, которые перерабатываются в текстиль и инженерные пластмассы. Меньшие количества бензола используются для производства некоторых видов каучуки, смазочные материалы, красители, моющие средства, наркотики, взрывчатка, и пестициды. В 2013 году крупнейшим потребителем бензола был Китай, за ним следовали США. Производство бензола в настоящее время расширяется на Ближнем Востоке и в Африке, тогда как производственные мощности в Западной Европе и Северной Америке стагнируют.[57]
Толуол в настоящее время часто используется вместо бензола, например, в качестве присадки к топливу. Свойства этих двух растворителей схожи, но толуол менее токсичен и имеет более широкий диапазон жидкостей. Толуол также перерабатывается в бензол.[58]

Компонент бензина
Как бензин (бензин) присадка, бензол увеличивает октановое число и уменьшает стучать. Как следствие, бензин часто содержал несколько процентов бензола до 1950-х годов, когда тетраэтилсвинец заменил его как наиболее широко используемую антидетонационную присадку. С глобальным отказом от этилированного бензина, бензол вернулся в качестве присадки к бензину в некоторых странах. в Соединенные Штаты, беспокойство по поводу его негативного воздействия на здоровье и возможности попадания бензола в грунтовые воды привели к строгому регулированию содержания бензола в бензине, обычно с пределами около 1%.[59] Европейские спецификации бензина теперь содержат такое же ограничение на содержание бензола в размере 1%. В Агентство по охране окружающей среды США в 2011 г. ввела новые правила, согласно которым содержание бензола в бензине было снижено до 0,62%.[60] Во многих европейских языках слово "нефть" или "бензин" является родственным словом "бензол".
Реакции
Наиболее распространенные реакции бензола включают замещение протона другими группами.[61] Электрофильное ароматическое замещение это общий метод дериватизации бензола. Бензол достаточно нуклеофильный что он подвергается замене на ацилий ионы и алкил карбокатионы давать замещенные производные.
 Электрофильное ароматическое замещение бензола
Электрофильное ароматическое замещение бензола
Наиболее распространенным примером такой реакции является этилирование бензола.
В 1999 году было произведено около 24 700 000 тонн.[62] Весьма поучительным, но гораздо менее промышленным значением является Алкилирование Фриделя-Крафтса бензола (и многих других ароматических колец) с помощью алкилгалогенид в присутствии сильного катализатора кислоты Льюиса. Точно так же Ацилирование Фриделя-Крафтса связанный пример электрофильное ароматическое замещение. Реакция включает ацилирование бензола (или многих других ароматических колец) с ацилхлорид используя сильный Кислота Льюиса катализатор Такие как хлорид алюминия или же Хлорид железа (III).

Сульфирование, хлорирование, нитрование
С помощью электрофильного ароматического замещения многие функциональные группы вводятся в бензольный каркас. Сульфирование бензола предполагает использование олеум, смесь серной кислоты с триоксид серы. Сульфированные производные бензола полезны моющие средства. В нитрование, бензол реагирует с ионами нитрония (NO2+), который является сильным электрофилом, получаемым при сочетании серной и азотной кислот. Нитробензол является предшественником анилин. Хлорирование достигается хлором с получением хлорбензол в присутствии катализатора на основе кислоты Льюиса, такого как трихлорид алюминия.
Гидрирование
Через гидрирование, бензол и его производные превращаются в циклогексан и производные. Эта реакция достигается за счет использования высоких давлений водород в присутствии гетерогенные катализаторы, например мелко разделенный никель. В то время как алкены можно гидрогенизировать при комнатной температуре, бензол и родственные соединения являются более устойчивыми субстратами, требующими температуры> 100 ° C. Эта реакция широко практикуется в промышленных масштабах. В отсутствие катализатора бензол непроницаем для водорода. Гидрирование нельзя остановить, чтобы получить циклогексен или циклогексадиены, поскольку они являются превосходными субстратами. Сокращение березы это некаталитический процесс, однако селективно гидрирует бензол до диена.
Металлические комплексы
Бензол - отличный лиганд в металлоорганический химия низковалентных металлов. Важными примерами являются, соответственно, сэндвич и полусэндвич комплексы, Cr (C6ЧАС6)2 и [RuCl2(C6ЧАС6)]2.
Влияние на здоровье

Бензол классифицируется как канцероген, который увеличивает риск рака и других заболеваний, а также является печально известной причиной отказа костного мозга. Значительное количество эпидемиологических, клинических и лабораторных данных связывает бензол с апластической анемией, острым лейкозом, аномалиями костного мозга и сердечно-сосудистыми заболеваниями.[63][64][65] Конкретные гематологические злокачественные новообразования, с которыми связан бензол, включают: острый миелоидный лейкоз (AML), апластическую анемию, миелодиспластический синдром (MDS), острый лимфобластный лейкоз (ALL) и хронический миелоидный лейкоз (CML).[66]
В Американский нефтяной институт (API) заявил в 1948 году, что «обычно считается, что единственная абсолютно безопасная концентрация бензола равна нулю».[67] Безопасного уровня воздействия не существует; даже небольшие количества могут причинить вред.[68] В Министерство здравоохранения и социальных служб США (DHHS) классифицирует бензол как человеческий канцероген. Длительное воздействие чрезмерного уровня бензола в воздухе вызывает лейкемия, потенциально смертельный рак кроветворных органов. Особенно, острый миелоидный лейкоз или же острый нелимфоцитарный лейкоз (AML и ANLL) не вызывает сомнений, что они вызваны бензолом.[69] МАИР оценило бензол как «известный как канцерогенный для человека» (Группа 1).
Поскольку бензол повсеместно присутствует в бензине и углеводородном топливе, которое используется повсеместно, воздействие бензола на человека является глобальной проблемой для здоровья. Бензол поражает печень, почки, легкие, сердце и мозг и может вызывать ДНК разрывы прядей, хромосомный повреждения и т. д. Бензол причины рак у животных, включая человека. Было показано, что бензол вызывает рак у обоих полов у нескольких видов лабораторных животных, подвергшихся воздействию различными путями.[70][71]
Воздействие бензола
Согласно Агентство регистрации токсичных веществ и заболеваний (ATSDR) (2007), бензол является химическим веществом, созданным человеком и естественным путем, в результате процессов, которые включают: извержения вулканов, лесные пожары, синтез химических веществ, таких как фенол, изготовление синтетические волокна, и изготовление каучуки, смазочные материалы, пестициды, лекарства и красители. Основными источниками воздействия бензола являются: табак дым, автозаправочные станции, выхлопные газы от автомобилей и промышленные выбросы; однако проглатывание и всасывание бензола через кожу может также происходить при контакте с загрязненной водой. Бензол метаболизируется в печени и выводится с моча. Измерение уровня бензола в воздухе и воде осуществляется путем сбора через активированный уголь трубки, которые затем анализируются с помощью газовый хроматограф. Измерение бензола у людей может быть выполнено с помощью моча, кровь, и дыхательные тесты; однако все они имеют свои ограничения, поскольку бензол быстро метаболизируется в организме человека.[72]
Воздействие бензола может постепенно привести к апластическому анемия, лейкемия, и множественная миелома.[73]
OSHA регулирует уровень бензола на рабочем месте.[74] Максимально допустимое количество бензола в воздухе рабочего помещения в течение 8-часового рабочего дня и 40-часовой рабочей недели составляет 1 ppm. Поскольку бензол может вызывать рак, NIOSH рекомендует всем работникам носить специальные дыхательное оборудование когда они могут подвергнуться воздействию бензола на уровнях, превышающих рекомендуемый (8-часовой) предел воздействия 0,1 ppm.[75]
Пределы воздействия бензола
В Агентство по охране окружающей среды США установил максимальный уровень загрязнения (MCL) для бензола в питьевая вода 0,005 мг / л (5 частей на миллиард), как указано в Национальных правилах США по первичной питьевой воде.[76] Это регулирование основано на предотвращении лейкемогенеза бензола. Целевой уровень максимального уровня загрязнения (MCLG), не имеющая юридической силы цель для здоровья, которая обеспечит адекватный запас безопасности для предотвращения неблагоприятных последствий, - это нулевая концентрация бензола в питьевой воде. EPA требует сообщать о разливах или случайных выбросах в окружающую среду 10 фунтов (4,5 кг) или более бензола.
Соединенные штаты. Управление по охране труда (OSHA) установил допустимый предел воздействия 1 часть бензола на миллион частей воздуха (1 ppm) на рабочем месте в течение 8-часового рабочего дня и 40-часовой рабочей недели. Предел кратковременного воздействия переносимого по воздуху бензола составляет 5 частей на миллион в течение 15 минут.[77] Эти правовые ограничения были основаны на исследованиях, демонстрирующих убедительные доказательства риска для здоровья рабочих, подвергающихся воздействию бензола. Риск от воздействия 1 ppm в течение всей рабочей жизни оценивается в 5 дополнительных смертей от лейкемии на 1000 подвергшихся воздействию сотрудников. (Эта оценка предполагает отсутствие порога канцерогенного воздействия бензола.) OSHA также установило уровень действия 0,5 ppm, чтобы стимулировать еще более низкое воздействие на рабочем месте.[78]
Соединенные штаты. Национальный институт охраны труда и здоровья (NIOSH) пересмотрел Немедленно опасно для жизни и здоровья (IDLH) для бензола до 500 ppm. Текущее определение NIOSH для состояния IDLH, приведенное в логике выбора респиратора NIOSH, представляет собой такое определение, которое представляет угрозу воздействия переносимых по воздуху загрязнителей, когда это воздействие может вызвать смерть, немедленные или отложенные необратимые неблагоприятные последствия для здоровья или предотвратить побег из таких окружающая среда [NIOSH 2004]. Целью определения значения IDLH является (1) обеспечение того, чтобы работник мог сбежать из данной загрязненной среды в случае отказа оборудования респираторной защиты, и (2) считается максимальным уровнем, выше которого только высоконадежный дыхательный аппарат допускается обеспечение максимальной защиты работников [NIOSH 2004[79]].[80] В сентябре 1995 года NIOSH выпустил новую политику по развитию рекомендуемые пределы воздействия (RELs) для веществ, включая канцерогены. Поскольку бензол может вызывать рак, NIOSH рекомендует всем работникам носить специальное дыхательное оборудование, когда они могут подвергнуться воздействию бензола на уровнях, превышающих REL (10-часовой) 0,1 ppm.[81] Предел кратковременного воздействия NIOSH (STEL - 15 мин) составляет 1 ppm.
Американская конференция государственных промышленных гигиенистов (ACGIH) приняла предельно допустимые значения (ПДК) для бензола при TWA 0,5 ppm и STEL 2,5 ppm.
Токсикология
Биомаркеры воздействия
Несколько тестов могут определить воздействие бензола. Сам бензол можно измерить в дыхании, крови или моче, но такое тестирование обычно ограничивается первыми 24 часами после воздействия из-за относительно быстрого удаления химического вещества путем выдоха или биотрансформации. У большинства людей в развитых странах есть измеримые базовые уровни бензола и других ароматических углеводородов нефти в крови. В организме бензол ферментативно превращается в ряд продуктов окисления, включая муконовая кислота, фенилмеркаптуровая кислота, фенол, катехол, гидрохинон и 1,2,4-тригидроксибензол. Большинство этих метаболитов имеют определенную ценность как биомаркеры воздействия на человека, поскольку они накапливаются в моче пропорционально степени и продолжительности воздействия и могут все еще присутствовать в течение нескольких дней после прекращения воздействия. Текущие пределы биологического воздействия ACGIH для профессионального воздействия составляют 500 мкг / г креатинина для муконовой кислоты и 25 мкг / г креатинина для фенилмеркаптуровой кислоты в образце мочи в конце смены.[82][83][84][85]
Биотрансформации
Даже если это не обычный субстрат для метаболизма, бензол может окисляться обоими бактерии и эукариоты. У бактерий диоксигеназа фермент может добавить кислород к кольцу, и неустойчивый продукт немедленно восстанавливается (путем НАДН ) к циклической диол с двумя двойными связями, нарушающими ароматичность. Затем диол вновь восстанавливается НАДН до катехол. Затем катехол метаболизируется до ацетил-КоА и сукцинил КоА, используется организмами в основном в Цикл лимонной кислоты для производства энергии.
Путь метаболизма бензола сложен и начинается в печени. Вовлечены несколько ферментов. К ним относятся цитохром P450 2E1 (CYP2E1), хинин оксидоредуктаза (NQ01 или DT-диафораза или НАД (Ф) Н дегидрогеназа (хинон 1) ), GSH и миелопероксидаза (MPO). CYP2E1 участвует в нескольких этапах: превращение бензола в оксепин (оксид бензола), фенол к гидрохинон и гидрохинон к бензолтриолу и катехол. Гидрохинон, бензолтриол и катехол превращаются в полифенолы. В костном мозге МПО превращает эти полифенолы в бензохиноны. Эти промежуточные продукты и метаболиты вызывают генотоксичность с помощью множества механизмов, включая ингибирование топоизомеразы II (которая поддерживает структуру хромосом), нарушение микротрубочек (которые поддерживают клеточную структуру и организацию), образование свободных радикалов кислорода (нестабильные виды), которые могут приводить к точечным мутациям, увеличивая окислительный стресс, вызывающий разрывы цепей ДНК и изменение метилирования ДНК (что может влиять на экспрессию генов). NQ01 и GSH изменяют метаболизм от токсичности. NQ01 метаболизирует бензохинон до полифенолов (противодействуя эффекту МПО). GSH участвует в образовании фенилмеркаптуровой кислоты.[66][86]
Генетический полиморфизм этих ферментов может вызывать потерю или усиление функции. Например, мутации в CYP2E1 увеличивают активность и приводят к увеличению образования токсичных метаболитов. Мутации NQ01 приводят к потере функции и могут привести к снижению детоксикации. Мутации миелопероксидазы приводят к потере функции и могут привести к снижению образования токсичных метаболитов. Мутации или делеции GSH приводят к потере функции и снижению детоксикации. Эти гены могут быть мишенями для генетического скрининга на предрасположенность к токсичности бензола.[87]
Молекулярная токсикология
Парадигма токсикологической оценки бензола смещается в область молекулярной токсикологии, поскольку она позволяет лучше понять фундаментальные биологические механизмы. Глутатион кажется, играет важную роль в защите от разрывов ДНК, вызванных бензолом, и считается новым биомаркером воздействия и воздействия.[88] Бензол вызывает хромосомные аберрации в лейкоцитах периферической крови и костном мозге, что объясняет более высокую заболеваемость лейкемией и множественной миеломой, вызванной хроническим воздействием. Эти аберрации можно отслеживать с помощью флуоресцентная гибридизация in situ (FISH) с ДНК-зондами для оценки эффектов бензола вместе с гематологическими тестами в качестве маркеров гематотоксичности.[89] В метаболизме бензола участвуют ферменты, кодируемые полиморфными генами. Исследования показали, что генотип в этих локусах может влиять на восприимчивость к токсическим эффектам воздействия бензола. Лица, несущие вариант NAD (P) H: хиноноксидоредуктазу 1 (NQO1), микросомальную эпоксидгидролазу (EPHX) и делецию глутатион-S-трансферазы T1 (GSTT1), показали более высокую частоту однонитевых разрывов ДНК.[90]
Биологическое окисление и канцерогенная активность
Один из способов понять канцерогенные эффекты бензола - изучить продукты биологического окисления. Например, чистый бензол окисляется в организме с образованием эпоксида, оксид бензола, который нелегко выводится из организма и может взаимодействовать с ДНК, вызывая вредные мутации.
Пути воздействия
Вдыхание
Наружный воздух может содержать низкие уровни бензола от автозаправочных станций, древесного дыма, табачного дыма, переносимого бензина, выхлопных газов автомобилей и промышленных выбросов.[91] Около 50% всего воздействия бензола по всей стране (США) происходит в результате курения табака или воздействия табачного дыма.[92] Выкуривая 32 сигареты в день, курильщик потребляет около 1,8 миллиграмма (мг) бензола. Это количество примерно в 10 раз превышает среднесуточное потребление бензола некурящими.[93]
Вдыхаемый бензол в основном выводится без изменений через выдох. В исследовании на людях от 16,4 до 41,6% оставшегося бензола выводилось через легкие в течение пяти-семи часов после двух-трехчасового воздействия от 47 до 110 частей на миллион, и только 0,07–0,2% оставшегося бензола выводилось в неизмененном виде в организме. моча. После воздействия 63–405 мг / м3 бензола в течение 1–5 часов от 51 до 87% выделялось с мочой в виде фенола за период от 23 до 50 часов. В другом исследовании на людях 30% абсорбированного бензола, нанесенного через кожу, который в основном метаболизируется в печени, выводится в виде фенола с мочой.[94]
Воздействие безалкогольных напитков
В определенных условиях и в присутствии других химикатов бензойная кислота (консервант) и аскорбиновая кислота (Витамин C) может взаимодействовать с образованием бензола. В марте 2006 г. официальный Агентство пищевых стандартов в Британия провели опрос 150 марок безалкогольных напитков. Было обнаружено, что в четырех концентрациях бензола выше Всемирная организация здоровья пределы. Пострадавшие партии были сняты с продажи. Об аналогичных проблемах сообщало FDA в США.[95]
Загрязнение водоснабжения
В 2005 году подача воды в г. Харбин в Китае с населением почти девять миллионов человек был отключен из-за сильного воздействия бензола.[96] Бензол просочился в Река Сунгари, поставляющий питьевую воду в город, после взрыв на заводе Китайской национальной нефтяной корпорации (CNPC) в городе Цзилинь 13 ноября 2005 г.
Убийство
В Нацисты использованный бензол, введенный через инъекция как один из их многих методов убийство.[97][98]
Смотрите также
- 6-членные ароматические кольца с заменой одного атома углерода другой группой: борабензол, бензол, силабензол, гермабензол, станнабензол, пиридин, фосфор, арсабензол, пирилиевая соль
- Департамент промышленного союза против Американского нефтяного института
- BTEX
Примечания
- ^ Критики указали на проблему с исходной структурой бензола Кекуле (1865): всякий раз, когда бензол подвергался замещению в орто-положении, должны были образоваться два различимых изомера, в зависимости от того, существует ли двойная связь или одинарная связь между атомами углерода, к которым относятся заместители. были прикреплены; однако таких изомеров не наблюдали. В 1872 году Кекуле предположил, что бензол имеет две взаимодополняющие структуры и что эти формы быстро взаимопревращаются, так что если бы между любой парой атомов углерода существовала двойная связь в один момент, эта двойная связь в следующий момент превратилась бы в одинарную (и наоборот). Чтобы обеспечить механизм процесса преобразования, Кекуле предположил, что валентность атома определяется частотой, с которой он сталкивается со своими соседями в молекуле. Когда атомы углерода в бензольном кольце сталкиваются друг с другом, каждый атом углерода сталкивается дважды с одним соседом в течение данного интервала, а затем дважды со своим другим соседом в течение следующего интервала. Таким образом, двойная связь будет существовать с одним соседом в течение первого интервала и с другим соседом в течение следующего интервала. Следовательно, между атомами углерода бензола не было фиксированных (т. Е. Постоянных) и отчетливых одинарных или двойных связей; вместо этого связи между атомами углерода были идентичными. Видеть страницы 86–89 Огюста Кекуле (1872) "Ueber einige Condensationsprodukte des Aldehyds" (О некоторых продуктах конденсации альдегидов), Annalen der Chemie und Pharmacie компании Liebig, 162(1): 77–124, 309–320. С п. 89: "Das einfachste Mittelaller Stöße eines Kohlenstoffatoms ergiebt sich aus der Summe der Stöße der beiden ersten Zeiteinheiten, die sich dann periodisch wiederholen.… Man sieht daher, daß jedes Kohlenstheberden ... ист. " (Простейшее среднее значение всех столкновений атома углерода [в бензоле] получается из суммы столкновений в течение первых двух единиц времени, которые затем периодически повторяются ... таким образом, можно видеть, что каждый атом углерода сталкивается одинаково часто с двумя другие, с которыми он сталкивается, [и], таким образом, находится в точно таких же отношениях с двумя своими соседями. Обычная структурная формула для бензола выражает, конечно, только столкновения, которые происходят во время один единицы времени, то есть в течение одной фазы, и поэтому можно прийти к мнению, что дважды замещенные производные [бензола] должны быть разными в положениях 1,2 и 1,6 [бензольного кольца]. Если только что представленную идею [или аналогичную] можно считать правильной, то [из этого] следует, что эта разница [между связями в положениях 1,2 и 1,6] является лишь кажущейся [одной ], а не настоящий [один].)
Рекомендации
- ^ а б Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. С. 10, 22, 204, 494, 577. Дои:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ Лиде, Д. Р., изд. (2005). CRC Справочник по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5.
- ^ Арнольд, Д .; Планка, C .; Эриксон, E .; Пайк, Ф. (1958). «Растворимость бензола в воде». Промышленная и инженерная химия Химическая и инженерная серия данных. 3 (2): 253–256. Дои:10.1021 / i460004a016.
- ^ Breslow, R .; Го, Т. (1990). «Измерения поверхностного натяжения показывают, что хаотропные засаливающие денатуранты не просто разрушают структуру воды». Труды Национальной академии наук Соединенных Штатов Америки. 87 (1): 167–9. Bibcode:1990ПНАС ... 87..167Б. Дои:10.1073 / pnas.87.1.167. ЧВК 53221. PMID 2153285.
- ^ Кокер, А. Кайоде; Людвиг, Эрнест Э. (2007). Прикладное проектирование процессов Людвига для химических и нефтехимических заводов. 1. Эльзевир. п. 114. ISBN 978-0-7506-7766-0. Получено 2012-05-31.
- ^ а б c d е "Бензол".
- ^ а б Атертон Зайделл; Уильям Ф. Линке (1952). Растворимость неорганических и органических соединений: сборник данных о растворимости из периодической литературы. Добавка. Ван Ностранд.
- ^ а б c Бензол в Linstrom, Peter J .; Маллард, Уильям Г. (ред.); Веб-книга NIST Chemistry, стандартная справочная база данных NIST номер 69, Национальный институт стандартов и технологий, Гейтерсбург (Мэриленд), http://webbook.nist.gov (Дата обращения 29 мая 2014)
- ^ а б c Сигма-Олдрич Co., Бензол. Проверено 29 мая 2014.
- ^ а б c Карманный справочник NIOSH по химической опасности. "#0049". Национальный институт охраны труда и здоровья (NIOSH).
- ^ "Бензол". Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Бензол - обзор | Темы ScienceDirect». www.sciencedirect.com. Получено 2020-11-25.
- ^ Фолкинс, Хиллис О. (2000). "Бензол". Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a03_475.
- ^ Слово «бензоин» происходит от арабского выражения «Любань Джави", или же "ладан из Ява ". Моррис, Эдвин Т. (1984). Аромат: история духов от Клеопатры до Шанель. Сыновья Чарльза Скрибнера. п. 101. ISBN 978-0684181950.
- ^ а б Рок, А. Дж. (1985). «Гипотеза и эксперимент на раннем этапе развития теории бензола Кекуле». Анналы науки. 42 (4): 355–81. Дои:10.1080/00033798500200411.
- ^ Фарадей, М. (1825). «О новых соединениях углерода и водорода и некоторых других продуктах, полученных при разложении нефти под действием тепла». Философские труды Королевского общества. 115: 440–466. Дои:10.1098 / рстл.1825.0022. JSTOR 107752. На страницах 443–450 Фарадей обсуждает «бикарбюратор водорода» (бензол). На страницах 449–450 он показывает, что эмпирическая формула бензола - C6ЧАС6, хотя он этого не осознает, потому что (как и большинство химиков того времени) использовал неправильную атомную массу для углерода (6 вместо 12).
- ^ Кайзер, Р. (1968). "Бикарбюратор водорода. Переоценка открытия бензола в 1825 году аналитическими методами 1968 года". Angewandte Chemie International Edition на английском языке. 7 (5): 345–350. Дои:10.1002 / anie.196803451.
- ^ Митчерлих, Э. (1834). "Über das Benzol und die Säuren der Oel- und Talgarten" [О бензоле, масляных и жирных кислотах]. Annalen der Pharmacie. 9 (1): 39–48. Дои:10.1002 / jlac.18340090103. В сноске на странице 43 редактор журнала Либих предложил изменить исходное название Мицчерлиха для бензола (а именно, «бензин») на «бензол», поскольку суффикс «-в» предполагает, что это алкалоид (например, Чинин ( хинин)), которым не является бензол, тогда как суффикс «-ол» предполагает, что он маслянистый, а это бензол. Так, на странице 44 Митчерлих заявляет: "Da diese Flüssigkeit aus der Benzoësäure gewonnen wird, und wahrscheinlich mit den Benzoylverbindungen im Zusammenhang steht, так что gibt man ihr am besten den Namen Benzol, da der Name Benzoïn schon für die mit dem Bitterhölthöböden" - это слово "Бензоин шон für die mit dem Bitterhölthöböden". (Поскольку эта жидкость [бензол] получается из бензойной кислоты и, вероятно, связана с бензоильными соединениями, лучшее название для нее - «бензол», поскольку название «бензоин» уже было выбрано Либихом и Велером для соединения, которое изомерный с маслом горького миндаля [бензальдегид].)
- ^ Лоран, Огюст (1836) "Sur la chlorophénise et les acides chlorophénisique et chlorophénèsique", Анналы химии и тела, т. 63, с. 27–45, см. п. 44: "Je donne le nom de phène au радикальный fondamental des acides précédens (φαινω, j'éclaire), puisque la benzine se Trouve dans le gaz de l'éclairage". (Я даю название «фен» (φαινω, я освещаю) основному радикалу предшествующих кислот, потому что бензол содержится в освещающем газе.)
- ^ Хофманн, А. В. (1845) "Ueber eine sichere Reaction auf Benzol" (О надежном тесте на бензол), Annalen der Chemie und Pharmacie, т. 55. С. 200–205; на стр. 204–205 Хофманн обнаружил бензол в каменноугольном масле.
- ^ Мэнсфилд Чарльз Блахфорд (1849). "Untersuchung des Steinkohlentheers". Annalen der Chemie und Pharmacie. 69 (2): 162–180. Дои:10.1002 / jlac.18490690203.
- ^ Чарльз Мэнсфилд подал (11 ноября 1847 г.) и получил (май 1848 г.) патент (№ 11 960) на фракционную перегонку каменноугольной смолы.
- ^ Хоффман, Август У. (1856). «Об инсолиновой кислоте». Труды Королевского общества. 8: 1–3. Дои:10.1098 / rspl.1856.0002.
Существование и способ образования инсолиновой кислоты доказывают, что к ряду одноосновных ароматических кислот Cn2ЧАСn2-8О4, самым низким из известных членов которой является бензойная кислота,….
[Примечание: эмпирические формулы органических соединений, которые появляются в статье Хофманна (стр. 3), основаны на атомной массе углерода 6 (вместо 12) и атомной массе кислорода 8 (вместо 16).] - ^ Чернихаро, Хосе; и другие. (1997), "Открытие C инфракрасной космической обсерваторией"4ЧАС2, С6ЧАС2, и бензол в CRL 618 ", Письма в астрофизический журнал, 546 (2): L123 – L126, Bibcode:2001ApJ ... 546L.123C, Дои:10.1086/318871
- ^ Клаус, Адольф К. (1867) «Теоретические соображения и их применение к классификационной схеме органической химии», Berichte über die Verhandlungen der Naturforschenden Gesellschaft zu Freiburg im Breisgau (Отчеты о работе Научного общества Фрайбурга в Брайсгау), 4 : 116-381. В разделе Aromatischen Verbindungen (ароматические соединения), стр. 315-347, Клаус представляет гипотетическую структуру Кекуле для бензола (п. 317 ), возражает против него, представляет альтернативную геометрию (п. 320 ) и заключает, что его альтернатива верна (стр.326 ). См. Также рисунки на п. 354 или же п. 379.
- ^ Дьюар Джеймс (1867). «Об окислении фенилового спирта и механическом устройстве, адаптированном для иллюстрации структуры ненасыщенных углеводородов». Труды Королевского общества Эдинбурга. 6: 82–86. Дои:10.1017 / S0370164600045387.
- ^ Ладенбург Альберт (1869). "Bemerkungen zur aromatischen Theorie" [Наблюдения по теории ароматики]. Berichte der Deutschen Chemischen Gesellschaft. 2: 140–142. Дои:10.1002 / cber.18690020171.
- ^ Армстронг Генри Э (1887). «Объяснение законов, управляющих замещением в случае бензоидных соединений». Журнал химического общества. 51: 258–268 [264]. Дои:10.1039 / ct8875100258.
- ^ Тиле, Йоханнес (1899) «Zur Kenntnis der ungesättigten Verbindungen» (О наших знаниях о ненасыщенных соединениях), Annalen der Chemie Юстуса Либиха306: 87–142; видеть: «VIII. Die aromatischen Verbindungen. Das Benzol». (VIII. Ароматические соединения. Бензол.), Стр. 125–129. Смотрите далее: Тиле (1901) "Zur Kenntnis der ungesättigen Verbindungen", Annalen der Chemie Юстуса Либиха, 319: 129–143.
- ^ В своей статье 1890 года Армстронг представил бензольные ядра в полициклических бензоидах, поместив внутри бензольных ядер букву «С», сокращение от слова «центрический». Центрические сродства (то есть связи) действуют в пределах обозначенного цикла атомов углерода. С п. 102: «… бензол, согласно этой точке зрения, на самом деле может быть представлен двойным кольцом». Видеть:
- Армстронг, Х. (1890). «Строение циклоидных углеводородов». Труды химического общества. 6: 101–105.
- Армит, Джеймс Уилсон; Робинсон, Роберт (1925). «Полиядерные гетероциклические ароматические типы. Часть II. Некоторые ангидрониевые основания». Журнал химического общества, Сделки. 127: 1604–1618. Дои:10.1039 / ct9252701604.
- Балабан, Александру Т .; Schleyer, Paul v. R .; Рзепа, Генри С. (2005). "Крокер, а не Армит и Робинсон, начните шесть ароматических электронов". Химические обзоры. 105 (10): 3436–3447. Дои:10.1021 / cr0300946. PMID 16218557.
- ^ Лошмидт, Дж. (1861). Chemische Studien (на немецком). Вена, Австро-Венгрия: Зон Карла Герольда. п. 30, 65.
- ^ Кекуле, Ф. (1865). "Sur la конституция ароматических веществ". Bulletin de la Société Chimique de Paris. 3: 98–110. На стр. 100, Кекуле предполагает, что атомы углерода бензола могут образовывать «chaîne fermée» (замкнутую цепь, петлю).
- ^ Кекуле, Ф. А. (1866). "Untersuchungen über aromatische Verbindungen (Исследования ароматических соединений)". Liebigs Annalen der Chemie und Pharmacie. 137 (2): 129–36. Дои:10.1002 / jlac.18661370202.
- ^ Рок, А. Дж. (2010). Образ и реальность: Кекуле, Копп и научное воображение. Издательство Чикагского университета. п. 186–227. ISBN 978-0226723358..
- ^ Прочтите, Джон (1995). От алхимии к химии. Нью-Йорк: Dover Publications. стр.179 –180. ISBN 9780486286907.
- ^ английский перевод Уилкокс, Дэвид Х .; Гринбаум, Фредерик Р. (1965). "Теория бензольных колец Кекуле: предмет для беззаботных шуток". Журнал химического образования. 42 (5): 266–67. Bibcode:1965JChEd..42..266W. Дои:10.1021 / ed042p266.
- ^ Кекуле, Ф. А. (1890). "Benzolfest: Rede". Berichte der Deutschen Chemischen Gesellschaft. 23: 1302–11. Дои:10.1002 / cber.189002301204.
- ^ Бенфей О. Т. (1958). «Август Кекуле и рождение структурной теории органической химии в 1858 году». Журнал химического образования. 35 (1): 21–23. Bibcode:1958JChEd..35 ... 21B. Дои:10.1021 / ed035p21.
- ^ Гиллис Джин (1966). «Огюст Кекуле и его сын, реализованный в Ганде 1858–1867 годов». Mémoires de la Classe des Sciences - Académie Royale des Sciences, des Lettres et des Beaux-arts de Belgique. 37 (1): 1–40.
- ^ Лонсдейл, К. (1929). «Строение бензольного кольца в гексаметилбензоле». Труды Королевского общества. 123A (792): 494–515. Bibcode:1929RSPSA.123..494L. Дои:10.1098 / RSPA.1929.0081.
- ^ Лонсдейл, К. (1931). «Рентгеновский анализ структуры гексахлорбензола с использованием метода Фурье». Труды Королевского общества. 133A (822): 536–553. Bibcode:1931RSPSA.133..536L. Дои:10.1098 / rspa.1931.0166.
- ^ Вильгельм Кёрнер (1867) "Faits pour servir à la détermination du lieu chimique dans la série aromatique" (Факты, которые необходимо использовать при определении химического положения в ароматическом ряду), Bulletins de l'Académie royale des Sciences, des lettres et des beaux-arts de Belgique, 2-я серия, 24 : 166–185; особенно см. стр. 169. Из стр. 169: «По разнице возможностей ces trois séries, dans lesquelles les dérivés bihydroxyliques ont leurs термины, соответствующие, par les prefixes ortho-, para- et mêta-». (Эти три ряда, в которых дигидроксипроизводные имеют соответствующие термины, легко отличить по приставкам орто-, пара- и мета.)
- ^ Герман фон Фелинг, изд., Neues Handwörterbuch der Chemie [Новый краткий химический словарь] (Брауншвейг, Германия: Friedrich Vieweg und Sohn, 1874), vol. 1, п. 1142.
- ^ Гребе (1869) "Ueber die Construction des Naphthalins" (О строении нафталина), Annalen der Chemie und Pharmacie, 149 : 20–28; особенно см. стр. 26.
- ^ Виктор Мейер (1870) "Untersuchungen über die Construction der zweifach-substituirten Benzole" (Исследования структуры дизамещенных бензолов), Annalen der Chemie und Pharmacie, 156 : 265–301; см. особенно стр. 299–300.
- ^ Уильямс, P.R.D .; Knutsen, J.S .; Аткинсон, С .; Madl, A.K .; Паустенбах, Д. (2007). «Концентрации бензола в воздухе, связанные с историческим использованием некоторых составов жидких гаечных ключей». Журнал гигиены труда и окружающей среды. 4 (8): 547–561. Дои:10.1080/15459620701446642. PMID 17558801. S2CID 32311057.
- ^ а б Хиллис О. Фолкинс (2005). "Бензол". Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a03_475. ISBN 978-3527306732.
- ^ Bacon, G.E .; Curry, N .; Уилсон, С. (12 мая 1964 г.). «Кристаллографическое исследование твердого бензола методом дифракции нейтронов». Труды Лондонского королевского общества. Серия A, Математические и физические науки. 279 (1376): 98–110. Bibcode:1964RSPSA.279 ... 98B. Дои:10.1098 / RSPA.1964.0092. JSTOR 2414835. S2CID 94432897.
- ^ Моран Д., Симмонетт А.С., Лич Ф.И., Аллен В.Д., Шлейер П.В., Шефер Х.Ф. (2006). «Популярные теоретические методы предсказывают, что бензол и арены непланарны». Журнал Американского химического общества. 128 (29): 9342–3. Дои:10.1021 / ja0630285. PMID 16848464.
- ^ Купер, Дэвид Л .; Геррат, Джозеф; Раймонди, Марио (1986). «Электронное строение молекулы бензола». Природа. 323 (6090): 699–701. Bibcode:1986Натура.323..699C. Дои:10.1038 / 323699a0. S2CID 24349360.
- ^ Полинг, Линус (1987). «Электронная структура молекулы бензола». Природа. 325 (6103): 396. Bibcode:1987Натура.325..396П. Дои:10.1038 / 325396d0. S2CID 4261220.
- ^ Мессмер, Ричард П .; Шульц, Питер А. (1987). «Электронное строение молекулы бензола». Природа. 329 (6139): 492. Bibcode:1987Натура.329..492М. Дои:10.1038 / 329492a0. S2CID 45218186.
- ^ Харкорт, Ричард Д. (1987). «Электронное строение молекулы бензола». Природа. 329 (6139): 491–492. Bibcode:1987Натура.329..491H. Дои:10.1038 / 329491b0. S2CID 4268597.
- ^ "Символ Юникода" BENZENE RING "(U + 232C)". fileformat.info. Получено 2009-01-16.
- ^ "Символ Юникода" BENZENE RING WITH CIRCLE "(U + 23E3)". fileformat.info. Получено 2009-01-16.
- ^ «Гетероциклическая химия: гетероциклические соединения». Университет штата Мичиган, Кафедра химии.
- ^ «Исследование рынка: бензол (2-е издание), Ceresana, август 2014 г.». ceresana.com. Получено 2015-02-10.
- ^ «Исследование рынка: толуол, Ceresana, январь 2015 г.». ceresana.com. Архивировано из оригинал на 2017-04-29. Получено 2015-02-10.
- ^ Кольмец, Джентри, Руководство по модернизации BTX, Весенняя конференция Айше 2007 г.
- ^ «Контроль опасных загрязнителей воздуха от мобильных источников». Агентство по охране окружающей среды США. 2006-03-29. п. 15853. Архивировано с оригинал на 2008-12-05. Получено 2008-06-27.
- ^ Стрэнкс, Д. Р .; М. Л. Хеффернан; К. К. Ли Доу; П. Т. Мактиг; Г. Р. А. Уизерс (1970). Химия: структурный взгляд. Карлтон, Виктория: Издательство Мельбурнского университета. п. 347. ISBN 978-0-522-83988-3.
- ^ Уэлч, Винсент А .; Фэллон, Кевин Дж .; Гелбке, Хайнц-Петер (2005). «Этилбензол». Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a10_035.pub2. ISBN 3527306730.
- ^ Каспер, Деннис Л.и другие. (2004) Принципы внутренней медицины Харрисона, 16-е изд., McGraw-Hill Professional, стр. 618, г. ISBN 0071402357.
- ^ Руководство Merck, домашнее издание, «Обзор лейкемии».
- ^ Бард, Д. (2014). «Загрязнение воздуха, связанное с дорожным движением, и начало инфаркта миокарда: раскрытие бензола в качестве триггера? Перекрестное исследование на небольшой территории». PLOS ONE. 9 (6): 6. Bibcode:2014PLoSO ... 9j0307B. Дои:10.1371 / journal.pone.0100307. ЧВК 4059738. PMID 24932584.
- ^ а б Смит, Мартин Т. (2010). «Достижения в понимании воздействия бензола на здоровье и его восприимчивости». Annu Rev Public Health. 31: 133–48. Дои:10.1146 / annurev.publhealth.012809.103646. ЧВК 4360999. PMID 20070208.
- ^ Американский институт нефти, токсикологический обзор API, бензол, сентябрь 1948 г., Агентство по токсичным веществам и регистру заболеваний, Министерство здравоохранения и социальных служб
- ^ Смит, Мартин Т. (01.01.2010). «Достижения в понимании воздействия бензола на здоровье и восприимчивости». Ежегодный обзор общественного здравоохранения. 31 (1): 133–148. Дои:10.1146 / annurev.publhealth.012809.103646. ЧВК 4360999. PMID 20070208.
- ^ ВОЗ. Международное агентство по изучению рака, Монографии МАИР по оценке канцерогенных рисков для людей, общие оценки канцерогенности: обновление монографий МАИР В архиве 2008-03-06 на Wayback Machine, Тома с 1 по 42, Приложение 7
- ^ Хафф Дж (2007). «Бензолиндуцированные раковые заболевания: краткий анамнез и влияние на профессиональное здоровье». Int J Occup Environ Health. 13 (2): 213–21. Дои:10.1179 / oeh.2007.13.2.213. ЧВК 3363002. PMID 17718179.
- ^ Rana SV; Верма Y (2005). «Биохимическая токсичность бензола». J Environ Biol. 26 (2): 157–68. PMID 16161967.
- ^ Агентство регистрации токсичных веществ и заболеваний. (2007). Бензол: информационный лист для пациента.
- ^ Yardley-Jones, A .; Андерсон, Д .; Парк, Д. В. (1991). «Токсичность бензола, его метаболизм и молекулярная патология в оценке риска для человека». Британский журнал промышленной медицины. 48 (7): 437–44. Дои:10.1136 / oem.48.7.437. ЧВК 1035396. PMID 1854646.
- ^ Стандарты безопасности и гигиены труда, токсичные и опасные вещества, 1910 г. 1028. Osha.gov. Проверено 23 ноября 2011.
- ^ Заявление об общественном здравоохранении для бензола, Агентство регистрации токсичных веществ и заболеваний. (Август 2007 г.). Бензол: информационный листок для пациента. Atsdr.cdc.gov (03.03.2011). Проверено 23 ноября 2011.
- ^ Загрязняющие вещества в питьевой воде | Органические химические вещества | Бензол. Water.epa.gov. Проверено 17 апреля 2014.
- ^ Информация о химическом отборе проб Бензол. Osha.gov. Проверено 23 ноября 2011.
- ^ Токсичность бензола: стандарты и правила | ATSDR - Экологическая медицина и санитарное просвещение в области окружающей среды - CSEM. Atsdr.cdc.gov (30 июня 2000 г.). Проверено 9 октября 2010.
- ^ Логика выбора респиратора NIOSH В архиве 2017-08-29 в Wayback Machine (Октябрь 2004 г.). Цинциннати, Огайо: Министерство здравоохранения и социальных служб США, Служба общественного здравоохранения, Центры по контролю заболеваний, Национальный институт охраны труда и здоровья, DHHS (NIOSH). Публикация № 2005-100.
- ^ Документация по концентрациям, непосредственно опасным для жизни или здоровья (IDLH): Введение. Cdc.gov. Проверено 23 ноября 2011.
- ^ «Заявление об охране здоровья населения от бензола». Агентство регистрации токсичных веществ и заболеваний. Министерство здравоохранения и социальных служб США, Служба общественного здравоохранения, Центры по контролю за заболеваниями, Национальный институт охраны труда и здоровья. Август 2007 г.. Получено 2011-11-23 - через Atsdr.cdc.gov.
- ^ Эшли, DL; Бонин, Массачусетс; Кардинали, Флорида; МакКроу, JM; Вутен, СП (1994). «Концентрации летучих органических соединений в крови среди населения США, не подвергавшегося профессиональному воздействию, и в группах с подозрением на воздействие» (PDF). Клиническая химия. 40 (7, п. 2): 1401–4. Дои:10.1093 / Clinchem / 40.7.1401. PMID 8013127.
- ^ Fustinoni S, Buratti M, Campo L, Colombi A, Consonni D, Pesatori AC, Bonzini M, Farmer P, Garte S, Valerio F, Merlo DF, Bertazzi PA (2005). «Моча t, t-муконовая кислота, S-фенилмеркаптуровая кислота и бензол как биомаркеры низкого воздействия бензола». Химико-биологические взаимодействия. 153–154: 253–6. Дои:10.1016 / j.cbi.2005.03.031. PMID 15935823.
- ^ ACGIH (2009). TLV и BEI 2009 г.. Американская конференция государственных гигиенистов, Цинциннати, Огайо.
- ^ Базельт, Р. (2008) Утилизация токсичных лекарств и химикатов у человека, 8-е издание, Биомедицинские публикации, Фостер-Сити, Калифорния, стр. 144–148, ISBN 0962652377.
- ^ Снайдер, Р. Хедли, К. (1996). «Обзор метаболизма бензола». Environ Health Perspect. 104 (Дополнение 6): 1165–1171. Дои:10.1289 / ehp.96104s61165. ЧВК 1469747. PMID 9118888.
- ^ Догерти, Д; Garte, S; Барховский, А; Змуда, Дж; Тайоли, Э (2008). «Полиморфизмы NQO1, MPO, CYP2E1, GSTT1 и STM1 и биологические эффекты воздействия бензола - обзор литературы». Письма токсикологии. 182 (1–3): 7–17. Дои:10.1016 / j.toxlet.2008.09.008. PMID 18848868.
- ^ Fracasso ME, Doria D, Bartolucci GB, Carrieri M, Lovreglio P, Ballini A, Soleo L, Tranfo G, Manno M (2010). «Низкие уровни бензола в воздухе: корреляция между биомаркерами воздействия и генотоксическими эффектами». Toxicol Lett. 192 (1): 22–8. Дои:10.1016 / j.toxlet.2009.04.028. PMID 19427373.
- ^ Eastmond, D.A .; Рупа, Д.С. Hasegawa, LS (2000). «Обнаружение гипердиплоидии и хромосомных разрывов в интерфазных лимфоцитах человека после воздействия бензольного метаболита гидрохинона с использованием многоцветной флуоресценции in situ гибридизации с ДНК-зондами». Mutat Res. 322 (1): 9–20. Дои:10.1016/0165-1218(94)90028-0. PMID 7517507.
- ^ Garte, S; Taioli, E; Попов, Т; Болоньези, С; Фермер, П; Мерло, Ф (2000). «Генетическая предрасположенность к токсичности бензола у людей». J Toxicol Environ Health A. 71 (22): 1482–1489. Дои:10.1080/15287390802349974. PMID 18836923. S2CID 36885673.
- ^ ToxFAQ для бензола, Агентство регистрации токсичных веществ и заболеваний, Департамент здравоохранения и социальных служб В архиве 2008-03-09 на Wayback Machine
- ^ ToxGuide для бензола, Агентство регистрации токсичных веществ и заболеваний, Департамент здравоохранения и социальных служб
- ^ Заявление об общественном здравоохранении. Бензол, Отдел токсикологии и экологической медицины, август 2007 г.
- ^ Бензол, CASRN: 71-43-2. Банк данных об опасных веществах, Национальная медицинская библиотека США. Национальные институты здоровья.
- ^ «FDA: слишком много бензола в некоторых напитках», CBS Новости, 19 мая 2006 г. Проверено 11 июля 2006 г.
- ^ «100 тонн загрязняющих веществ вылилось в китайскую реку». Хранитель. 25 ноября 2005 г.. Получено 7 января 2020.
- ^ «Отборы и смертельные уколы». Государственный музей Аушвиц-Биркенау. Получено 15 мая, 2020.
- ^ «Бывший нацистский трудовой лагерь в Австрии, теперь объявленный туристическим объектом». Гаарец. 3 мая 2019.
внешняя ссылка
| Схолия имеет химический профиль для Бензол. |
- Бензол в Периодическая таблица видео (Ноттингемский университет)
- Международная карта химической безопасности 0015
- Резюме USEPA по токсичности бензола
- Карманный справочник NIOSH по химической опасности
- Бензол из PubChem
- Департамент здравоохранения и социальных служб: TR-289: Исследования токсикологии и канцерогенеза бензола
- Видео подкаст сэра Джона Кадогана, читающего лекцию о бензоле со времен Фарадея в 1991 г.
- Профиль вещества
- Бензол в базе данных ChemIDplus
- Банк данных по опасным веществам NLM - Бензол