Соединение диазония - Diazonium compound

Соединения диазония или же соли диазония группа органические соединения разделяя общий функциональная группа R − N+
2Икс−
где R может быть любой органической группой, такой как алкил или арил, и X представляет собой неорганический или органический анион, такой как галоген.
Общие свойства и реакционная способность
Согласно приведенным в таблице константам линейной зависимости свободной энергии (например, Hammett σм и σп), группа диазония (N2+) является одним из наиболее сильно электроноакцепторных заместителей. Таким образом, α-положение разновидностей алкандиазония и кислых протонов на диазонио-замещенных фенолах и бензойных кислотах значительно снизило pKа значения по сравнению с их незамещенными аналогами. Например, водный pKа метандиазония оценивается в <10,[1] в то время как фенольный протон 4-гидроксибензолдиазония был измерен как 3,4.[2]
Что касается реакционной способности, в химии солей диазония преобладает их склонность к дедиазотированию посредством термодинамически (энтальпийно и энтропийно) благоприятного вытеснения газообразного азота. Реакция (MeN2+→ Я+ + N2) имеет изменение энтальпии 43 ккал / моль, а (EtN2+→ Et+ + N2) имеет изменение энтальпии 11 ккал / моль.[3] Для вторичных и третичных разновидностей алкандиазония энтальпическое изменение рассчитано как близкое к нулю или отрицательное, с минимальным активационным барьером для удаления азота. Следовательно, вторичные и (особенно) третичные виды алкандиазония являются либо несвязанными, несуществующими видами, либо, в лучшем случае, чрезвычайно быстротечными промежуточными продуктами.

Карбоксилат метилдиазония считается мимолетным промежуточным продуктом в метилировании карбоновых кислот посредством диазометан, и разновидности алкандиазония, образующиеся при диазотировании аминов, изучались в исследованиях в области физической органической химии.[4][5] Однако соли алкандиазония в остальном синтетически несущественны из-за их экстремального и неконтролируемого содержания SN2 / SN1 / E1 реактивность.
Напротив, соли арендиазония более стабильны, хотя при определенных условиях все еще опасно взрывоопасны, поскольку SN2 геометрически невозможно и не встречается, а SN1 возникает с гораздо большей трудностью по сравнению с разновидностями алкандиазония из-за трудности образования высокоэнергетического арильного катиона и более сильного C (sp2) –N по сравнению со связью C (sp3) –N связь в соединениях алкандиазония. Обычно хлоридную соль получают при 5 ° C из анилина и NaNO.2/ водн. HCl и ArN2+Cl– соли имеют свойство разлагаться (иногда со взрывом) при более высоких температурах. Однако использование неактивных окислительно-восстановительных и объемных HSO4–, BF4– , или ЦО– as counteranions позволила хранить соли арендиазония неограниченное время при 0 ° C и безопасно обращаться с ними в течение коротких периодов времени при температурах до 50 ° C. Соли арендиазония подвергаются SN1 (Ar) (диссоциативное мономолекулярное нуклеофильное ароматическое замещение) в некоторых случаях, в то время как большинство их реакций протекает с участием SRN1 (Ar) (диссоциативное радикальное нуклеофильное ароматическое замещение), в котором происходит первоначальный перенос электрона, позволяющий образовывать арильный радикал, а не катион.
Соли арендиазония - исключительно универсальные реагенты для химического синтеза. Поскольку арильные радикалы и катионы обладают высокой электрофильностью и будут реагировать практически с любым нуклеофильным реагентом, соли арендиазония образуют «транзитный узел» для химии аренов, из которого можно получить почти любое другое ароматическое производное. Более того, эта полезность подчеркивается их доступностью: соли арендиазония легко доступны при диазотировании ариламинов (анилинов и гетероариламинов), которые, в свою очередь, получают из исходного арена электрофильным нитрованием с последующим опосредованным или катализируемым металлом восстановлением.[6] После электрофильного ароматического замещения химия диазония является наиболее часто применяемой стратегией для получения ароматических соединений.
В промышленном отношении соли арендиазония являются важными промежуточными продуктами в органический синтез из азокрасители.[7]
Подготовка
Процесс образования диазониевых соединений называется «диазотированием», «диазонированием» или «диазотированием». О реакции впервые сообщил Питер Грисс в 1858 г., который впоследствии открыл несколько реакций этого нового класса соединений. Чаще всего соли диазония получают обработкой ароматических аминов азотистая кислота и дополнительная кислота. Обычно образуется азотистая кислота. на месте (в той же колбе) из нитрат натрия и избыток минеральная кислота (обычно водный HCl, H2ТАК4, п-ЧАС3CC6ЧАС4ТАК3H или HBF4):

Водные растворы солей хлорида диазония, традиционно получаемые из анилина, нитрита натрия и соляной кислоты, нестабильны при комнатной температуре и обычно готовятся при 0-5 ° C. Однако можно выделить соединения диазония в виде тетрафторборат или же тозилат соли,[8] которые являются стабильными твердыми веществами при комнатной температуре. Часто предпочтительно, чтобы соль диазония оставалась в растворе, но они имеют тенденцию к перенасыщать. Операторы были ранены или даже погибли в результате неожиданной кристаллизации соли с последующим ее взрывом.[9]
Из-за этих опасностей соединения диазония обычно не выделяют. Вместо этого они используются на месте. Этот подход иллюстрируется получением аренсульфонильного соединения:[10]
Реакции диазосочетания
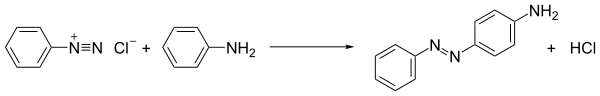
Наиболее распространенная реакция солей диазония - это азосоединение. В этом процессе соединение диазония атакуется богатыми электронами субстратами, т.е. соединяется с ними. Когда связывающими партнерами являются арены, такие как анилины и фенолы, процесс является примером электрофильное ароматическое замещение:
Другим коммерчески важным классом связывающих партнеров являются ацетоуксусные амиды, как показано на препарате Pigment Yellow 12, a диарилидный пигмент.[11]
Результирующий азосоединения часто бывают полезными красителями и на самом деле их называют азокрасители.[12] Глубокие цвета красок отражают их расширенные спряжение. Например, краситель под названием анилиновый желтый производится путем смешивания анилин и холодный раствор соли диазония, а затем его энергично встряхивают. Анилиновый желтый получают в виде желтого твердого вещества.[13] Точно так же холодный щелочной раствор Нафтален-2-ол (бета-нафтол) дает интенсивный оранжево-красный осадок.[13] Метиловый апельсин это пример азокрасителя, который используется в лаборатории в качестве индикатор pH.
Смещение N2 группа
Катионы арендиазония претерпевают несколько реакций, в которых N2 группа заменяется другой группой или ионом. Некоторые из основных из них следующие.[14][15]
Биариловая муфта
Пара катионов диазония может быть соединена с образованием биарилы. Это преобразование иллюстрируется соединением соль диазония происходит от антраниловая кислота давать дифеновая кислота ((C6ЧАС4CO2ЧАС)2).[16] В родственной реакции та же соль диазония теряет N2 и CO2 давать бензин.[17]
Замена на Halides
Реакция Сандмейера
Хлорид бензолдиазония, нагретый с хлоридом меди или бромидом меди, растворенным в HCl или HBr соответственно. хлорбензол или же бромбензол, соответственно.
Реакция Гаттермана
В реакции Гаттермана хлорид бензолдиазония нагревают с медным порошком и HCl или HBr для получения хлорбензола и бромбензола соответственно. Он назван в честь немецкого химика. Людвиг Гаттерманн.[18]
Замена йодидом
Йод нелегко ввести непосредственно в бензольное кольцо. Однако его можно ввести путем обработки катионов арендиазония йодистый калий:
Замена фторидом
Фторбензол образуется при термическом разложении бензолдиазония фторборат. Преобразование называется Реакция Бальца-Шимана.[19]
Традиционная реакция Бальца-Шимана была предметом множества мотивов, например: с использованием гексафторфосфатов (PF6−) и гексафторантимонат (SbF6−) вместо тетрафторборатов. Диазотирование можно проводить с помощью солей нитрозония, таких как [NO] SbF6.[20]
Разные замены
Замена водородом
Катионы арендиазония восстанавливаются гипофосфорная кислота,[21] этиловый спирт или же станнит натрия дает бензол:
Замена гидроксильной группой
Фенолы получают нагреванием водных растворов солей арендиазония:[22][23][24][25]
Эта реакция носит немецкое название Phenolverkochung («приготовление с получением фенолов»). Образовавшийся фенол может реагировать с солью диазония, и, следовательно, реакция протекает в присутствии кислоты, которая подавляет эту дальнейшую реакцию.[26] Гидроксилирование по типу Сандмейера также возможно с использованием Cu2O и Cu2+ в воде.
Замена нитрогруппой
Нитробензол может быть получен обработкой фторбората бензолдиазония нитрат натрия в присутствии меди. В качестве альтернативы диазотизация анилина может проводиться в присутствии закиси меди, которая генерирует нитрит меди in situ:
Замена на цианогруппу
Цианогруппа обычно не может быть введена нуклеофильным замещением галоарены, но такие соединения можно легко получить из солей диазония. Показательным является приготовление бензонитрил используя реагент цианид меди:
Эта реакция - особый тип Реакция Сандмейера.
Замена трифторметильной группой
Две исследовательские группы сообщили о трифторметилировании солей диазония в 2013 году. Гуссен сообщил о получении CuCF.3 комплекс из CuSCN, TMSCF3, а Cs2CO3. Напротив, Fu сообщил о трифторметилировании с использованием реагента Умемото (S-трифторметилдибензотиофения тетрафторборат) и порошок Cu (условия типа Гаттермана). Их можно описать следующим уравнением:
Скобка указывает на то, что другие лиганды на меди, вероятно, присутствуют, но опущены.
Замена тиоловой группой
Соли диазония можно превратить в тиолы в два этапа. Лечение бензолдиазония хлорида с этилксантат калия с последующим гидролизом промежуточного ксантогенатного эфира дает тиофенол:
Замена арильной группой
Арильная группа может быть связана с другой с использованием солей арендиазония. Например, лечение бензолдиазония хлорид с бензолом (ароматическое соединение) в присутствии гидроксида натрия дает дифенил:
Эта реакция известна как Реакция Гомберга – Бахмана. Подобное преобразование также достигается обработкой хлорида бензолдиазония этиловый спирт и медный порошок.
Замена боронатной эфирной группой
Группа Bpin (пинаколатобор), используемая в Кросс-муфта Suzuki-Miyaura реакции, можно установить реакцией диазониевой соли с бис (пинаколато) дибороном в присутствии пероксида бензоила (2 мол.%) в качестве инициатора:[27] . Альтернативно подобное борилирование может быть достигнуто с использованием карбонильных комплексов переходных металлов, включая декакарбонил диманганца.[28]
- C6ЧАС5N2+Икс– + pinB – Bpin → C6ЧАС5Bpin + X – Bpin + N2
Реакция Меервейна
Хлорид бензолдиазония реагирует с соединениями, содержащими активированные двойные связи для производства фенилированных продуктов. Реакция называется Меервейн арилирование:
Металлические комплексы
Катионы диазония в своих реакциях с комплексами металлов ведут себя аналогично NO.+. Например, комплексы низковалентных металлов добавляют с солями диазония. Иллюстративные комплексы [Fe (CO)2(PPh3)2(N2Ph)]+ и хиральный по отношению к металлу комплекс Fe (CO) (NO) (PPh3) (N2Ph).[29]
Другие методы дедиазотизации
- к органическое восстановление загар электрод
- мягкими восстановителями, такими как аскорбиновая кислота (Витамин С )[30]
- к гамма-излучение из сольватированные электроны генерируется в воде
- фотоиндуцированный перенос электронов
- восстановление катионами металлов, чаще всего медь соль.
- анион-индуцированная дедиазониация: противоион, такой как йод, передает электрон на катион диазония, образуя арильный радикал и йодный радикал
- индуцированная растворителем дедиазониация с растворитель служащий донором электронов
Реакции прививки
В потенциальном приложении в нанотехнологии, соли диазония 4-хлорбензолдиазонийтетрафторборат очень эффективно функционализирует одностенные нанотрубки.[31] Чтобы расслаиваться нанотрубки, они смешаны с ионная жидкость в Ступка и пестик. Соль диазония добавляется вместе с карбонат калия, а после измельчения смеси при комнатная температура Поверхность нанотрубок покрыта хлорфенильными группами с эффективностью 1 из 44 атомов углерода. Эти добавленные заместители предотвращают образование тесных пучков трубок из-за большого силы сцепления между ними, что является постоянной проблемой в технологии нанотрубок.
Также возможно функционализировать кремниевые пластины с солями диазония, образующими арил монослой. В одном исследовании поверхность кремния промывалась фтористый водород аммония оставляя его покрытым кремний-водородными связями (гидридная пассивация).[32] Реакция поверхности с раствором соли диазония в ацетонитрил 2 часа в темноте - это спонтанный процесс через свободный радикал механизм:[33]
Пока что прививка солей диазония на металлы выполнена на утюг, кобальт, никель, платина, палладий, цинк, медь и золото поверхности.[34] Сообщалось также о прививке к алмазным поверхностям.[35] Возникает один интересный вопрос - это фактическое положение арильной группы на поверхности. An in silico изучать [36] демонстрирует, что в период 4 элемента от титана до меди энергия связи уменьшается слева направо, потому что количество d-электронов увеличивается. Металлы слева от железа расположены под наклоном или плоско на поверхности, отдавая предпочтение металлу углероду. пи бонд образования, а те, что справа от железа, расположены в вертикальном положении, предпочитая металл углероду сигма-облигация формирование. Это также объясняет, почему прививка соли диазония до сих пор была возможна с теми металлами, которые расположены справа от железа в периодическая таблица.
Восстановление до гидразиновой группы
Соли диазония можно восстановить с помощью хлорид олова (SnCl2) к соответствующему гидразин производные. Эта реакция особенно полезна в Синтез индола по Фишеру из триптан соединения и индометацин. Использование дитионит натрия является улучшением по сравнению с хлоридом олова, поскольку это более дешевый восстановитель с меньшими экологическими проблемами.
Биохимия
Алкандиазоний ионы, которые редко встречаются в органической химии, считаются возбудителями канцерогенов. Конкретно, нитрозамины Считается, что они подвергаются метаболической активации с образованием разновидностей алкандиазония.
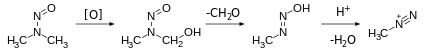
Приложения
Первое использование солей диазония заключалось в производстве водостойких окрашенных тканей путем погружения ткани в водный раствор соединения диазония с последующим погружением в раствор связующего вещества (богатое электронами кольцо, которое подвергается электрофильному замещению). Основное применение соединений диазония остается в производстве красителей и пигментов.[12]
Другое использование
Соединения диазония - стандартные реагенты, используемые в синтез органических соединений, особенно производные арила.
Соли диазония светочувствительны и разрушаются под воздействием УФ или фиолетовый свет. Это свойство привело к их использованию при воспроизведении документов. В этом процессе бумага или пленка покрываются солью диазония. После контактного воздействия на свету остаточный диазо превращается в стабильный азокраситель с водным раствором связующего. В более распространенном процессе используется бумага, покрытая диазо, связующим веществом и кислотой для предотвращения связывания; после экспонирования изображение проявляется паровой смесью аммиак и вода, которая усиливает сцепление.
Безопасность
Твердые галогениды диазония часто опасно взрывоопасны, и сообщалось о смертельных случаях и травмах.[9]
Природа анионов влияет на стабильность соли. Перхлораты арендиазония, такие как перхлорат нитробензолдиазония, использовались для инициирования взрывчатых веществ.
Смотрите также
Рекомендации
- ^ Фэй, На; Заутер, Василий; Джиллингем, Деннис (2016). «PK a кислот Бренстеда контролирует их реакционную способность с диазосоединениями». Химические коммуникации. 52 (47): 7501–7504. Дои:10.1039 / C6CC03561B. PMID 27212133.
- ^ Д. Браво-Диас, Карлос (2010-10-15), «Диазогидроксиды, диазоэфиры и родственные виды», в Раппопорте, Цви (ред.), Химия функциональных групп PATai, John Wiley & Sons, Ltd, Дои:10.1002 / 9780470682531.pat0511, ISBN 9780470682531
- ^ Кэри, Фрэнсис А. (2007). Продвинутая органическая химия. Сандберг, Ричард Дж. (5-е изд.). Нью-Йорк: Спрингер. ISBN 9780387448978. OCLC 154040953.
- ^ Штрейтвизер, Эндрю; Шеффер, Уильям Д. (июнь 1957 г.). «Стереохимия первичного углерода. VI. Реакция оптически активного 1-аминобутана-1-d с азотистой кислотой. Механизм реакции амин-азотистая кислота1». Журнал Американского химического общества. 79 (11): 2888–2893. Дои:10.1021 / ja01568a054.
- ^ Фридман, Лестер; Jurewicz, Anthony T .; Бэйлесс, Джон Х. (март 1969). «Влияние растворителя на ионные равновесия диазоалкан-алкандиазоний при дезаминировании аминов». Журнал Американского химического общества. 91 (7): 1795–1799. Дои:10.1021 / ja01035a032.
- ^ Норман, Р. О. (Ричард Освальд Чандлер) (2017). Принципы органического синтеза (3-е изд.). CRC Press. ISBN 9780203742068. OCLC 1032029494.
- ^ Химия диазония и диазогрупп. Часть 1. Патай С. Под ред. 1978 Wiley-Blackwell. ISBN 0-471-99492-8. Химия диазония и диазогрупп. Часть 2. Патай С. / Под ред. 1978 Wiley-Blackwell. ISBN 0-471-99493-6.
- ^ Филимонов Виктор Д .; Трусова, Марина; Постников, Павел; Краснокутская Елена А .; Ли, Ён Мин; Хван, Хо Юн; Ким, Хёнук; Чи, Ки-Ван (18 сентября 2008 г.). «Необычно стабильные, универсальные и чистые тозилаты арендиазония: их получение, структуры и синтетическая применимость». Органические буквы. 10 (18): 3961–3964. Дои:10.1021 / ol8013528. ISSN 1523-7060. PMID 18722457.
- ^ а б «Отчет об инциденте с CRHF в Великобритании - Перенасыщенная соль диазония вызывает летальный исход». Форум опасностей химических реакций Великобритании. Архивировано из оригинал 6 октября 2018 г.. Получено 13 мая 2010.
- ^ Р. В. Хоффман (1981). «м-Трифторметилбензолсульфонилхлорид». Орг. Синтезатор. 60: 121. Дои:10.15227 / orgsyn.060.0121.
- ^ К. Голод. W. Herbst "Пигменты, органические" в Энциклопедия промышленной химии Ульмана, Wiley-VCH, Weinheim, 2012. Дои:10.1002 / 14356007.a20_371
- ^ а б Клаус Хунгер, Петер Мишке, Вольфганг Рипер, и другие. «Азокрасители» в Энциклопедии промышленной химии Ульмана, 2005, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a03_245.
- ^ а б Кларк, Джим. "химгид". Получено 28 сентября 2011.
- ^ Марч, Дж. «Продвинутая органическая химия», 4-е изд. Дж. Вили и сыновья, 1992: Нью-Йорк. ISBN 978-0-471-60180-7.
- ^ Мэри Энн Фокс; Джеймс К. Уайтселл (2004). Органическая химия (3, иллюстрированное изд.). Джонс и Бартлетт Обучение. С. 535–538. ISBN 978-0-7637-2197-8.
- ^ Аткинсон, Э. Р .; Лоулер, Х. Дж. (1927). «Дифеновая кислота». Органический синтез. 7: 30. Дои:10.15227 / orgsyn.007.0030.
- ^ Логулло, Ф. М .; Зейтц, А. Х .; Фридман, Л. (1968). «Бензолдиазоний-2-карбокси- и бифенилен». Органический синтез. 48: 12. Дои:10.15227 / orgsyn.048.0012.
- ^ Л. Гаттерманн (1894). "Untersuchungen über Diazoverbindungen". Berichte der Deutschen Chemischen Gesellschaft. 23 (1): 1218–1228. Дои:10.1002 / cber.189002301199.
- ^ Флуд, Д. Т. (1933). «Фторбензол». Орг. Синтезатор. 13: 46. Дои:10.15227 / orgsyn.013.0046..
- ^ Фуруя, Такеру; Кляйн, Йоханнес Э. М. Н .; Риттер, Тобиас (2010). «Образование связи C – F для синтеза арилфторидов». Синтез. 2010 (11): 1804–1821. Дои:10.1055 / с-0029-1218742. ЧВК 2953275. PMID 20953341.
- ^ Райнхард Брукнер, изд. Майкл Хармата; Органические механизмы, реакции, стереохимия и синтез, 3-е изд., Стр.246, ISBN 978-3-8274-1579-0
- ^ Х. Э. Унгнаде, Э. Ф. Орволл (1943). «3-Бром-4-гидрокситолуол». Органический синтез. 23: 11. Дои:10.15227 / orgsyn.023.0011.
- ^ Казем-Ростами, Масуд (2017). «Легкое приготовление фенола». Synlett. 28 (13): 1641–1645. Дои:10.1055 / с-0036-1588180.
- ^ Кэри, Ф. А .; Сандберг, Р. Дж. (2007). Продвинутая органическая химия. Vol. B, Глава 11: Springer. стр.1028.CS1 maint: location (ссылка на сайт)
- ^ Хазаеи, Ардешир; Казем-Ростами, Масуд; Заре, Абдолкарим; Мусави-Заре, Ахмад Реза; Садехпур, Махдиа; Афхами, Аббас (2013). «Синтез, характеристика и применение полисульфона на основе триазена в качестве адсорбента красителя». Журнал прикладной науки о полимерах. 129 (6): 3439–3446. Дои:10.1002 / app.39069.
- ^ Р. Х. Ф. Манске (1928). "м-Нитрофенол ». Органический синтез. 8: 80. Дои:10.15227 / orgsyn.008.0080.
- ^ Ву, Цзе; Гао, Юэцю; Цю, Гуаньиньшэн; Он, Линман (2014-08-20). «Удаление аминогрупп из анилинов посредством реакций на основе диазониевой соли». Органическая и биомолекулярная химия. 12 (36): 6965–6971. Дои:10.1039 / C4OB01286K. ISSN 1477-0539. PMID 25093920.
- ^ Фэрламб, Ян; Ферт, Джеймс Д .; Хаммарбэк, Л. Андерс; Burden, Thomas J .; Иствуд, Джонатан Б.; Дональд, Джеймс Р .; Horbaczewskyj, Chris S .; МакРоби, Мэтью Т .; Tramaseur, Адам; Кларк, Ян П .; Таури, Майкл; Робинсон, Алан; Кригер, Жан-Филипп; Линам, Джейсон М. (2020). «Инициированное светом и марганцем биорилирование арилдиазониевых солей: механистическое понимание сверхбыстрой шкалы времени, выявленное с помощью спектроскопического анализа с временным разрешением». Химия - Европейский журнал. Дои:10.1002 / chem.202004568. PMID 33135818.
- ^ Саттон, Д. (1993). «Металлоорганические диазосоединения». Chem. Rev. 93 (3): 905–1022. Дои:10.1021 / cr00019a008.
- ^ Пиначо Крисостомо Фернандо (2014). «Аскорбиновая кислота как инициатор прямого C-H арилирования (гетеро) аренов с помощью нитрозированных анилинов in situ». Angewandte Chemie International Edition. 53 (8): 2181–2185. Дои:10.1002 / anie.201309761. PMID 24453180.
- ^ Прайс, Б. Кэтрин (2005). «Зеленая химическая функционализация одностенных углеродных нанотрубок в ионных жидкостях». Журнал Американского химического общества. 127 (42): 14867–14870. Дои:10.1021 / ja053998c. PMID 16231941.
- ^ Майкл П. Стюарт; Франсиско Майя; Дмитрий В. Косынкин; и другие. (2004). «Прямая ковалентная прививка сопряженных молекул на поверхности Si, GaAs и Pd из солей арендиазония». Варенье. Chem. Soc. 126 (1): 370–8. Дои:10.1021 / ja0383120. PMID 14709104.
- ^ Последовательность реакций: реакция поверхности кремния с фтористый водород аммония создает гидрид слой. Электрон переносится с поверхности кремния на соль диазония в потенциал холостого хода восстановление, оставляющее кремний катион-радикал и диазониевый радикал. На следующем этапе протон и молекула азота удаляются, и два радикальных остатка рекомбинируют, создавая поверхностную связь кремний-углерод.
- ^ Беланже, Даниэль; Пинсон, Жан (2011). «Электрографика: мощный метод модификации поверхности». Обзоры химического общества. 40 (7): 3995–4048. Дои:10.1039 / c0cs00149j. ISSN 0306-0012. PMID 21503288.
- ^ S.Q. Луд; М. Стинакерс; П. Бруно; и другие. (2006). «Химическая прививка бифенильных самоорганизующихся монослоев на ультрананокристаллическом алмазе». Варенье. Chem. Soc. 128 (51): 16884–91. Дои:10.1021 / ja0657049. PMID 17177439.
- ^ Де-эн Цзян; Бобби Г. Самптер; Шэн Дай (2006). «Структура и связь между арильной группой и металлическими поверхностями». Варенье. Chem. Soc. 128 (18): 6030–1. Дои:10.1021 / ja061439f. PMID 16669660.
- ^ Tricker, A.R .; Preussmann, R. (1991). «Канцерогенный N-Нитрозамины в пище: возникновение, образование, механизмы и канцерогенный потенциал ». Мутационные исследования / генетическая токсикология. 259 (3–4): 277–289. Дои:10.1016/0165-1218(91)90123-4. PMID 2017213.
реакция диазосочетания
внешняя ссылка
- W. Reusch. «Реакции аминов». Виртуальный текст органической химии. Университет штата Мичиган. Архивировано из оригинал 12 декабря 2012 г.










![{ Displaystyle { ce {[C6H5N + 2] BF4- -> C6H5F + BF3 + N2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/98854fdc1405b490fdd0d68f060887ff90168c5b)
![{ Displaystyle { ce {[C6H5N2 +] Cl- + H3PO2 + H2O -> C6H6 + N2 + H3PO3 + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae4fe80352442662e0e0ea86f444c2e7e154a36a)
![{ Displaystyle { ce {[C6H5N2 +] Cl- + CH3CH2OH -> C6H6 + N2 + CH3CHO + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1fd6aff8b1cca4b87fa0f2eb030d2df4b7521ff8)



![{ Displaystyle { ce {C6H5N2 + + [CuCF3] -> C6H5CF3 + [Cu] + + N2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/186b334438ab68ac9d7c76d6da6d2c60b3bbf50d)


![{ Displaystyle { ce {[C6H5N2 +] Cl- + C6H6 -> C6H5-C6H5 + N2 + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/62f872781ba025ad2794380235783323c9a464c9)
![{ displaystyle { ce {[C6H5N + 2] Cl- + ArCH = CHCOOH -> ArC = C-C6H5 + N2 + CO2 + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c56c56d4d1da0b2573f3464b3f344c9c72cbf35e)