Фторбензол - Fluorobenzene
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Фторбензол | |||
| Другие имена Фенил фторид Монофторбензол | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.006.657 | ||
| КЕГГ | |||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C6ЧАС5F | |||
| Молярная масса | 96.103 | ||
| Внешность | Бесцветная жидкость | ||
| Плотность | 1,025 г / мл, жидкость | ||
| Температура плавления | -44 ° С (-47 ° F, 229 К) | ||
| Точка кипения | От 84 до 85 ° C (от 183 до 185 ° F, от 357 до 358 K) | ||
| низкий | |||
| -58.4·10−6 см3/ моль | |||
| Структура | |||
| Планарный | |||
| Опасности | |||
| R-фразы (устарело) | R36, R37, R38 | ||
| S-фразы (устарело) | S16, S26, S36 | ||
| NFPA 704 (огненный алмаз) | |||
| Родственные соединения | |||
Родственные галобензолы | Хлорбензол Бромбензол Йодобензол | ||
Родственные соединения | Бензол 1,2-дифторбензол | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Фторбензол это химическое соединение с формулой C6ЧАС5F, часто сокращенно Ph F. Бесцветная жидкость, это предшественник многих фторфенильных соединений.
Подготовка
Впервые о PhF сообщил в 1886 г. О. Валлах на Боннский университет, который приготовил соединение в два этапа. Фенилдиазоний хлорид впервые был преобразован в триазен с использованием пиперидина:
- [PhN2] Cl + 2 (CH2)5NH → PhN = N-N (CH2)5 + [(CH2)5NH2] Cl
Затем триазин был расщеплен плавиковая кислота:
- PhN = N-N (CH2)5 + 2 HF → PhF + N2 + [(CH2)5NH2] F
Историческая справка: во времена Валлаха фтор символизировался буквой «Fl». Таким образом, его процедура называется «Фторбензол, C6ЧАС5Fl ».[1]
В лабораторных условиях PhF готовится термическое разложение из бензолдиазоний тетрафторборат:
- PhN2BF4 → PhF + BF3 + N2
Согласно методике, твердый [PhN2] BF4 нагревается пламенем, чтобы вызвать экзотермическая реакция, что также дает трифторид бора и газообразный азот. Продукт PhF и BF3 легко разделяются из-за их различных точки кипения.[2]
Технический синтез осуществляется по реакции циклопентадиен с дифторкарбен. Первоначально сформированный циклопропан подвергается расширению кольца и последующему устранению фтороводород.
Реакции
PhF ведет себя несколько иначе, чем другие производные галобензола из-за пи-донорных свойств фторида. Например, пара-положение более активно по отношению к электрофилам, чем бензол. По этой причине его можно преобразовать в 1-бром-4-фторбензол с относительно высокой эффективностью.[3]
Свойства растворителя
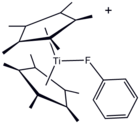 Структура [(C5Мне5)2Ti (FC6ЧАС5)]+, координационный комплекс фторбензола.
Структура [(C5Мне5)2Ti (FC6ЧАС5)]+, координационный комплекс фторбензола.
PhF - полезный растворитель для высокореактивных частиц. Его температура плавления при -44 ° C ниже, чем у бензола. Напротив, температуры кипения PhF и бензола очень похожи и отличаются всего на 4 ° C. Он значительно более полярен, чем бензол, с диэлектрической проницаемостью 5,42 по сравнению с 2,28 для бензола при 298 К.[4] Фторбензол - относительно инертное соединение, отражающее прочность связи C – F.
Хотя его обычно считают некоординирующим растворителем, металлический комплекс PhF был кристаллизован.[5]
Смотрите также
Рекомендации
- ^ Валлах, О. «Über einen Weg zur leichten Gewinnung organischer Fluorverbindungen» (Относительно метода легкого получения органических соединений фтора) Annalen der Chemie Юстуса Либиха, 1886, том 235, с. 255–271; Дои:10.1002 / jlac.18862350303
- ^ Флуд, Д. Т. (1933). «Фторбензол». Орг. Синтезатор. 13: 46. Дои:10.15227 / orgsyn.013.0046..
- ^ Розенталь, Джоэл; Шустер, Дэвид И. (2003). «Аномальная реакционная способность фторбензола при электрофильном ароматическом замещении и связанных с ним явлениях». J. Chem. Образовательный. 80 (6): 679. Дои:10.1021 / ed080p679.
- ^ Таблица диэлектрических постоянных чистых жидкостей. Национальное бюро стандартов. 1951 г.
- ^ R.N. Перуц и Т. Браун «Активация связи C – F с помощью переходных металлов» Комплексная металлоорганическая химия III, 2007, том 1, с. 725–758; Дои:10.1016 / B0-08-045047-4 / 00028-5.