Соединения фтора - Compounds of fluorine

Фтор образует большое разнообразие химических соединений, внутри которых всегда принимает степень окисления -1. С другими атомами фтор образует полярные ковалентные связи или ионные связи. Чаще всего ковалентные связи с участием атомов фтора представляют собой одинарные облигации, хотя существуют по крайней мере два примера связи более высокого порядка.[2] Фторид может действовать как мостиковый лиганд между двумя металлами в некоторых сложных молекулах. Молекулы, содержащие фтор, также могут проявлять водородная связь (более слабое связующее звено с некоторыми неметаллами).[3] Химия фтора включает неорганические соединения, образованные водородом, металлами, неметаллами и даже благородными газами; а также разнообразный набор органических соединений.[примечание 1]Для многих элементов (но не для всех) наивысшая известная степень окисления может быть достигнута во фториде. Для некоторых элементов это достигается исключительно во фториде, для других - исключительно в оксиде; а для других (элементы в определенных группах) наивысшие степени окисления оксидов и фторидов всегда равны.[4]
Дифтор
В то время как отдельный атом фтора имеет один неспаренный электрон, молекулярный фтор (F2) все электроны спарены. Это делает это диамагнитный (слегка отталкивается магнитами) с магнитная восприимчивость −1,2 × 10−4 (SI ), что близко к предсказаниям теории.[5] Напротив, двухатомные молекулы кислорода соседнего элемента, с двумя неспаренными электронами на молекулу, являются парамагнитный (притягивается к магнитам).[6]
| Икс | XX | HX | BX3 | AlX3 | CX4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| я | 151 | 294 | 272 | 285 | 239 |
Связь фтор-фтор молекулы дифтора относительно слабая по сравнению со связями более тяжелых молекул дигалогена. Энергия связи значительно слабее, чем у Cl2 или Br2 молекулы и аналогично легко расщепляющимся кислородно-кислородным связям перекиси или азот-азотные связи гидразины.[8] Ковалентный радиус фтора около 71 пикометра найден в F2 молекул значительно больше, чем в других соединениях из-за этой слабой связи между двумя атомами фтора.[9] Это результат относительно большого электронного и межъядерного отталкивания в сочетании с относительно небольшим перекрытием связей. орбитали возникающий из-за малого размера атомов.[10]
F2 молекула обычно описывается как имеющая ровно одну связь (другими словами, ордер на облигации из 1) предоставлено одним p электрон на атом, как и другие галогены X2 молекулы. Однако p-орбитали более тяжелых галогенов частично смешиваются с орбиталями d-орбиталей, что приводит к увеличению эффективного порядка связи; например, хлор имеет порядок связи 1,12.[11] Электроны фтора не могут проявлять этот d-характер, поскольку таких d-орбиталей, близких по энергии к фторам, не существует. валентные орбитали.[11] Это также помогает объяснить, почему соединение в F2 слабее, чем в Cl2.[10]
Реактивность
Реакции с элементарным фтором часто бывают внезапными или взрывоопасными. Многие вещества, которые обычно считаются инертными, такие как стальной порошок, осколки стекла и асбест волокна, легко потребляются холодным газообразным фтором. Дерево и даже вода горят пламенем, когда подвергаются воздействию струи фтора, без искры.[12][13]
| Внешнее видео | |
|---|---|
Фтор реагирует с цезием, видео Королевского института. (Оба видео сняты в лаборатории фтора Университета Лестера.) |
Реакции элементарного фтора с металлами требуют разных условий, которые зависят от металла. Часто металл (например, алюминий, железо или медь) необходимо измельчить, потому что многие металлы пассивировать за счет образования защитных слоев из фторида металла, стойких к дальнейшему фторированию.[7] В щелочных металлов с фтором реагируют с взрывом (небольшой взрыв), а щелочноземельные металлы реагируют не так агрессивно. В благородные металлы рутений, родий, палладий, платина и золото вступают в реакцию наименее быстро, для чего требуется чистый газообразный фтор при 300–450 ° C (575–850 ° F).[14]
Фтор взрывоопасен с водород аналогично щелочным металлам.[15] В галогены легко реагирует с газообразным фтором[16] как и тяжелый благородный газ радон.[17] Более легкие благородные газы ксенон и криптон можно заставить реагировать с фтором в особых условиях, в то время как аргон претерпит химические превращения только с фтороводород.[18] Азот с его очень стабильным тройные облигации, требует электрического разряда и высоких температур для непосредственного соединения с фтором.[19]Фтор реагирует с аммиак образовывать азот и фтороводород .
Химические характеристики, эффекты присутствия в молекуле
В химии фтора преобладает его сильная тенденция к получению электронов. Это самый электроотрицательный элементарный и элементарный фтор - сильный окислитель. Удаление электрона от атома фтора требует такой большой энергии, что неизвестно ни одного известного реагента. окислять фтор к любому положительному степень окисления.[20]
Таким образом, единственный распространенный фтор степень окисления равно -1. Оно отличается от этого значения для элементарного фтора, где атомы связаны друг с другом и, следовательно, в степени окисления 0, и нескольких многоатомных ионов: очень нестабильных анионов. F−
2 и F−
3 с промежуточными степенями окисления существуют при очень низких температурах, разлагаясь при температуре около 40 К.[21] Так же F+
4 катион и несколько родственных ему видов были предсказаны как стабильные.[22]
Фтор образует соединения со всеми элементами, кроме неон и гелий. В частности, он формирует бинарные соединения, названный фториды, со всеми указанными элементами, кроме аргон. Все элементы до эйнштейний, элемент 99, проверены, кроме астатин и франций,[23] а также известно, что фтор образует соединения с менделевий, элемент 101,[24] резерфордий, элемент 104,[25] и сиборгий, элемент 106.[26]
В результате своего небольшого размера и высокой плотности отрицательного заряда фторид-анион является самым «твердым» основанием (т.е. поляризуемость ). Из-за этого фториды в реальных кристаллах соли часто имеют более высокую эффективные сборы чем оксиды того же металла, хотя формальный заряд кислорода вдвое больше, чем у фтора.[нужна цитата ]
Как часть молекулы, это часть с большим индуктивный эффект. В последнем случае это значительно увеличивает кислотность молекулы: анион, образующийся после отдачи протона, в результате становится стабильным. Учитывать уксусная кислота и это мононуклеоз-, ди- и трифторуксусный производные и их pKа значения (4,74, 2,66, 1,24 и 0,23[заметка 2]);[27] Другими словами, трифтордерат в 33 800 раз сильнее кислоты, чем уксусная.[28] Фтор является основным компонентом самой сильной из известных кислот с нейтральным зарядом, ЧАС
2ФСБФ
6.[29] Есть доказательства еще более сильной кислоты, ЧАС
2FAuF
6, но это не оказалось изолированным.[30]
В молекуле, которая состоит из центральных атомов и присоединенных к ней фторов, межмолекулярная связь не очень сильна. Более того, плотные отрицательные шары, которыми являются фтор, отталкиваются друг от друга. Следовательно, прочность межмолекулярной связи еще больше падает, что приводит к низкой температуре плавления высоких фторидов.[нужна цитата ]
Фтористый водород
| HF и H2О сходства | |
 |  |
| Температуры кипения галогенидов водорода (синий) и халькогенидов водорода (красный): HF и H2O сломать тенденции из-за водородные связи. | Температура замерзания HF / H2Смеси O: стрелки указывают соединения в твердом состоянии. |
Фтор соединяется с водородом с образованием соединения (HF), называемого фтористым водородом или, особенно в контексте водных растворов, плавиковой кислотой. Тип связи H-F - один из немногих, способных образовывать водородные связи (создавать дополнительные кластерные ассоциации с подобными молекулами). Это влияет на различные особенности свойств фтороводорода. В некотором смысле вещество ведет себя больше как вода, также очень склонная к образованию водородных связей, чем один из других галогенидов водорода, таких как HCl.[31][32][33]
Водородная связь между молекулами HF приводит к высокой вязкость в жидкой фазе и ниже ожидаемого давления в газовой фазе. Фтористый водород не кипит до 20 ° C, в отличие от более тяжелых галогенидов водорода, которые кипят от -85 ° C до -35 ° C (от -120 ° F до -30 ° F). ВЧ смешивающийся с водой (растворяется в любой пропорции), в то время как другие галогениды водорода имеют большие промежутки растворимости с водой. Фтористый водород и вода также образуют несколько соединений в твердом состоянии, в первую очередь соединение 1: 1, которое не плавится до -40 ° C (-40 ° F), что на 44 градуса Цельсия (79 градусов по Фаренгейту) выше точки плавления. чистого ВЧ.[34]
В отличие от других галогеноводородных кислот, таких как соляная кислота, фтороводород - это только слабая кислота в водном растворе, с константа диссоциации кислоты (pKа) равным 3,19.[35] Слабость HF как водной кислоты парадоксальна, учитывая, как полярный связь HF намного сильнее, чем связь в HCl, HBr или HI. Объяснение такого поведения сложно и связано с различными тенденциями кластерообразования HF, воды и фторид-иона, а также с термодинамическими проблемами.[заметка 3] При больших концентрациях свойство, называемое гомоконъюгация раскрывается. HF начинает принимать фторид-ионы, образуя многоатомные ионы (такие как бифторид, HF−
2) и протоны, что значительно увеличивает кислотность соединения.[37] Плавиковая кислота также является самой сильной из галогеноводородных кислот в уксусная кислота и аналогичные растворители.[38] Его скрытый кислотный потенциал также проявляется в том факте, что он протонирует кислоты, такие как соляная, серная или азотная.[39] Несмотря на свою слабость, фтористоводородная кислота очень агрессивна, даже разрушает стекло (только гидратированное).[37]
Сухой фтороводород хорошо растворяет фториды низковалентных металлов. Некоторые молекулярные фториды также растворяются в HF. Многие белки и углеводы могут растворяться в сухом HF и извлекаться из него. Большинство нефторидных неорганических химикатов реагируют с HF, а не растворяются.[40]
Фториды металлов
Фториды металлов довольно не похожи на другие галогениды металлов, принимая отличительные структуры. Во многих отношениях фториды металлов больше похожи на оксиды, часто имеющие аналогичные связи и кристаллические структуры.[41]
Благодаря своей высокой электроотрицательности фтор стабилизирует металлы в более высоких степенях окисления с высокими отношениями M: галогенид. Известны многочисленные пента- и гексафториды с нейтральным зарядом, тогда как аналогичные хлориды и бромиды встречаются реже. Молекулярные бинарные фториды часто летучие, либо в виде твердых веществ. [42] жидкости,[43] или газы[44] при комнатной температуре.
Растворимость фторидов сильно варьируется, но имеет тенденцию к снижению по мере увеличения заряда иона металла. Из растворенных фторидов получаются основные растворы.[45]
| Фториды элементов переходных металлов 25–29 | ||||
 |  |  |  |  |
| Дифторид марганца | Трифторид железа | Дифторид кобальта | Дифторид никеля | Дифторид меди |
Фториды металлов с низкой степенью окисления

В щелочных металлов форма монофториды. Все они растворимы и имеют хлорид натрия (каменная соль) структура,[46] Поскольку фторид-анион является основным, многие фториды щелочных металлов образуют бифториды с формулой MHF2. Среди других монофторидов только серебро (I)[47] и таллий (I)[48] фториды хорошо охарактеризованы. Оба они хорошо растворимы, в отличие от других галогенидов этих металлов.
В отличие от монофторидов дифториды могут быть растворимыми или нерастворимыми. Некоторые дифториды переходных металлов, такие как медь (II) и никель (II), растворимы.[47] В щелочноземельный форма металлов дифториды которые нерастворимы.[47] Напротив, хлориды щелочноземельных металлов легко растворимы.[47]
Многие дифториды имеют структуру флюорита, названную в честь фторид кальция (а также принят несколькими диоксидами металлов, такими как Исполнительный директор2, UO2, ThO2 и др.), который окружает каждый катион металла 8 фторидами. Некоторые дифториды принимают структура рутила, названный в честь формы диоксида титана и принятый также рядом других диоксидов металлов. Структура четырехугольный и ставит атомы металлов в октаэдрическую координацию.
Дифторид бериллия отличается от других дифторидов. В целом, бериллий имеет тенденцию связывать ковалентно, намного больше, чем другие щелочноземельные земли, и его фторид частично ковалентен (хотя еще более ионный чем другие его галогениды). BeF2 имеет много общего с SiO2 (кварц) в основном ковалентно связанный сеть прочная. BeF2 имеет тетраэдрически координированный металл и образует стекла (трудно кристаллизуются). В кристаллическом состоянии фторид бериллия имеет ту же кристаллическую структуру при комнатной температуре, что и кварц, а также имеет много структур при более высоких температурах.
Дифторид бериллия хорошо растворяется в воде,[47] в отличие от других щелочноземельных металлов. (Хотя они сильно ионны, они не растворяются из-за особенно сильного энергия решетки структуры флюорита.) Однако BeF2 имеет гораздо более низкую электропроводность в растворе или в расплавленном состоянии, чем можно было бы ожидать, если бы он был ионным.[49][50][51][52]
| Порядок и беспорядок в дифторидах | |
 |  |
| Структура флюорита, используемая многими дифторидами | Неупорядоченная структура стекла из фторида бериллия (эскиз в двух измерениях) |
Многие металлы образуют трифториды, такие как железо, висмут, редкоземельные элементы, и металлы в столбцах алюминия и скандия периодической таблицы. Трифториды многих редкоземельных элементов, а также висмут обладают YF3 структура. Трифториды плутония, самария (при высокой температуре) и лантана принимают LaF3 структура. Трифториды железа и галлия обладают FeF3 структура, похожая на триоксид рения. Только ScF3 кубический (ReO3) при температуре окружающей среды; этот материал также обладает необычным свойством отрицательное тепловое расширение, что означает его усадку при нагревании в довольно широком диапазоне температур.

Трифторид золота имеет структуру связанных -AuF4- квадраты, расположенные по спирали (спиральная цепочка).[53] В отличие от явно ионного трифторида золота, его трихлорид и трибромид являются летучими димерный молекулы.[54] Трифторид алюминия представляет собой твердое вещество с высокой температурой плавления, которое является мономером в газовой фазе, тогда как другие его тригалогениды представляют собой легкоплавкие летучие молекулы или линейные полимерные цепи, которые образуют димеры в виде газовой фазы.[55] Трифторид не растворим в воде, но некоторые из них растворимы в других растворителях.[56]
В тетрафториды показывают смесь ионной и ковалентной связи. Цирконий, гафний и многие актиниды образуют тетрафториды с ионной структурой, которая помещает катион металла в 8-координату. квадратная антипризма.[57][58] Температура плавления составляет около 1000 ° C.[59]
Тетрафториды титана и олова являются полимерными с температурами плавления ниже 400 ° C. (Напротив, их тетрахлориды являются молекулярными и жидкими при комнатной температуре.) Тетрафторид ванадия имеет структуру, аналогичную оловянной[60] и непропорционально при 100–120 ° C на трифторид и пентафторид.
Тетрафториды иридия, платины, палладия и родия имеют одинаковую структуру, которая не была известна до 1975 года. Они имеют октаэдрически координированные атомы металла с четырьмя общими фторами и двумя неподеленными. Температуры плавления, если они известны, ниже 300 ° C.
Тетрафторид марганца - нестабильное твердое вещество, которое разлагается даже при комнатной температуре.[61] Только один из двух аллотропов, α-MnF4, понятно. В этом соединении марганец образует –MnF6- октаэдры, которые разделяют мостиковые фторы для образования –Mn4F20- кольца, которые затем соединяются трехмерно.[62]
| Некоторые тетрафторидные структуры | ||
 |  |  |
| ZrF4, обычная структура тетрафторида | Полимерная структура SnF4 | –Mn4F20- кольцо MnF4 |
Фториды металлов с высокой степенью окисления
Пента- и высшие фториды металлов являются все молекулярными и, следовательно, по крайней мере в некоторой степени летучими.
Ванадий, ниобий, и тантал форма пентафториды как их самый нейтральный по заряду фторид. Пентафторид ванадия - единственный нелетучий высокозарядный фторид металла, в котором ванадий является центром –VF.6- октаэдры. Пентафториды ниобия и тантала имеют одинаковые тетраэдры в своей структуре, с той разницей, что образуются тетра- (а не полимерные) молекулы.[63]
Самый высокий фторид висмута - это летучая пента, которая является мощным фторирующим агентом. В твердом состоянии он полимерный, состоит из линейных цепочек октаэдров, разделяющих аксиальные фториды. В сочетании с щелочными металлами пятивалентный висмут может образовывать гексафторбисмутат [BiF6]−, при реакции с донором фтора, сильным (например, NaF[64][65]) или нет (например, XeF4[66]).
Многие металлы, образующие гексафториды также может образовывать пентафториды. Например, уран, имеющий известную гексафторид, также образует две разные пентафторидные структуры. При комнатной температуре (альфа) форма имеет такую же линейную цепную структуру, что и пентафторид висмута. Как молекулярная (газовая) разновидность, UF5 имеет квадратно-пирамидальный структура.
| Строение пентафторида висмута (или альфа-урана) | |
  |   |
| Структура (XF5)п цепь; X = Bi, U. | Упаковка цепей |
Металлы, которые делают хорошо охарактеризованные гексафториды включить девять металлов в центр периодической таблицы (молибден, технеций, рутений, родий, вольфрам, рений, осмий, иридий, и платина ) вместе с элементами 92–94: уран, нептуний, и плутоний. При комнатной температуре, гексафторид вольфрама это газ. Гексафторид молибдена и гексафторид рения жидкие. Остальные - летучие твердые вещества.

Металл гексафториды являются окислителями из-за их тенденции выделять фтор: например, гексафторид платины был первым соединением, окисляющим молекулярный кислород[67] и ксенон.[68] Полоний также формирует гексафторид, но он малоизучен.[69]
Рений - единственный металл, известный связь с семью фторидами, что является рекордом по количеству заряженных лигандов для соединения металла с нейтральным зарядом.[70] Гептафторид рения принимает пентагональная бипирамида молекулярная геометрия. Расчеты показывают, что неизвестный в настоящее время, но, возможно, возможный гептафторид иридия[71] (отчет о синтезе готовится[72]), гептафторид технеция,[73] и гептафторид осмия[74] тоже будет иметь эту структуру.
Осмий октафторид Впервые сообщалось в 1913 году, но в 1958 году было показано, что это соединение на самом деле является гексафторидом осмия.[75] Теоретическое исследование 1993 года предсказало очень слабые связи в октафториде осмия и показало, что это будет трудно обнаружить экспериментально. Исследование предсказало, что если оно будет сделано, OsF8 будет иметь связи Os – F двух разных длин.[76]
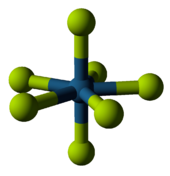
Фториды неметаллов
В неметалл бинарные фториды - летучие соединения. Они показывают большую разницу между периодом 2 и другими фторидами. Например, период 2 элемента фториды элементов никогда не превышают октет в их атомах. (Бор является исключением из-за своего особого положения в периодической таблице.) Элементы с более низким периодом, однако, могут образовывать гипервалентные молекулы, Такие как пентафторид фосфора или же гексафторид серы.[77] Реакционная способность таких частиц сильно различается - гексафторид серы инертен, а трифторид хлора является чрезвычайно реактивным, но есть некоторые тенденции, основанные на положениях таблицы Менделеева.
Трифторид бора представляет собой плоскую молекулу. У него всего шесть электронов вокруг центрального атома бора (и, следовательно, неполный октет), но он легко принимает База Льюиса, формируя аддукты с неподеленными парами молекул или ионов, таких как аммиак или другой фторид-ион, который может отдать еще два электрона для завершения октета.[78] Монофторид бора представляет собой нестабильную молекулу с необычной (более высокой, чем одинарной) связью с фтором. Порядок связи был описан как 1,4 (промежуточный между одинарной и двойной связью). Он изоэлектронен с N2.[79]

Тетрафторид кремния, похожий на тетрафторид углерода и тетрафторид германия, принимает молекулярный четырехгранный структура.[80] SiF4 устойчив к нагреву или воздействию электрической искры, но реагирует с водой (даже влажным воздухом), металлами и щелочами, проявляя слабокислый характер.[81] Реакции с магнийорганическими соединениями, спиртами, аминами и аммиаком дают соединения аддукции.[81] Кремнефтористоводородная кислота, производное SiF4, представляет собой сильную кислоту в водном растворе (безводной формы не существует).[82]
Пниктогены (столбец таблицы Менделеева азота) показывают очень похожие тенденции в реакционной способности и кислотности высших фторидов (пентафторидов) и наиболее распространенных (трифториды), причем указанное свойство увеличивается вниз по группе: NF3 устойчив к гидролизу,[83] ПФ3 очень медленно гидролизуется во влажном воздухе,[84] а AsF3 полностью гидролизуется.[83] SbF3 гидролизуется лишь частично из-за усиления ионного характера связи с фтором. Соединения являются слабыми основаниями Льюиса, с NF3 опять же исключение.[83] Пентафториды фосфора[84] и мышьяк[85] намного более реактивны, чем их трифториды; Пентафторид сурьмы - настолько сильная кислота, что она носит титул сильнейшей кислоты Льюиса.[85] Не известно, что азот образует пентафторид, Хотя тетрафтораммоний катион (NF+
4) содержит азот в формальной степени окисления +5.[86] Монофторид азота метастабильный вид, который наблюдался в лазерных исследованиях. Он изоэлектронен с O2 и, что необычно, как BF, имеет более высокий порядок связи, чем односвязанный фтор.[2][87]

В халькогены (столбец таблицы Менделеева) в чем-то похожи: тетрафториды термически нестабильны и гидролизуются, а также готовы использовать свою неподеленную пару для образования аддуктов с другими (кислотными) фторидами. Тетрафториды серы и селена молекулярные, а TeF4 представляет собой полимер.[88] Гексафториды являются результатом прямого фторирования элементов (сравните: других гексагалогенидов этих элементов даже не существует). Их реакционная способность увеличивается с атомным номером: SF6 чрезвычайно инертен, SeF6 менее благороден (например, реагирует с аммиаком при 200 ° C (400 ° F)), а TeF6 легко гидролизуется с образованием оксокислоты.[88] Самый высокий фторид кислорода - дифторид кислорода,[88] но фтор теоретически может (по состоянию на 2012 год) окислять его до уникально высокой степени окисления +4 во фторкалионе: ИЗ+
3.[89] Кроме того, встречаются несколько фторидов халькогенов, которые содержат более одного халькогена (O2F2,[90] S2F10,[91] так далее.).
Хорошо охарактеризованные более тяжелые галогены (хлор, бром и йод) все образуют моно-, три- и пентафториды: XF, XF3, и XF5. Из нейтральных +7 видов только гептафторид йода известен.[92] Хотя гептафториды хлора и брома неизвестны, соответствующие катионы ClF+
6 и BrF+
6, чрезвычайно сильные окислители.[93] Астатин плохо изучен, и хотя есть сообщения о нелетучем монофториде астатина,[94] его существование обсуждается.[95] Многие фториды галогенов являются мощными фторирующими агентами. Особого внимания заслуживает трифторид хлора - легко фторирующий асбест и тугоплавкие оксиды - и он может быть даже более активным, чем пентафторид хлора. Промышленно используется, ClF3 требует специальных мер предосторожности, подобных тем, которые применяются в отношении газообразного фтора, из-за его коррозионной активности и опасности для человека.[96][97]
Суперкислоты
Некоторые важные неорганические кислоты содержат фтор. Обычно они очень сильные из-за высокой электроотрицательности фтора. Одна такая кислота, фторантимоновая кислота (HSbF6), является самой сильной из известных кислот с нейтральным зарядом.[29] Дисперсия заряда аниона влияет на кислотность сольватированного протона (в виде ЧАС
2F+
): Соединение имеет чрезвычайно низкий pKа −28 и составляет 10 квадриллионов (1016) раз сильнее чистой серной кислоты.[29] Фторантимоновая кислота настолько сильна, что протонирует в других отношениях инертные соединения, такие как углеводороды. Венгерско-американский химик Джордж Олах получил Нобелевскую премию по химии 1994 г. за исследование таких реакций.[98]
Соединения благородных газов
В благородные газы обычно нереактивны, потому что они заполнены электронными оболочками. До 1960-х годов о химической связи с благородным газом не было известно. В 1962 г. Нил Бартлетт обнаружили, что гексафторид платины реагирует с ксеноном. Он назвал состав, который он приготовил гексафтороплатинат ксенона, но с тех пор было обнаружено, что продукт представляет собой смесь, возможно, монофтороксенил (II) пентафтороплатинат, [XeF]+[PtF5]−, монофтороксенил (II) ундекафторплатинат, [XeF]+[Pt2F11]−и трифтордиксенил (II) гексафтороплатинат, [Xe2F3]+[PtF6]−.[99] Фторирование ксенона Бартлеттом получило высокую оценку.[100] Позже в 1962 году было обнаружено, что ксенон напрямую реагирует с фтором с образованием ди- и тетрафторидов. С тех пор появились сообщения о других фторидах благородных газов.

Бинарные соединения ксенона включают дифторид ксенона, тетрафторид ксенона, и гексафторид ксенона.[101] Ксенон образует несколько оксифторидов, таких как оксидифторид ксенона, XeOF2, гидролизом тетрафторида ксенона.[102] Его более легкий сосед, криптон, также образует хорошо изученные соединения, например, дифторид криптона. Тетрафторид криптона был зарегистрирован в 1963 г.[103] но впоследствии было показано, что это ошибочная идентификация; соединение, похоже, сейчас очень трудно синтезировать (хотя может существовать даже гексафторид).[104]
В соответствии с периодические тенденции, радон более реактивен к фтору. Дифторид радона был заявлен.[94] Более легкие благородные газы (гелий через аргон) не образуют стабильных бинарных фторидов.
Высшие степени окисления: фтор против кислорода
| Самый высокий фторид и оксид рутения | |
 | 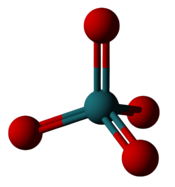 |
| Гексафторид рутения: Шесть фторов подходят для рутения, но имеют степень окисления +6. | Четырехокись рутения: Четыре атома кислорода помещаются вокруг рутения, что составляет степень окисления +8. |
Элементы часто имеют самую высокую степень окисления в форме бинарного фторида. Некоторые элементы проявляют наивысшую степень окисления только в нескольких соединениях, одним из которых является фторид; и самая высокая известная степень окисления некоторых элементов наблюдается исключительно у фторида.
За группы 1–5, 10, 13–16 (кроме азота) высшие степени окисления оксидов и фторидов всегда равны. Различия наблюдаются только в хроме, 7–9 группах, меди, ртути и благородных газах. Фторирование позволяет некоторым элементам достигать относительно низких[примечание 4] высшие степени окисления, которые иначе трудно достичь. Например, для криптона не известен бинарный оксид, но дифторид криптона хорошо изучен.[105] В то же время для некоторых других элементов определенные очень высокие степени окисления известны только для разновидностей на основе кислорода, а не для соединений на основе фтора. Для ранее упомянутых летучих оксидов нет соответствующих гепта- или октафторидов. (Например, октафторид рутения вряд ли когда-либо будет синтезирован,[106] пока четырехокись рутения нашла даже промышленное применение.[107]) Основная проблема, которая не позволяет фтору образовывать высшие состояния в ковалентных гепта- и октафторидах, заключается в том, что трудно прикрепить такое большое количество лигандов вокруг одного атома; в аналогичных оксидах вдвое меньше лигандов.[108][примечание 5] Однако октафторид-анионы, такие как октафториодат (ЕСЛИ−
8), октафторцирконат (ZrF4−
8), и октафтороксенат (XeF2−
8) анионы хорошо известны.
Самые высокие степени окисления могут быть необычными для повседневной жизни или даже для промышленного использования. Например, синтез тетрафторид ртути, первое соединение, достигшее степени окисления выше +2 для группа 12 элемент, разрушая заполненную 5d-оболочку, снова показывая важность релятивистского воздействия на тяжелые элементы, и заправляя дебаты над тем, есть ли Меркурий, кадмий, и цинк переходные металлы,[109] происходит при криогенных температурах, а соединение разлагается при температурах твердого азота.[110] Еще более нестабильным является единственный вид кобальта (V), CoF+
4 катион, наблюдали только в газовой фазе (без взаимодействия с другими атомами, поэтому не было продемонстрировано стабильности в какой-либо химической среде).[106] Причина, по которой существуют такие нестабильные виды, сложна, но ее можно резюмировать следующим образом на примере предполагаемого NF
5 молекула: согласно современным расчетам, пять атомов фтора и один атом азота теоретически могут располагаться по-разному, например NF
3 и F
2, NF•
4 и F
•, NF
5и т. д. NF
3+F
2 система наименьшей энергии (самая устойчивая). Однако если NF
5 молекула была синтезирована, она должна была бы пройти через высокоэнергетическое переходное состояние, из которого она могла бы распасться на две молекулы. Но поскольку переходное состояние имеет более высокую энергию, чем шестиатомная молекула, необходимо добавить разность энергий, чтобы достичь переходного состояния и, таким образом, позволить распад. Эта энергия называется барьером активации реакции. (Вторая мода распада имеет аналогичное положение.) Таким образом, если было добавлено мало энергии (низкие температуры), то соединение могло существовать; однако синтез - серьезная проблема (еще не решенная).[111]
Фторорганические соединения
В химическая связь углерод-фтор фторорганических соединений является самой прочной связью в органической химии.[112] Наряду с низкой поляризуемостью молекул, это наиболее важные факторы, способствующие высокой стабильности фторорганических соединений.[113]
Связь углерод-фтор более мелких молекул образуется тремя основными способами: фтор заменяет галоген или водород или присоединяется по кратной связи. Прямая реакция углеводородов с газообразным фтором может быть опасно реактивной, поэтому, возможно, потребуется снизить температуру даже до -150 ° C (-240 ° F).[114] «Твердые носители фтора», соединения, которые могут выделять фтор при нагревании, в частности трифторид кобальта,[115] вместо него может быть использован фтористый водород. После реакции размер молекул существенно не изменяется, так как элементы имеют очень похожие ван-дер-ваальсовы радиусы.[113] Прямое фторирование становится еще менее важным, когда речь идет о реакциях с галогенорганическими соединениями или ненасыщенными соединениями, или когда желателен префторуглерод (тогда Электролиз на основе HF обычно используется).[116] Напротив, фторполимеры образованы полимеризация свободные радикалы; другие методы, используемые для углеводородных полимеров, не работают с фтором.[117]
Диапазон фторорганических соединений разнообразен, что отражает присущую им сложность органическая химия. Существует огромное количество небольших молекул с различными количествами замещения фтора, а также множество полимеров - исследования в определенных областях обусловлены коммерческой ценностью их применения.[118]
 | 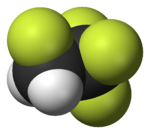 | 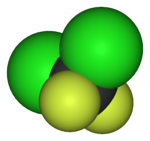 |  |  |  |
|---|---|---|---|---|---|
| Фторметан (метил фторид), используемый в обработка полупроводников | 1,1,1,2-тетрафторэтан (R-134a), ГФУ | Дихлордифторметан (Хладагент R-12), CFC | Трифторметансульфонат кислота (трифликовая кислота), суперкислотный | Перфтороктансульфоновая кислота, фторсодержащее поверхностно-активное вещество (изображен анион) | Раздел политетрафторэтилен (Тефлон) полимер |
Маленькие молекулы
Монофторалканы (алканы с одним водородом, замещенным фтором) могут быть химически и термически нестабильными, но растворимы во многих растворителях; но чем больше фтора, а не водорода, стабильность увеличивается, а точки плавления и кипения и растворимость снижаются. При увеличении плотности и вязкости диэлектрическая проницаемость, поверхностное натяжение и показатели преломления падают.[119]
Частично фторированные алканы являются гидрофторуглероды (ГФУ). Замена других галогенов в сочетании с фтором дает хлорфторуглероды (CFC) или бромфторуглероды (BFC) и тому подобное (если остается некоторое количество водорода, HCFC и тому подобное). Свойства зависят от количества и идентичности атомов галогена. В общем, точки кипения еще больше повышаются за счет комбинации атомов галогенов, потому что различный размер и заряд различных галогенов допускают большее межмолекулярное притяжение.[120] Как и фторуглероды, хлорфторуглероды и бромфторуглероды не горючие: они не содержат углерод-водородные связи реагировать и высвободившиеся галогениды тушат пламя.[120]

Когда все водороды заменяются фтором для получения перфторалканов, обнаруживается большая разница. Такие соединения чрезвычайно устойчивы, и только натрий в жидком аммиаке атакует их при стандартных условиях. Кроме того, они очень нерастворимы, и их растворяют лишь немногие органические растворители.[119]
Однако, если перфторуглерод содержит двойные или тройные связи (перфторуглеродалкены или же -алкины ), очень реакционноспособный по отношению к принятию лигандов, даже менее стабилен, чем соответствующие углеводороды.[121] Дифторацетилен, который разлагается даже при жидкий азот температуры,[122] является ярким примером. Если такая молекула асимметрична, то атакуется более фторированный углерод, так как он несет положительный заряд, вызванный связями C – F, и слабо экранирован.[121] (аналогично тому, как ненасыщенные углеводороды, атакованные HF, добавляют водород к более богатому водородом атому на Правило марковникова[123]).
Перфторированные соединения, в отличие от перфторуглеродов, это термин, используемый для молекул, которые будут перфторуглеродами - только атомами углерода и фтора - за исключением наличия дополнительной функциональной группы (хотя существует другое определение[124]). Они обладают большинством свойств перфторуглеродов (инертность, стабильность, несмачиваемость и нерастворимость в воде и маслах, скользкость и т. Д.).[125] но может отличаться из-за свойств функциональной группы, хотя перфторуглеродный хвост отличается по групповым свойствам по сравнению со свойствами соединений с углеводородным хвостом.
Перфторалкансульфоновые кислоты также очень отличаются своей кислотностью. Производное сульфоновой кислоты, трифторметансульфоновая кислота, по силе сравним с хлорная кислота.[126] Эти соединения снижают поверхностную энергию; по этой причине они, особенно перфтороктансульфоновая кислота (ПФОС, ранее активный компонент торговой марки "Scotchgard") нашли промышленное применение в качестве поверхностно-активных веществ (см. над ).[126]
Если перфторированное соединение имеет фторированный хвост, но также несколько нефторированных атомов углерода (обычно два) рядом с функциональной группой, это называется фтортеломер (such molecules are commercially treated as perfluorinated), but such molecules are more of industrial value than chemical. The chain end may similarly be attached to different functional groups (via the hydrogenized terminal carbon), such as hydroxyl resulting in fluorotelomer alcohols, sulfonate resulting in fluorotelomer sulfonates, etc.[125]
Полимеры
Fluoropolymers are similar in many regards with smaller molecules; adding fluorine to a polymer affects the properties in the same manner as in small molecules (increasing chemical stability, melting point, reducing flammability, solubility, etc.). Each fluoropolymer has own characteristic properties, though.[117]
The simplest fluoroplastic is polytetrafluoroethylene (PTFE, DuPont brand Teflon), which is a simple linear chain polymer with the repeating structural unit:–CF2-. PTFE has a backbone of carbons single bonded in a long chain, with all side bonds to fluorines. It contains no hydrogens and can be thought of as the perfluoro analog of полиэтилен (structural unit: –CH2–). PTFE has high chemical and thermal stability, as expected for a perfluorocarbon, much stronger than polyethylene. Its resistance to van der Waals forces makes PTFE the only known surface to which a геккон cannot stick.[127] The compound, however, lacks an ability to transform upon melting, which is not a problem for various PTFE derivatives, namely FEP (фторированный этиленпропилен, with some fluorines replaced with the–CF3 group) or PFA (perfluoroalkoxy, some fluorines replaced with –OCF3). They share most properties with PTFE, but there are still differences, namely maximum usage temperature (highest for the non-flexible PTFE).[128]
There are other fluoroplastics other than perfluorinated. Поливинилиденфторид (PVDF, structural unit: –CF2CH2–), is an analog of PTFE with half the fluorines. PVF (polyvinyl fluoride, structural unit: –CH2CHF–) contains one one-fourth the fluorines of PTFE. Despite this, it still has many properties of more fluorinated compounds.[129] PCTFE (polychlorotrifluoroethylene, structural unit: –CF2CFCl–) is another important compound. It differs from PTFE by having a quarter of fluorine replaced with chlorines, yet this difference brings even greater hardness, creep resistance, and moisture persistence.[129]
Mild fluorination of polyethylene gives does not make all of the plastic lose its hydrogens for fluorine; only a thin layer (0.01 mm at maximum) is then affected. This is somewhat similar to metal passivation: the bulk properties are not affected, but the surface properties are, most notably, a greater пароизоляция. Therefore, they are a cheaper alternative to the perfluoro plastics if only surface is important.[130]

Нафион is a structurally complicated polymer. It has a PTFE-like backbone, but also contains side chains of perfluoro ether that end in sulfonic acid (–SO2OH) groups. It also possesses great chemical stability, while exact properties vary with morphology. However, because of the difficult chemical structure, it is also relatively easily converted to an иономер (shows conductivity) by adding cations like Na+ or by converting into the sulfonic acid rather than the given sulfonyl fluoride. The conductivity is due to that the main carbon chain separates from the side chains, thus forming polar and non-polar regions. This form is also very hydroscopic.[131]
Fluoroelastomers, like other эластомеры (artificial rubbers), consist of disordered polymer chains connected in three dimensions. The main challenges in making fluorelastomers are cross-linking (reacting the unreactive polymers), as well as removing the HF formed during лечение. There are three main families of fluoroelasters. VDF/HFP is a copolymer system of vinylidene fluoride and (at least 20%) hexafluoropropylene. TFE/propylene is another copylymer system with better chemical resistance to some solvents. TFE/PMVE (perfluoromethylvinyl ether) is a copolymer system which creates a perfluorinated fluoroelastomer.[132]
Примечания
- ^ В этой статье, metalloids are not treated separately from metals and nonmetals, but among elements they are closer to. Например, германий is treated as a metal, and кремний as a nonmetal. Сурьма is included for comparison among nonmetals, even though it is closer to metals chemically than to nonmetals. The noble gases are treated separately from nonmetals; hydrogen is discussed in the Фтористый водород section and carbon in the Органические соединения раздел. П-блок period 7 elements have not been studied and thus are not included. This is illustrated by the adjacent image: the dark gray elements are metals, the green ones are nonmetals, the light blue ones are the noble gases, the purple one is hydrogen, the yellow one is carbon, and the light gray elements have unknown properties.
- ^ Lower numbers mean greater acidity; note the scale is logarithmical.
- ^ See citation for more detailed explanation.[36]
- ^ There is no general line where oxidation states are "relatively low" or "relatively high", they rely on specific elements (and defined only for elements that have highest oxides and fluorides are in different oxidation states); in general, +7 and +8 are high, while +4 and below are low. States +5 and +6 rely on element properties, like atomic radius; for a small nitrogen atom, +5 is "high" here, but for larger palladium and platinum +6 is still "low".
- ^ Note that aside from the molecular one, other forms of the highest fluorides are not considered to be possible. Such compounds are extremely unlikely to be completely ionic because of large sixth, seventh, and eighth oxidation energies of all elements, which make the reactions that may produce such compounds highly unfavorable (even though the possible osmium octafluoride may be mostly ionic[76]).
Цитаты
- ^ Calderazzo, Fausto (2010). "Halide-bridged polymers of divalent metals with donor ligands – Structures and properties". Обзоры координационной химии. 254 (5–6): 537–554. Дои:10.1016/j.ccr.2009.08.007.
- ^ а б Harbison, G. S. (2002). "The Electric Dipole Polarity of the Ground and Low-lying Metastable Excited States of NF". Журнал Американского химического общества. 124 (3): 366–367. Дои:10.1021/ja0159261. PMID 11792193.
- ^ Smart, Bruce E.; Tatlow, J. C. (1994). Organofluorine chemistry: Principles and commercial applications. Springer. п. 515. ISBN 978-0306446108.
- ^ Riedel, S .; Каупп, М. (2009). "The Highest Oxidation States of the Transition Metal Elements" (PDF). Обзоры координационной химии. 253 (5–6): 606–624. Дои:10.1016 / j.ccr.2008.07.014.[постоянная мертвая ссылка ]
- ^ Cheng, H .; Fowler, D. E.; Henderson, P. B.; Hobbs, J. P.; Pascaloni, M. R. (1999). "On the magnetic susceptibility of fluorine". Журнал физической химии А. 103 (15): 2861–2866. Bibcode:1999JPCA..103.2861C. Дои:10.1021/jp9844720.
- ^ Mackay, Mackay & Henderson 2002, п. 72.
- ^ а б Гринвуд и Эрншоу 1998, п. 804.
- ^ Macomber, Roger S. (1996). Органическая химия. 1. Книги университетских наук. п. 230. ISBN 978-0-935702-90-3. Получено 26 июля 2011.
- ^ Hemat, R. A. S. (2009). Вода. 42. Urotext. pp. 707–709. ISBN 9781903737125.
- ^ а б Гринвуд и Эрншоу 1998, п. 801.
- ^ а б Akhmetov, N. S. (2001). Общая и неорганическая химия [Общая и неорганическая химия] (4-е изд.). Академик [Akademik]. п. 317. ISBN 978-5-06-003363-2.
- ^ Jaccaud et al. 2005 г., п. 2.
- ^ Nelson, Eugene W. (1947). "'Bad man' of the elements". Популярная механика. 88 (2): 106–108, 260.
- ^ Lidin, Molochko & Andreeva 2000, pp. 442–455.
- ^ Гринвуд и Эрншоу 1998, п. 844.
- ^ Jaccaud et al. 2005 г., п. 3.
- ^ Pitzer, Kenneth S. (1975). "Fluorides of radon and element 118". Журнал химического общества, химические коммуникации (18): 760b–761. Дои:10.1039/C3975000760B.
- ^ Khriachtchev, Leonid; Pettersson, Mika; Runeberg, Nino; Lundell, Jan; Räsänen, Markku (2000). "A stable argon compound". Природа. 406 (6798): 874–876. Bibcode:2000Natur.406..874K. Дои:10.1038/35022551. PMID 10972285. S2CID 4382128.
- ^ Lidin, Molochko & Andreeva 2000, п. 252.
- ^ Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. (2010). Principles of chemistry: The molecular Science. Cengage Learning. п. 156. ISBN 978-0-495-39079-4. Получено 7 мая 2011.
- ^ Wiberg, Wiberg & Holleman 2001, п. 422.
- ^ Schlöder, T.; Riedel, S. (2012). "Investigation of Heterodimeric and Homodimeric Radical Cations of the Series: [F2О2]+, [F2Cl2]+, [Cl2О2]+, [F4]+, and [Cl4]+". RSC Advances. 2 (3): 876–881. Дои:10.1039/C1RA00804H.
- ^ Young, J. P .; Haire, R.G .; Peterson, J. R .; Ensor, D. D.; Fellow, R. L. (1981). "Chemical consequences of radioactive decay. 2. spectrophotometric study of the ingrowth of berkelium-249 and californium-249 into halides of einsteinium-253". Неорганическая химия. 20 (11): 3979–3983. Дои:10.1021/ic50225a076.
- ^ Hulet, E. K. (1967). "Mendelevium: Divalency and Other Chemical Properties". Наука. 158 (3800): 486–8. Bibcode:1967Sci...158..486H. Дои:10.1126/science.158.3800.486. PMID 17749069. S2CID 19645593.
- ^ Kratz, J. V. (2003). "Critical evaluation of the chemical properties of the transactinide elements (IUPAC Technical Report)". Чистая и прикладная химия. 75 (1): 103. Дои:10.1351/pac200375010103. S2CID 5172663.
- ^ Kahn, Bernd (2007). Radioanalytical chemistry. ISBN 978-0-387-34122-4. Получено 4 мая 2011.
- ^ Siegemund et al. 2005 г., п. 29.
- ^ "Acids and bases". askthenerd.com. 2011 г.. Получено 18 августа 2012.
- ^ а б c Olah, George A. (2005). "Crossing conventional boundaries in half a century of research". Журнал органической химии. 70 (7): 2413–2429. Дои:10.1021/jo040285o. PMID 15787527.
- ^ Hwang, I. C.; Seppelt, K. (2001). "Gold Pentafluoride: Structure and Fluoride Ion Affinity This work was supported by the Deutsche Forschungsgemeinschaft and the Fond der Chemischen Industrie". Angewandte Chemie International Edition. 40 (19): 3690–3693. Дои:10.1002/1521-3773(20011001)40:19<3690::AID-ANIE3690>3.0.CO;2-5. PMID 11592224.
- ^ Pauling, Linus A. (1960). The nature of the chemical bond and the structure of molecules and crystals: An introduction to modern structural chemistry. Издательство Корнельского университета. стр.454 –464. ISBN 978-0-8014-0333-0.
- ^ Atkins, Peter; Jones, Loretta (2008). Chemical principles: The quest for insight. W. H. Freeman & Co. pp. 184–185. ISBN 978-1-4292-0965-6.
- ^ Emsley, John (1981). "The hidden strength of hydrogen". Новый ученый. 91 (1264): 291–292. Получено 25 декабря 2012.
- ^ Гринвуд и Эрншоу 1998, pp. 812–816.
- ^ Wiberg, Wiberg & Holleman 2001, п. 425.
- ^ Кларк, Джим. "The acidity of the hydrogen halides". Получено 4 сентября 2011.
- ^ а б Chambers, C.; Holliday, A. K. (1975). Modern inorganic chemistry (An intermediate text) (PDF). The Butterworth Group. С. 328–329. Архивировано из оригинал (PDF) на 2013-03-23. Получено 2013-05-03.
- ^ Hannan, Henry J. (1975). Technician's formulation handbook for industrial and household cleaning Products. Lulu.com. п. 31. ISBN 9780615156019.
- ^ Hannan, Henry J. (2010). Course in chemistry for IIT-JEE 2011. Tata McGraw Hill Education Private Limited. pp. 15–22. ISBN 9780070703360.
- ^ Гринвуд и Эрншоу 1998, pp. 816–819.
- ^ Гринвуд и Эрншоу 1998, п. 819.
- ^ Lide 2004, п. 4-76.
- ^ Lide 2004, п. 4-71.
- ^ Lide 2004, п. 4-92.
- ^ Oxtoby, David W.; Gillis, H. Pat; Campion, Alan (2012). Principle of Modern Chemistry. Cengage Learning. п. 693. ISBN 9780840049315.
- ^ Aigueperse et al. 2005 г., "Fluorine Compounds, Inorganic," pp. 25–27.
- ^ а б c d е Storer, Frank Humphreys (1864). First Outlines of a Dictionary of Solubilities of Chemical Substances. Кембридж. С. 278–80. ISBN 978-1-176-62256-2.
- ^ Remy, Heinrich (1956). Treatise on Inorganic Chemistry: Introduction and main groups of the periodic table. Elsevier Publishing Company. п. 383.
- ^ Emeléus & Sharpe 1983, pp. 256–277.
- ^ Уолш, Кеннет А. (01.01.2009). Beryllium chemistry and processing. ASM International. pp. 99–102, 118–119. ISBN 978-0-87170-721-5.
- ^ Mackay, Mackay & Henderson 2002, п. 243–244.
- ^ Hertz, Raymond K. (1987). "General analytical chemistry of beryllium". In Coyle, Francis T. (ed.). Chemical analysis of metals: a symposium. ASTM. С. 74–75. ISBN 978-0-8031-0942-1.
- ^ F. W. B. Einstein; P. R. Rao; James Trotter; Neil Bartlett (1967). "The crystal structure of gold trifluoride". Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 4: 478–482. Дои:10.1039/J19670000478.
- ^ Wiberg, Wiberg & Holleman 2001, п. 1286.
- ^ Wiberg, Wiberg & Holleman 2001, п. 1047.
- ^ Sobolev, Boris Petrovich (2001). The Rare Earth Trifluorides: Introduction to materials science of multicomponent metal fluoride crystals. Institut d'Estudis Catalans. п. 51. ISBN 978-84-7283-610-5.
- ^ Kern, S.; Hayward, J.; Roberts, S.; Richardson, J. W.; Rotella, F. J.; Soderholm, L.; Cort, B.; Tinkle, M.; West, M .; Hoisington, D.; Lander, G. A. (1994). "Temperature Variation of the Structural Parameters in Actinide Tetrafluorides". Журнал химической физики. 101 (11): 9333–9337. Bibcode:1994JChPh.101.9333K. Дои:10.1063/1.467963.
- ^ Brown, Paul L.; Mompean, Federico J.; Perrone, Jane; Illemassène, Myriam (2005). Chemical Thermodynamics of Zirconium. Gulf Professional Publishing. п. 144. ISBN 978-0-444-51803-3.
- ^ Lide 2004, pp. 4-60, -76, -92, -96.
- ^ Беккер, С .; Müller, B. G. (1990). "Vanadium Tetrafluoride". Angewandte Chemie International Edition на английском языке. 29 (4): 406–407. Дои:10.1002/anie.199004061.
- ^ Браун, Дэвид; Canterford, J. H .; Colton, Ray (2009). Halides of the Transition Elements: Halides of the first row transition metals, by R. Colton and J. H. Canterford. Вайли. п. 213. Получено 2012-06-06.
- ^ Nakajimȧ, Tsuyoshi; Žemva, Boris; Tressaud, Alain (2009). Advanced Inorganic Fluorides: Synthesis, Characterization, and Applications (1-е изд.). Эльзевир. п.111. ISBN 978-0444720023.
- ^ Emeléus & Sharpe 1983, п. 105.
- ^ Breunig, Hans Joachim. "Bismuth compounds". Kirk-Othmer Encyclopedia of Chemical Technology Volume 4. Джон Вили и сыновья. п. 22.
- ^ Wiberg, Wiberg & Holleman 2001, п. 770.
- ^ Suzuki, Hitomi; Matano, Yoshihiro (2001). Висмуторганическая химия. Эльзевир. п.8. ISBN 978-0-444-20528-5.
- ^ Bartlett, Neil; Lohmann, D. H. (1962). "Dioxygenyl hexafluoroplatinate (V), O2+[PtF6]−". Труды химического общества (3): 115. Дои:10.1039/PS9620000097.
- ^ Bartlett, Neil (1962). "Xenon hexafluoroplatinate (V) Xe+[PtF6]−". Труды химического общества (6): 218. Дои:10.1039/PS9620000197.
- ^ Wiberg, Wiberg & Holleman 2001, п. 594.
- ^ Vogt, T.; Fitch, A. N.; Cockcroft, J. K. (1994). "Crystal and molecular structures of rhenium heptafluoride". Наука. 263 (5151): 1265–67. Bibcode:1994Sci...263.1265V. Дои:10.1126/science.263.5151.1265. PMID 17817431. S2CID 20013073.
- ^ Bayerische Julius-Maximilians-Universität Würzburg 2006, п. 93.
- ^ Technische Universität Berlin (2012). "Prediction of new compounds and new oxidation states". Получено 2012-05-24.
- ^ Riedel, S .; Каупп, М. (2009). "The highest oxidation states of the transition metal elements". Обзоры координационной химии. 253 (5–6): 606–624. Дои:10.1016 / j.ccr.2008.07.014.
- ^ Bayerische Julius-Maximilians-Universität Würzburg 2006, п. 102.
- ^ Weinstock, Bernard; Malm, John G. (September 1958). "Osmium Hexafluoride and its Identity with the Previously Reported Octafluoride". Журнал Американского химического общества. 80 (17): 4466–4468. Дои:10.1021/ja01550a007.
- ^ а б Weldkamp, Achim; Frenking, Gernot (1993). "Quantum-mechanical ab initio investigation of the transition-metal compounds OsO4, OsO3F2, OsO2F4, OsOF6, and OsF8". Chemische Berichte. 126 (6): 1325–1330. Дои:10.1002/cber.19931260609.
- ^ Noury, Stephane; Silvi, Bernard; Gillespie, Ronald J. (2002). "Chemical bonding in hypervalent molecules: Is the octet rule relevant?" (PDF). Неорганическая химия. 41 (8): 2164–2172. Дои:10.1021/ic011003v. PMID 11952370. Получено 23 мая 2012.
- ^ Гринвуд и Эрншоу 1998 С. 198–199.
- ^ Martinie, R. J.; Bultema, J. J.; van der Wal, M. N.; Burkhart, B. J.; van der Griend, D. A.; de Kock, R. L. (2011). "Bond order and chemical properties of BF, CO, and N2" (PDF). Журнал химического образования. 88 (8): 1094–1097. Bibcode:2011JChEd..88.1094M. Дои:10.1021/ed100758t.
- ^ Ellis, Bryan David (2001). Научный эссенциализм. Издательство Кембриджского университета. п. 69. ISBN 978-0521800945.
- ^ а б Aigueperse et al. 2005 г., п. 28.
- ^ Aigueperse et al. 2005 г., п. 30.
- ^ а б c Raghavan, P. S. (1998). Concepts and problems in inorganic Chemistry. Издательство Discovery. С. 164–165. ISBN 9788171414185.
- ^ а б Aigueperse et al. 2005 г., п. 37.
- ^ а б Norman, Nicholas C. (1998). Chemistry of arsenic, antimony and bismuth. Springer. п. 97. ISBN 978-0751403893.
- ^ Christe, K. O .; Wilson, W. W. (1986). "Synthesis and characterization of NF+
4BrF−
4 и NF+
4BrF
4О−
". Неорганическая химия. 25 (11): 1904–1906. Дои:10.1021/ic00231a038. - ^ Дэвис, Стивен Дж .; Rawlins, Wilson T.; Piper, Lawrence G. (1989). "Rate coefficient for the H + NF(a1Δ) reaction" (PDF). The Journal of Physical Chemistry. 93 (3): 1078–1082. Дои:10.1021/j100340a013.
- ^ а б c Murthy, C. Parameshwara (2008). University chemistry, Tom 1. New Age International. pp. 180–182, 206–208. ISBN 978-8122407426.
- ^ Crawford, M.; Klapötke, T. M. (1999). "The trifluorooxonium cation, ИЗ+
3". Journal of Fluorine Chemistry. 99 (2): 151–156. Дои:10.1016/S0022-1139(99)00139-6. - ^ Гринвуд и Эрншоу 1998, п. 639.
- ^ Гринвуд и Эрншоу 1998, п. 686.
- ^ Wiberg, Wiberg & Holleman 2001, п. 435.
- ^ Wiberg, Wiberg & Holleman 2001, п. 436.
- ^ а б Pitzer, Kenneth Sanborn, ed. (1993). Molecular structure and statistical thermodynamics: Selected papers of Kenneth S. Pitzer. 1. World Scientific. п. 111. ISBN 978-9810214395.
- ^ Gmelin, Leopold (1985-07-03). Gmelin handbook of inorganic chemistry: At—Astatine (8-е изд.). Springer-Verlag. п. 224. ISBN 9783540935162.
- ^ Гринвуд и Эрншоу 1998, pp. 828–830.
- ^ Patnaik, Pradyot (2007). A comprehensive guide to the hazardous properties of chemical substances. Джон Вили и сыновья. С. 478–479. ISBN 9780471714583.
- ^ "The Nobel Prize in chemistry 1994". nobelprize.org. Получено 22 декабря 2008.
- ^ Wiberg, Wiberg & Holleman 2001 С. 392–393.
- ^ Новости химии и техники как цитируется Michael Barnes. "Neil Bartlett, emeritus professor of chemistry, dies at 75". University of California Newsroom. Архивировано из оригинал на 2011-10-22. Получено 24 декабря 2011.
- ^ Wiberg, Wiberg & Holleman 2001, п. 438.
- ^ Wiberg, Wiberg & Holleman 2001, п. 400.
- ^ Grosse, A. V.; Kirshenbaum, A. D.; Streng, A. G.; Streng, L. V. (1963). "Krypton Tetrafluoride: Preparation and Some Properties". Наука. 139 (3559): 1047–1048. Bibcode:1963Sci...139.1047G. Дои:10.1126/science.139.3559.1047. PMID 17812982.
- ^ Dixon, D. A.; Wang, T. H.; Grant, D. J.; Peterson, K. A.; Christe, K. O .; Schrobilgen, G. J. (2007). "Heats of Formation of Krypton Fluorides and Stability Predictions for KrF4 and KrF6 from High Level Electronic Structure Calculations". Неорганическая химия. 46 (23): 10016–10021. Дои:10.1021/ic701313h. PMID 17941630.
- ^ Wiberg, Wiberg & Holleman 2001, п. 398.
- ^ а б Riedel, S .; Каупп, М. (2009). "The highest oxidation states of the transition metal elements". Обзоры координационной химии. 253 (5–6): 606–624. Дои:10.1016 / j.ccr.2008.07.014.
- ^ "Technical data sheet 320 Ruthenium tetroxide 0.5% aqueous solution" (PDF). Polysciences, Inc. 2000. p. 1. Archived from оригинал (PDF) 18 августа 2011 г.. Получено 28 декабря 2012.
- ^ Bayerische Julius-Maximilians-Universität Würzburg 2006, п. 34.
- ^ Jensen, William B. (2008). "Is mercury now a transition element?". Журнал химического образования. 85 (9): 1182–1183. Bibcode:2008JChEd..85.1182J. Дои:10.1021/ed085p1182.
- ^ Wang, Xuefang; Эндрюс, Лестер; Riedel, Sebastian; Kaupp, Martin (2007). "Mercury is a transition metal: The first experimental evidence for HgF4". Angewandte Chemie. 119 (44): 8523–8527. Дои:10.1002/ange.200703710.
- ^ Lewars 2008 С. 60–61.
- ^ O'Hagan, D. (2008). "Understanding organofluorine chemistry. An introduction to the C–F bond". Обзоры химического общества. 37 (2): 308–319. Дои:10.1039/b711844a. PMID 18197347.
- ^ а б Siegemund et al. 2005 г., п. 2.
- ^ Siegemund et al. 2005 г., п. 4.
- ^ Jaccaud et al. 2005 г., п. 13.
- ^ Siegemund et al. 2005 г., стр. 3–5.
- ^ а б Carlson & Scmiegel 2005, п. 3.
- ^ Okazoe, Takashi (2009). "Overview on the history of organofluorine chemistry from the viewpoint of material industry" (PDF). Труды Японской академии, серия B. 85 (8): 276–289. Bibcode:2009PJAB...85..276O. Дои:10.2183/pjab.85.276. ЧВК 3621566. PMID 19838009.
- ^ а б Siegemund et al. 2005 г., стр. 7–8.
- ^ а б Sukornick, B. (1989). "Potentially acceptable substitutes for the chlorofluorocarbons". Международный журнал теплофизики. 10 (3): 553–561. Bibcode:1989IJT....10..553S. Дои:10.1007/BF00507978. S2CID 128953494.
- ^ а б Siegemund et al. 2005 г., п. 18.
- ^ Urben, Peter (2006). Bretherick's Handbook of Reactive Chemical Hazards (7-е изд.). Surendra Kumar. п. 269. ISBN 9780123725639.
- ^ Siegemund et al. 2005 г., п. 5.
- ^ Mendicino, L. (1999). Environmental issues in the electronics and semiconductor industries. Электрохимическое общество. п. 116. ISBN 9781566772303.
- ^ а б Knepper, Thomas P.; Lange, Frank T. (2011). Polyfluorinated Chemicals and Transformation Products. Springer. п.27. ISBN 9783642218712.
- ^ а б Siegemund et al. 2005 г., п. 32.
- ^ Калифорнийский университет в Беркли. "Research into gecko adhesion". Архивировано из оригинал 14 октября 2007 г.. Получено 29 апреля 2011.
- ^ Carlson & Scmiegel 2005, стр. 3–4.
- ^ а б Carlson & Scmiegel 2005, п. 4.
- ^ Kharitonov, A. P.; Taege, R.; Ferrier, G.; Piven, N. P. (2005). "The kinetics and mechanism of the direct fluorination of polyethylenes" (PDF). Surface Coatings International Part B: Coatings Transactions. 88 (3): 201–212. Дои:10.1007/BF02699574. S2CID 94554719. Архивировано из оригинал (PDF) на 2013-05-15. Получено 2013-05-03.
- ^ Rhoades, David Walter (2008). Broadband dielectric spectroscopy studies of Nafion. п. 2. ISBN 9780549785408.
- ^ Martin, John Wilson (2007). Concise encyclopedia of the structure of materials. Эльзевир. pp. 187–194. ISBN 978-0-08-045127-5.
Проиндексированные ссылки
- Bayerische Julius-Maximilians-Universität Würzburg (2006). The Highest Oxidation States of the 5d Transition Metals: a Quantum-Chemical Study (PDF) (Отчет). Химическое общество. Получено 2011-06-20.
- Emeléus, H.J .; Sharpe, A. G. (1983). Успехи неорганической химии и радиохимии (27-е изд.). Академическая пресса. ISBN 978-0-12-023627-5.
- Greenwood, N. N .; Эрншоу, А. (1998). Химия элементов (2-е изд.). Баттерворт Хайнеманн. ISBN 978-0-7506-3365-9.
- Lewars, Errol G. (2008). Modeling marvels: Computational anticipation of novel molecules. Springer. ISBN 978-1-4020-6972-7.
- Лиде, Дэвид Р. (2004). Справочник по химии и физике (84-е изд.). CRC Press. ISBN 978-0-8493-0566-5.
- Lidin, P. A.; Molochko, V. A.; Andreeva, L. L. (2000). Химические свойства неорганических веществ [Chemical properties of inorganic substances] (на русском). Khimiya. ISBN 978-5-7245-1163-6.
- Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. (2002). Введение в современную неорганическую химию (6-е изд.). CRC Press. ISBN 978-0-7487-6420-4.
- Ульманн, Франц, изд. (2005). Encyclopedia of Industrial Chemistry. Wiley-VCH. ISBN 978-3-527-30673-2.
- Aigueperse, Jean; Mollard, Paul; Девилье, Дидье; Chemla, Marius; Фарон, Роберт; Romano, Renée; Cuer, Jean Pierre (2000). "Fluorine Compounds, Inorganic". Энциклопедия промышленной химии Ульмана. Дои:10.1002/14356007. ISBN 978-3-527-30673-2.
- Carlson, D. Peter; Scmiegel, Walter (2000). "Fluoropolymers, Organic". Энциклопедия промышленной химии Ульмана. Дои:10.1002/14356007.a11_393. ISBN 978-3527306732.
- Жако, Майкл; Фарон, Роберт; Девилье, Дидье; Романо, Рене (2000). "Фтор". Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a11_293. ISBN 978-3527306732.
- Виберг, Эгон; Виберг, Нильс; Holleman, Arnold Frederick (2001). Inorganic chemistry. Академическая пресса. ISBN 978-0-12-352651-9. Получено 3 марта 2011.
- Yaws, Carl L.; Braker, William (2001). "Фтор". Matheson Gas Data Book, Book 2001. McGraw-Hill Professional. ISBN 978-0-07-135854-5.
