Диоксид урана - Uranium dioxide
 | |
| Имена | |
|---|---|
| Имена ИЮПАК Диоксид урана Оксид урана (IV) | |
| Другие имена Урания Оксид урана | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.014.273 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| UO2 | |
| Молярная масса | 270,03 г / моль |
| Внешность | черный порошок |
| Плотность | 10,97 г / см3 |
| Температура плавления | 2865 ° С (5189 ° F, 3138 К) |
| нерастворимый | |
| Структура | |
| Флюорит (кубический), cF12 | |
| FM3м, №225 | |
а = 547,1 вечера [1] | |
| Тетраэдр (O2−); кубическая (UIV) | |
| Термохимия | |
Стандартный моляр энтропия (S | 78 Дж · моль−1· K−1[2] |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | −1084 кДж · моль−1[2] |
| Опасности | |
| Паспорт безопасности | ICSC 1251 |
| Пиктограммы GHS |    |
| Сигнальное слово GHS | Опасность |
| H300, H330, H373, H400, H410, H411 | |
| P260, P264, P270, P271, P273, P284, P301 + 310, P304 + 340, P310, P314, P320, P321, P330, P391, P403 + 233, P405, P501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Нет данных |
| Родственные соединения | |
| Окись триурана Триоксид урана | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Диоксид урана или же оксид урана (IV) (UО2), также известный как Урания или же оксид урана, является окись из уран, и это черный, радиоактивный, кристаллический порошок, который естественным образом встречается в минерале уранинит. Он используется в ядерное топливо стержни в ядерные реакторы. Смесь урана и плутоний диоксиды используются как МОКС-топливо. До 1960 года он использовался как желтый и черный цвет в керамические глазури и стекло.
Производство
Диоксид урана производится сокращение триоксид урана с водород.
- UO3 + H2 → UO2 + H2O при 700 ° C (973 K)
Эта реакция играет важную роль в создании ядерное топливо через ядерная переработка и обогащение урана.
Химия
Структура
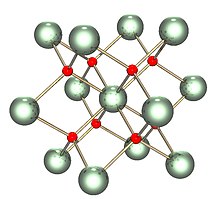
Твердое тело изоструктурный with (имеет ту же структуру, что и) флюорит (фторид кальция ), где каждый U окружен восемью O ближайшими соседями в кубической структуре. Кроме того, диоксиды церий, торий, плутоний и нептуний имеют такую же структуру. Никакие другие диоксиды элементов не имеют структуры флюорита. При плавлении измеренная средняя координация U-O снижается с 8 в кристаллическом твердом теле (UO8 кубов), до 6,7 ± 0,5 (при 3270 К) в расплаве.[3] Модели, согласующиеся с этими измерениями, показывают, что расплав состоит в основном из UO.6 и UO7 многогранные единицы, где примерно2⁄3 связей между многогранниками являются угловыми и1⁄3 разделяют границу.[3]

Диоксид урана

Спеченные таблетки диоксида урана
Окисление
Диоксид урана окисленный в контакте с кислород к октаоксид триурана.
- 3 UO2 + O2 → U3О8 при 700 ° С (970 К)
В электрохимия диоксида урана детально исследована как гальваническая коррозия диоксида урана контролирует скорость, с которой используется ядерное топливо растворяется. Видеть отработанное ядерное топливо для получения дополнительной информации. Вода увеличивает скорость окисления плутоний и уран металлы.[4][5]
Карбонизация
Диоксид урана карбонизированный в контакте с углерод, формируя карбид урана и монооксид углерода.
UO2 + 4 C → UC2 + 2 СО
Этот процесс должен выполняться под инертный газ в качестве карбид урана легко окисляется обратно в оксид урана.
Использует
Ядерное топливо
UO2 используется в основном как ядерное топливо, а именно как UO2 или в виде смеси UO2 и PuO2 (диоксид плутония ) называется смешанным оксидом (МОКС-топливо ), в виде топливные стержни в ядерные реакторы.
Обратите внимание, что теплопроводность диоксида урана очень мало по сравнению с уран, нитрид урана, карбид урана и цирконий облицовочный материал. Такая низкая теплопроводность может привести к локальному перегреву в центрах топливных таблеток. На приведенном ниже графике показаны различные температурные градиенты в различных топливных соединениях. Для этих видов топлива плотность тепловой энергии одинакова, а диаметр всех гранул одинаков.[нужна цитата ]

Топливные таблетки из оксида урана

Контейнеры для исходного материала для производства топливных таблеток из диоксида урана на заводе в России

Зависимость теплопроводности металлического циркония и диоксида урана от температуры
Цвет для стеклокерамической глазури
Оксид урана (уран) использовался для окрашивания стекла и керамики до Второй мировой войны, и до тех пор, пока не было обнаружено применение радиоактивности, это было его основным применением. В 1958 году военные США и Европы снова разрешили его коммерческое использование в качестве обедненного урана, и его использование снова началось в более ограниченных масштабах. Керамические глазури на основе урана становятся темно-зелеными или черными при обжиге в восстановительной печи или при обжиге UO2 используется; чаще его используют при окислении для получения ярко-желтой, оранжевой и красной глазури.[6] Оранжевого цвета Fiestaware хорошо известный пример продукта с глазурью цвета урана. Урановое стекло от бледно-зеленого до желтого и часто имеет ярко выраженные флуоресцентные свойства. Урания также использовался в составах эмаль и фарфор. Можно определить с помощью счетчик Гейгера если глазурь или стекло, произведенные до 1958 года, содержат уран.
Другое использование
До осознания вреда излучения уран использовался в искусственных зубах и зубных протезах, поскольку его легкая флуоресценция делала протезы более похожими на настоящие зубы в различных условиях освещения.
Истощен UO2 (ДУЭТ2) можно использовать как материал для радиационная защита. Например, ДУКРЕТ это "тяжелый конкретный "материал, где гравий заменен агрегатом диоксида урана; этот материал исследуется на предмет использования бочки за радиоактивные отходы. Бочки также могут быть изготовлены из ДУО.2-стали металлокерамика, а композитный материал сделанный из совокупность диоксида урана, служащего радиационной защитой, графит и / или Карбид кремния выступая в качестве нейтронное излучение поглотитель и замедлитель, а также сталь в качестве матрицы, высокая теплопроводность которой позволяет легко отводить остаточное тепло.[нужна цитата ]
Диоксид обедненного урана можно также использовать в качестве катализатор, например для деградации летучие органические соединения в газовой фазе, окисление из метан к метанол, и удаление сера из нефть. Он имеет высокую эффективность и долгосрочную стабильность при использовании для уничтожения летучих органических соединений по сравнению с некоторыми коммерческими продуктами. катализаторы, Такие как драгоценные металлы, TiO2, и Co3О4 катализаторы. В этой области проводится много исследований, причем ОУ предпочитают в качестве уранового компонента из-за его низкой радиоактивности.[7]
Использование диоксида урана в качестве материала для перезаряжаемые батарейки расследуется. Батареи могли иметь высокий удельная мощность и потенциал 4,7 В на ячейку. Еще одно исследуемое приложение находится в фотоэлектрохимические ячейки для производства водорода с помощью солнечной энергии, где UO2 используется как фотоанод. Раньше диоксид урана также использовался в качестве проводника тепла для ограничения тока (резистор URDOX), что было первым применением его полупроводниковых свойств.[нужна цитата ]
Диоксид урана также является самым сильным из известных пьезомагнетиков в антиферромагнитном состоянии, наблюдаемом при криогенных температурах ниже 30 ° С. кельвины. UO2 показывает линейную магнитострикцию, меняющую знак со знаком приложенного магнитного поля, и переключение магнитоупругой памяти при магнитных полях около 180 000 Э.[8]
Свойства полупроводника
В запрещенная зона диоксида урана сопоставима с таковыми из кремний и арсенид галлия, близкая к оптимуму эффективности в зависимости от кривой ширины запрещенной зоны для поглощения солнечного излучения, что предполагает его возможное использование для очень эффективного солнечные батареи на основе Диод Шоттки структура; он также поглощает на пяти разных длинах волн, включая инфракрасный, что еще больше повышает его эффективность. Его собственная проводимость при комнатной температуре примерно такая же, как у монокристалл кремний.[9]
В диэлектрическая постоянная диоксида урана составляет около 22, что почти вдвое больше, чем кремния (11,2) и GaAs (14,1). Это преимущество перед Si и GaAs при построении интегральные схемы, так как это может позволить более высокую плотность интеграции с более высокими напряжения пробоя и с меньшей восприимчивостью к CMOS туннелирование авария.
В Коэффициент Зеебека диоксида урана при комнатной температуре составляет около 750 мкВ / К, что значительно выше, чем 270 мкВ / К теллурид таллия и олова (Tl2SnTe5) и теллурид германия таллия (Tl2GeTe5) и из висмут -теллур сплавы, другие материалы, перспективные для термоэлектрическая энергия приложения и Элементы Пельтье.
В радиоактивный распад влияние 235U и 238U на его полупроводниковые свойства не измерялся с 2005 г.[Обновить]. Из-за медленной скорости распада этих изотопов он не должен существенно влиять на свойства солнечных элементов и термоэлектрических устройств из диоксида урана, но может стать важным фактором для СБИС чипсы. Использование обедненный уран оксид необходим по этой причине. Захват альфа-частиц, испускаемых во время радиоактивного распада в виде атомов гелия в кристаллической решетке, также может вызывать постепенные долгосрочные изменения ее свойств.[нужна цитата ]
В стехиометрия материала резко влияет на его электрические свойства. Например, электропроводность UO1.994 на порядки ниже при более высоких температурах, чем проводимость UO2.001.
Диоксид урана, как и U3О8, это керамика материал, способный выдерживать высокие температуры (около 2300 ° C по сравнению с максимум 200 ° C для кремния или GaAs), что делает его пригодным для высокотемпературных применений, таких как термофотовольтаические устройства.
Диоксид урана также устойчив к радиация повреждение, что делает его полезным для круто устройства для специальных военных и аэрокосмический Приложения.
А Диод Шоттки из U3О8 и p-n-p транзистор UO2 были успешно изготовлены в лаборатории.[10]
Токсичность
Известно, что диоксид урана поглощается фагоцитоз в легких.[11]
Смотрите также
Рекомендации
- ^ Лейндерс, Грегори; Кардинаэлс, Томас; Биннеманс, Коэн; Verwerft, Марк (2015). «Точные измерения параметров решетки стехиометрического диоксида урана». Журнал ядерных материалов. 459: 135–42. Bibcode:2015JNuM..459..135L. Дои:10.1016 / j.jnucmat.2015.01.029.
- ^ а б Зумдал, Стивен С. (2009). Химические принципы 6-е изд.. Компания Houghton Mifflin. п. A23. ISBN 978-0-618-94690-7.
- ^ а б Скиннер, Л. Б .; Benmore, C.J .; Weber, J. K. R .; Уильямсон, М. А .; Tamalonis, A .; Hebden, A .; Винцек, Т .; Alderman, O.L.G .; Guthrie, M .; Leibowitz, L .; Париз, Дж. Б. (2014). «Структура и динамика расплавленного диоксида урана». Наука. 346 (6212): 984–7. Bibcode:2014Наука ... 346..984С. Дои:10.1126 / science.1259709. OSTI 1174101. PMID 25414311.
- ^ Хашке, Джон М; Аллен, Томас H; Моралес, Луис А. (1999). «Реакции диоксида плутония с водой и кислородно-водородными смесями: механизмы коррозии урана и плутония» (PDF). Получено 2009-06-06.
- ^ Хашке, Джон М; Аллен, Томас H; Моралес, Луис А. (2001). «Реакции диоксида плутония с водой и водородно-кислородными смесями: механизмы коррозии урана и плутония». Журнал сплавов и соединений. 314 (1–2): 78–91. Дои:10.1016 / S0925-8388 (00) 01222-6.
- ^ Örtel, Стефан. Уран в дер Керамик. Geschichte - Technik - Hersteller.
- ^ Hutchings, Graham J .; Хенеган, Кэтрин С .; Хадсон, Ян Д.; Тейлор, Стюарт Х. (1996). «Катализаторы на основе оксида урана для разрушения летучих хлорорганических соединений». Природа. 384 (6607): 341–3. Bibcode:1996Натура.384..341H. Дои:10.1038 / 384341a0.
- ^ M. Jaime et al. (2017), Пьезомагнетизм и магнитоупругая память в диоксиде урана. Nature Communications 8, 99.
- ^ An, Yong Q .; Тейлор, Антуанетта Дж .; Конрадсон, Стивен Д.; Тругман, Стюарт А .; Дуракевич, Томаш; Родригес, Джордж (2011). "Сверхбыстрая динамика прыжка 5ж Электроны в изоляторе Мотта UO2 Изучено методом фемтосекундной спектроскопии накачки и зонда ». Письма с физическими проверками. 106 (20): 207402. Bibcode:2011ПхРвЛ.106т7402А. Дои:10.1103 / PhysRevLett.106.207402. PMID 21668262.
- ^ Кроткий, Томас Т .; фон Родерн, Б. (2008). «Полупроводниковые приборы из оксидов актинидов». Вакуум. 83 (1): 226–8. Bibcode:2008Vacuu..83..226M. Дои:10.1016 / j.vacuum.2008.04.005.
- ^ Принципы биохимической токсикологии. Тимбрелл, Джон. PA 2008 ISBN 0-8493-7302-6[страница нужна ]
дальнейшее чтение
- Barrett, S.A .; Якобсон, А. Дж .; Tofield, B.C .; Фендер, Б. Э. Ф. (1982). «Получение и структура оксида бария и урана BaUO3 + x». Acta Crystallographica Раздел B. 38 (11): 2775. Дои:10.1107 / S0567740882009935.
внешняя ссылка
- Полупроводниковые свойства оксидов урана
- Список бесплатных словарей по диоксиду урана
- В Диоксид урана International Bio-Analytical Industries, Inc.







