Диоксид свинца - Lead dioxide
 | |
| Имена | |
|---|---|
| Название ИЮПАК Оксид свинца (IV) | |
| Другие имена Оксид свинца Платтнерит | |
| Идентификаторы | |
| ChemSpider | |
| ECHA InfoCard | 100.013.795 |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 1872 |
| Характеристики | |
| PbO2 | |
| Молярная масса | 239,1988 г / моль |
| Внешность | темно-коричневый, черный порошок |
| Плотность | 9,38 г / см3 |
| Температура плавления | 290 ° С (554 ° F, 563 К) разлагается |
| нерастворимый | |
| Растворимость | растворим в уксусная кислота не растворим в алкоголь |
| 2.3 | |
| Структура | |
| шестиугольник | |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материалов |
Классификация ЕС (DSD) (устарело) | Repr. Кот. 1/3 |
| R-фразы (устарело) | R61, R20 / 22, R33, R62, R50 / 53 |
| S-фразы (устарело) | S53, S45, S60, S61 |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Родственные соединения | |
Другой катионы | Углекислый газ Диоксид кремния Диоксид германия Диоксид олова |
| Оксид свинца (II) Оксид свинца (II, IV) | |
Родственные соединения | Оксид таллия (III) Оксид висмута (III) |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Оксид свинца (IV) это неорганическое соединение с формулой PbO2. Это окись где вести находится в степень окисления из +4.[1] Это темно-коричневое твердое вещество, не растворимое в воде.[2] Он существует в двух кристаллических формах. Он имеет несколько важных приложений в электрохимия, в частности, как положительная пластина свинцово-кислотные батареи.
Характеристики
Физический

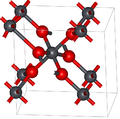
Диоксид свинца имеет два основных полиморфа, альфа и бета, которые встречаются в природе как редкие минералы. скрутинит и платтнерит соответственно. В то время как бета-форма была обнаружена в 1845 году,[3] α-PbO2 был впервые обнаружен в 1946 году и обнаружен как природный минерал в 1988 году.[4]
Альфа-форма имеет ромбический симметрия космическая группа ПБХН (№60), Символ Пирсона oP12, постоянные решетки а = 0,497 нм, б = 0,596 нм, c = 0,544 нм, Z = 4 (четыре формульные единицы на элементарную ячейку).[4] Атомы свинца шестикоординатные.
Симметрия бета-формы равна четырехугольный, космическая группа P42/ мм (№ 136), Символ Пирсона tP6, постоянные решетки а = 0,491 нм, c = 0,3385 нм, Z = 2[5] и связанные с рутил структура и может быть представлена как содержащая столбцы октаэдров, разделяющих противоположные края и соединенных с другими цепочками углами. Это контрастирует с альфа-формой, где октаэдры соединены смежными ребрами, образуя зигзагообразные цепочки.[4]
Химическая
Диоксид свинца разлагается при нагревании на воздухе следующим образом:
Стехиометрию конечного продукта можно контролировать, изменяя температуру - например, в приведенной выше реакции первая стадия происходит при 290 ° C, вторая при 350 ° C, третья при 375 ° C и четвертая при 600 ° C. Кроме того, Pb2О3 можно получить разложением PbO2 при 580–620 ° C и давлении кислорода 1400 атм (140 МПа). Следовательно, термическое разложение диоксида свинца является обычным способом получения различных оксидов свинца.[6]
Диоксид свинца - это амфотерный соединение с преобладающими кислотными свойствами. Растворяется в сильных основаниях с образованием гидроксиотвес ион, [Pb (OH)6]2−:[2]
- PbO2 + 2 NaOH + 2 Н2O → Na2[Pb (OH)6]
Он также реагирует с основными оксидами в расплаве, давая ортоплюмбаты M4[PbO4].
Из-за нестабильности его Pb4+ катион, диоксид свинца реагирует с горячими кислотами, превращаясь в более стабильный Pb2+ состояние и высвобождение кислорода:[6]
- 2 PbO2 + 2 ЧАС2ТАК4 → 2 PbSO4 + 2 часа2О + О2
- 2 PbO2 + 4 HNO3 → 2 Pb (НЕТ3)2 + 2 часа2О + О2
- PbO2 + 4 HCl → PbCl2 + 2 часа2O + Cl2
Однако эти реакции протекают медленно.
Двуокись свинца хорошо известна как окислитель, с примерами реакций, перечисленными ниже:[7]
- 2 MnSO4 + 5 PbO2 + 6 HNO3 → 2 HMnO4 + 2 PbSO4 + 3 Pb (НЕТ3)2 + 2 часа2О
- 2 Cr (ОН)3 + 10 КОН + 3 ПБО2 → 2 K2CrO4 + 3 тыс.2PbO2 + 8 часов2О
Электрохимический
Хотя формула диоксида свинца номинально обозначается как PbO2фактическое отношение кислорода к свинцу варьируется от 1,90 до 1,98 в зависимости от метода подготовки. Дефицит кислорода (или избыток свинца) приводит к характерному металлическому проводимость диоксида свинца, с удельное сопротивление всего 10−4 Ом · см, который используется в различных электрохимических приложениях. Как и металлы, диоксид свинца имеет характеристику электродный потенциал, И в электролиты он может быть поляризован как анодно и катодно. Электроды из диоксида свинца имеют двойное действие, то есть ионы свинца и кислорода принимают участие в электрохимических реакциях.[8]
Производство
Химические процессы
Диоксид свинца производят в промышленных масштабах несколькими способами, в том числе окислением красный свинец (Pb3О4) в щелочной суспензии в атмосфере хлора,[6] реакция свинец (II) ацетат с «хлорной извести» (гипохлорит кальция ),[9][10] Реакция Pb3О4 с азотная кислота также содержит диоксид:[2][11]
- Pb3О4 + 4 HNO3 → PbO2 + 2 Pb (НЕТ3)2 + 2 часа2О
PbO2 реагирует с гидроксид натрия с образованием иона гексагидроксоплюмбата (IV) [Pb (OH)6]2−, растворим в воде.
Электролиз
Альтернативный метод синтеза: электрохимический: диоксид свинца образуется на чистом свинце, в разбавленном серная кислота при анодной поляризации при потенциале электрода около +1,5 В при комнатной температуре. Эта процедура используется для крупномасштабного промышленного производства PbO.2 аноды. Свинец и медь электроды погружают в серную кислоту со скоростью 5–10 л / мин. Электроосаждение проводится гальваностатически, приложив ток около 100 А / м2 около 30 минут. Недостатком свинцового электрода является его мягкость, особенно по сравнению с твердым и хрупким PbO.2 который имеет Твердость по Моосу из 5.5.[12] Несоответствие механических свойств приводит к отслаиванию покрытия. Таким образом, альтернативным методом является использование более твердых материалов, таких как титан, ниобий, тантал или графит и депонировать PbO2 на них из нитрат свинца (II) в статической или проточной азотной кислоте. Подложка обычно пескоструйный перед нанесением для удаления оксидов и загрязнений с поверхности, а также для увеличения шероховатости поверхности и адгезии покрытия.[13]
Приложения
Диоксид свинца используется в производстве совпадения, пиротехника, красители и лечение сульфид полимеры. Он также используется при строительстве высоковольтных молниеотводы.[6]
Диоксид свинца используется как анод материал в электрохимии. β-PbO2 является более привлекательной для этой цели, чем α-форма, поскольку имеет относительно низкую удельное сопротивление, хороший коррозия сопротивление даже в низко-pH средний и высокий перенапряжение для выделения кислорода в электролитах на основе серной и азотной кислоты. Диоксид свинца также может противостоять хлор эволюция в соляная кислота. Аноды из диоксида свинца недороги и когда-то использовались вместо обычных. платина и графит электроды для регенерации дихромат калия. Они также применялись в качестве кислородных анодов для гальваника медь и цинк в сульфатных ваннах. В органическом синтезе аноды из диоксида свинца применялись для производства глиоксиловая кислота из Щавелевая кислота в сернокислотном электролите.[13]
Наиболее важное использование диоксида свинца в качестве катода свинцово-кислотные батареи. Его полезность связана с аномальной металлической проводимостью PbO.2. В свинцово-кислотные батарея накапливает и высвобождает энергию, сдвигая равновесие (пропорциональное соотношение) между металлическим свинцом, диоксидом свинца и солями свинца (II) в серная кислота.
- Pb + PbO2 + 2 HSO−
4 + 2 часа+ → 2 PbSO4 + 2 часа2О E° = +2,05 В
Безопасность
Соединения свинца - это яды.[14]
Рекомендации
- ^ Кроткий, Терри Л .; Гарнер, Лия Д. (01.02.2005). «Электроотрицательность и облигационный треугольник». Журнал химического образования. 82 (2): 325. Дои:10.1021 / ed082p325. ISSN 0021-9584.
- ^ а б c Иглсон, Мэри (1994). Краткая энциклопедия химии. Вальтер де Грюйтер. п. 590. ISBN 978-3-11-011451-5.
- ^ Хайдингер, В. (1845). "Zweite Klasse: Geogenide. II. Ordnung. Baryte VII. Bleibaryt. Plattnerit.". Handbuch der Bestimmenden Mineralogie (PDF) (на немецком). Вена: Браумюллер и Зайдель. п. 500.
- ^ а б c Taggard, J. E., Jr .; и другие. (1988). "Скутинит, природное присутствие α-PbO2 из Бингема, Нью-Мексико, США, и Мапими, Мексика " (PDF). Канадский минералог. 26: 905.
- ^ Harada, H .; Sasa, Y .; Уда, М. (1981). "Кристаллические данные для β-PbO2" (PDF). Журнал прикладной кристаллографии. 14 (2): 141. Дои:10.1107 / S0021889881008959.
- ^ а б c d Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. п. 386. ISBN 978-0-08-037941-8.
- ^ Кумар Де, Анил (2007). Учебник неорганической химии. New Age International. п. 387. ISBN 978-81-224-1384-7.
- ^ Барак, М. (1980). Электрохимические источники энергии: первичные и вторичные батареи.. ИЭПП. С. 184 и сл. ISBN 978-0-906048-26-9.
- ^ М. Баулдер (1963). «Оксид свинца (IV)». В Г. Брауэре (ред.). Справочник по препаративной неорганической химии, 2-е изд.. 1. Нью-Йорк, Нью-Йорк: Academic Press. п. 758.
- ^ Виберг, Нильс (2007). Lehrbuch der Anorganischen Chemie [Учебник неорганической химии] (на немецком). Берлин: де Грюйтер. п. 919. ISBN 978-3-11-017770-1.
- ^ Сатклифф, Артур (1930). Практическая химия для продвинутых студентов (Изд. 1949 г.). Лондон: Джон Мюррей.
- ^ «Платтнерит: информация и данные о минералах платтнерита». www.mindat.org. Получено 12 апреля 2018.
- ^ а б Франсуа Кардарелли (2008). Справочник по материалам: краткий настольный справочник. Springer. п. 574. ISBN 978-1-84628-668-1.
- ^ «ДИОКСИД СВИНЦА». hazar.com. Получено 12 апреля 2018.

