Электролит - Electrolyte
An электролит это вещество, которое производит электропроводящий раствор при растворении в полярный растворитель, например, вода. Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если электрический потенциал При нанесении на такой раствор катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду, который имеет дефицит электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Сюда входят наиболее растворимые соли, кислоты, и базы. Некоторые газы, такие как хлористый водород, в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды ) и синтетические полимеры (например., сульфонат полистирола ), названный "полиэлектролиты ", которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлористый, кальций, магний, и фосфат являются примерами электролитов.
В медицине замена электролита необходим, когда у человека длительная рвота или диарея, а также в ответ на интенсивную спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, пероральная регидратация решение, Суэро Орал, или же Педиалит ) и спортсменов (спортивные напитки ). Мониторинг электролитов важен при лечении анорексия и булимия.
Этимология
Слово электролит происходит от Древнегреческий ήλεκτρο- (ēlectro-), префикс, связанный с электричеством, и λυτός (Lytos), что означает «можно развязать или ослабить».
История
В его диссертации 1884 г. Сванте Аррениус выдвинул свое объяснение того, как твердые кристаллические соли при растворении распадаются на парные заряженные частицы, за что он получил Нобелевскую премию по химии 1903 года.[1][2][3][4]
Объяснение Аррениуса заключалось в том, что при образовании раствора соль распадается на заряженные частицы, которые Майкл Фарадей дал имя "ионы «много лет назад. Фарадей считал, что ионы образуются в процессе электролиз. Аррениус предположил, что даже в отсутствие электрического тока растворы солей содержат ионы. Таким образом, он предположил, что химические реакции в растворе - это реакции между ионами.[2][3][4]
Формирование
Растворы электролитов обычно образуются, когда соль помещается в растворитель такие как вода и отдельные компоненты диссоциируют из-за термодинамический взаимодействия между молекулами растворителя и растворенного вещества в процессе, называемом "сольватация ". Например, когда поваренная соль (хлорид натрия ) NaCl помещается в воду, соль (твердое вещество) растворяется на составляющие ионы в соответствии с реакцией диссоциации
- NaCl(s) → Na+(водн.) + Cl−(водн.)
Кроме того, вещества могут реагировать с водой с образованием ионов. Например, углекислый газ газ растворяется в воде с образованием раствора, содержащего гидроксоний, карбонат, и гидрокарбонат ионы.
Расплавленные соли также могут быть электролиты, поскольку, например, когда хлорид натрия расплавлен, жидкость проводит электричество. В частности, ионные жидкости, которые представляют собой расплавленные соли с температурой плавления ниже 100 ° C,[5] представляют собой тип неводных электролитов с высокой проводимостью и, таким образом, находят все больше и больше применений в топливных элементах и батареях.[6]
Электролит в растворе можно описать как «концентрированный», если он имеет высокую концентрацию ионов, или «разбавленный», если он имеет низкую концентрацию. Если большая часть растворенного вещества диссоциирует с образованием свободных ионов, электролит сильный; если большая часть растворенного вещества не диссоциирует, электролит слаб. Свойства электролитов можно использовать с помощью электролиза для извлечения составляющих элементов и соединений, содержащихся в растворе.
Щелочноземельные металлы образуют гидроксиды, которые являются сильными электролитами с ограниченной растворимостью в воде из-за сильного притяжения между составляющими их ионами. Это ограничивает их применение в ситуациях, когда требуется высокая растворимость.[7]
Физиологическое значение
В физиология, первичные ионы электролитов натрий (Na+), калий (K+), кальций (Ca2+), магний (Мг2+), хлористый (Cl−), гидрофосфат (HPO42−), и гидрокарбонат (HCO3−).[8] Символы электрического заряда плюс (+) и минус (-) указывают на то, что вещество имеет ионную природу и имеет несбалансированное распределение электронов, что является результатом химическая диссоциация. Натрий является основным электролитом, содержащимся во внеклеточной жидкости, а калий - основным внутриклеточным электролитом;[9] оба участвуют в балансе жидкости и контроле артериального давления.[10]
Все известные многоклеточные формы жизни требуют тонкого и сложного баланса электролитов между внутриклеточный и внеклеточный среды.[11] В частности, поддержание точного осмотический градиенты электролитов важно. Такие градиенты влияют и регулируют гидратация тела, а также pH крови, и имеют решающее значение для нерв и мышца функция. У живых организмов существуют различные механизмы, которые жестко контролируют концентрацию различных электролитов.
И мышечная ткань, и нейроны считаются электрическими тканями тела. Мышцы и нейроны активируются за счет активности электролитов между внеклеточной жидкости или же тканевая жидкость, и внутриклеточная жидкость. Электролиты могут проникать или покидать клеточную мембрану через специализированные белковые структуры, встроенные в клеточную мембрану. плазматическая мембрана называется "ионные каналы ". Например, сокращение мышц зависит от наличия кальция (Ca2+), натрий (Na+) и калий (K+). Без достаточного уровня этих ключевых электролитов может возникнуть мышечная слабость или сильные мышечные сокращения.
Электролитный баланс поддерживается пероральным или в экстренных случаях внутривенным (IV) приемом электролитсодержащих веществ и регулируется гормоны, в целом с почки вымывание лишних уровней. У человека электролит гомеостаз регулируется гормонами, такими как антидиуретические гормоны, альдостерон и гормоны паращитовидной железы. Серьезный электролитные нарушения, Такие как обезвоживание и гипергидратация, может привести к сердечным и неврологическим осложнениям и, если они не будут быстро решены, приведет к неотложная медицинская помощь.
Измерение
Измерение электролитов - это обычно выполняемая диагностическая процедура, выполняемая через анализ крови с ионоселективные электроды или же анализ мочи к медицинские технологи. Интерпретация этих ценностей несколько бессмысленна без анализа история болезни и зачастую невозможно без параллельных измерений функция почек. Наиболее часто измеряемыми электролитами являются натрий и калий. Уровни хлоридов измеряются редко, за исключением газ артериальной крови интерпретации, поскольку они по своей сути связаны с уровнями натрия. Одним из важных тестов, проводимых на моче, является удельный вес тест для определения возникновения электролитный дисбаланс.
Регидратация
В пероральная регидратационная терапия, напитки с электролитом, содержащие соли натрия и калия, восстанавливают концентрацию воды и электролитов в организме после обезвоживания, вызванного упражнение, чрезмерное употребление алкоголя, потоотделение (сильное потоотделение), диарея, рвота, интоксикация или голодание. Спортсмены, тренирующиеся в экстремальных условиях (в течение трех или более часов непрерывно, например, марафон или же триатлон ), которые не потребляют электролиты, рискуют обезвоживаться (или гипонатриемия ).[12]
Домашний электролитный напиток можно приготовить из воды, сахара и соли. в точных пропорциях.[13] Важно включать глюкозу (сахар), чтобы задействовать механизм совместного транспорта натрия и глюкозы. Также доступны коммерческие препараты.[14] как для человека, так и для ветеринарии.
Электролиты обычно встречаются в фруктовые соки, спортивные напитки, молоко, орехи и многие фрукты и овощи (цельные или в виде сока) (например, картофель, авокадо).
Электрохимия
Когда электроды помещаются в электролит и Напряжение нанесен, электролит будет проводить электричество. Одинокий электроны обычно не может проходить через электролит; вместо этого происходит химическая реакция на катод, обеспечивая электронами электролит. Другая реакция происходит на анод, поглощая электроны из электролита. В результате в электролите вокруг катода образуется облако отрицательного заряда, а вокруг анода - положительный заряд. Ионы в электролите нейтрализуют эти заряды, позволяя электронам продолжать течь и реакции продолжаться.
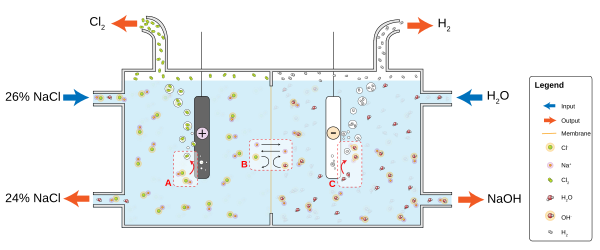
Например, в растворе обычной поваренной соли (хлорида натрия, NaCl) в воде катодная реакция будет
- 2H2O + 2e− → 2OH− + H2
и водород газ будет пузыриться; анодная реакция
- 2NaCl → 2 Na+ + Cl2 + 2e−
и хлор Газ выделяется в раствор, где он вступает в реакцию с ионами натрия и гидроксила с образованием гипохлорида натрия - бытового отбеливателя. Положительно заряженные ионы натрия Na+ будет реагировать на катод, нейтрализуя отрицательный заряд OH− там, а отрицательно заряженные гидроксид-ионы OH− будет реагировать на анод, нейтрализуя положительный заряд Na+ там. Без ионов из электролита заряды вокруг электрода замедлили бы непрерывный поток электронов; распространение из H+ и ОН− через воду к другому электроду требуется больше времени, чем перемещение гораздо более распространенных ионов соли. Электролиты диссоциируют в воде, потому что молекулы воды являются диполями, а диполи ориентируются энергетически выгодным образом для сольватации ионов.
В других системах в электродных реакциях могут участвовать металлы электродов, а также ионы электролита.
Электролитические проводники используются в электронных устройствах, где химическая реакция на границе раздела металл-электролит дает полезные эффекты.
- В батареи в качестве электродов используются два материала с разным сродством к электрону; электроны текут от одного электрода к другому вне батареи, в то время как внутри батареи цепь замыкается ионами электролита. Здесь электродные реакции преобразуют химическую энергию в электрическую.[15]
- В некоторых топливные элементы, твердый электролит или протонный проводник соединяет пластины электрически, разделяя топливные газы водород и кислород.[16]
- В гальваника В резервуарах электролит одновременно наносит металл на покрываемый объект и электрически подключает этот объект в цепи.
- В приборах наработки две тонкие колонки Меркурий разделены небольшим зазором, заполненным электролитом, и по мере прохождения заряда через устройство металл с одной стороны растворяется, а с другой - выпадает, заставляя видимый зазор медленно перемещаться.
- В электролитические конденсаторы химический эффект используется для получения очень тонкого диэлектрик или же изоляционный покрытие, в то время как слой электролита ведет себя как одна пластина конденсатора.
- В некоторых гигрометры влажность воздуха определяется путем измерения проводимости почти сухого электролита.
- Горячее размягченное стекло является проводником электролита, и некоторые производители стекла поддерживают его в расплавленном состоянии, пропуская через него большой ток.
Твердые электролиты
Твердые электролиты в основном можно разделить на четыре группы:
- Гелевые электролиты - очень похожи на жидкие электролиты. По сути, это жидкости в гибком решетчатый каркас. Разные добавки часто применяются для увеличения проводимость таких систем.[15][17]
- Сухие полимерные электролиты - отличаются от жидких и гелевых электролитов тем, что соль растворяется непосредственно в твердой среде. Обычно это относительно высокий диэлектрик постоянный полимер (PEO, ПММА, СКОВОРОДА, полифосфазены, силоксаны и др.) и соль с низким энергия решетки. Чтобы увеличить механическая сила и проводимость таких электролитов, очень часто композиты используются, и вводится инертная керамическая фаза. Есть два основных класса таких электролитов: полимер в керамике и керамика в полимере.[18][19][20]
- Твердые керамические электролиты - ионы мигрируют через керамическую фазу посредством вакансий или межстраничные объявления в пределах решетка. Также существуют стеклокерамические электролиты.
- Органические ионно-пластиковые кристаллы - это разновидность органические соли экспонирование мезофазы (т.е. состояние дела промежуточное звено между жидкостью и твердым телом), в котором подвижные ионы ориентационно или вращательно разупорядочены, а их центры расположены в упорядоченных узлах кристаллической структуры.[16] У них есть различные формы беспорядка из-за одного или нескольких твердых тел. фазовые переходы ниже температура плавления и поэтому пластик свойства и хорошая механическая гибкость, а также улучшенный межфазный контакт электрод-электролит. Особенно, протонные органические ионные пластиковые кристаллы (POIPC),[16] которые твердые протический органические соли, образованные протон перевод из Кислота Бренстеда к основанию Бренстеда и, по сути, являются протонными ионными жидкостями в расплавленном состоянии, оказались многообещающими твердотельными протонные проводники за топливные элементы. Примеры включают 1,2,4-триазолий перфторбутансульфонат[16] и имидазолий метансульфонат.[21]
Смотрите также
- Сильный электролит
- ИТИ (граница раздела двух несмешивающихся растворов электролита)
- Ионный транспортный номер
- Электролитдатенбанк Регенсбург
- ВТПР
Рекомендации
- ^ "Нобелевская премия по химии 1903 г.". Получено 5 января 2017.
- ^ а б Харрис, Уильям; Леви, Джудит, ред. (1975). Энциклопедия Новой Колумбии (4-е изд.). Нью-Йорк: Колумбийский университет. п.155. ISBN 978-0-231035-729.
- ^ а б МакГенри, Чарльз, изд. (1992). Новая Британская энциклопедия. 1 (15 изд.). Чикаго: Британская энциклопедия, Inc., стр. 587. Bibcode:1991неб..книга ..... Г. ISBN 978-085-229553-3.
- ^ а б Cillispie, Charles, ed. (1970). Словарь научной биографии (1-е изд.). Нью-Йорк: Сыновья Чарльза Скрибнера. С. 296–302. ISBN 978-0-684101-125.
- ^ Ши, Джиахуа (石家华); Сунь, Сюнь (孙 逊); Чуньхэ (杨春 和), Ян; Гао, Цинюй (高 青 雨); Ли, Юнфан (李永 舫) (2002). «Архивная копия» 离子 液体 研究 进展 (PDF). 化学 通报 (на китайском языке) (4): 243. ISSN 0441-3776. Архивировано из оригинал (PDF) 2 марта 2017 г.. Получено 1 марта 2017.CS1 maint: заархивированная копия как заголовок (связь)
- ^ Цзяншуй Луо; Цзинь Ху; Вольфганг Саак; Рюдигер Бекхаус; Гюнтер Виттсток; Иво Ф. Дж. Ванкелеком; Карстен Агерт; Олаф Конрад (2011). «Протонная ионная жидкость и ионные расплавы, полученные из метансульфоновой кислоты и 1H-1,2,4-триазола в качестве высокотемпературных электролитов PEMFC». Журнал химии материалов. 21 (28): 10426–10436. Дои:10.1039 / C0JM04306K. S2CID 94400312.
- ^ Браун, Химия: Центральная наука, 14-е издание, стр. 680.
- ^ Alfarouk, Khalid O .; Ahmed, Samrein B.M .; Ахмед, Ахмед; Эллиотт, Роберт Л .; Ибрагим, Мунтасер Э .; Али, Heyam S .; Уэльс, Кристиан К .; Нурвали, Ибрагим; Aljarbou, Ahmed N .; Башир, Адиль Х. Х .; Alhoufie, Sari T. S .; Алькахтани, Саад Саид; Cardone, Rosa A .; Фаис, Стефано; Харгинди, Сальвадор; Решкин, Стефан Дж. (7 апреля 2020 г.). "Взаимодействие дисрегуляции pH и электролитного дисбаланса при раке". Рак. 12 (4): 898. Дои:10.3390 / раки12040898. ЧВК 7226178. PMID 32272658.
- ^ Йе, Шэнлун (叶胜龙); Тан, Чжаоюй (汤钊猷) (1986). 细胞膜 钠泵 及其 临床 意义. 上海 医学 [Шанхайская медицина] (на китайском языке) (1): 1.
- ^ Ту, Чжицюань (涂 志 全) (2004).张定昌. 电解质 紊乱 对 晚期 肿瘤 的 治疗 影响. 中华 中 西医 杂志 [Китайский журнал китайской и западной медицины] (на китайском языке) (10).
正常人 体内 , 钠 离子 占 细胞 阳离子 总量 的 92% 钾 离子 阳离子 的 的 子 的钠 、 钾 是 人 体内 最主要 的 电解质 成分 ...
- ^ Alfarouk, Khalid O .; Ahmed, Samrein B.M .; Ахмед, Ахмед; Эллиотт, Роберт Л .; Ибрагим, Мунтасер Э .; Али, Heyam S .; Уэльс, Кристиан К .; Нурвали, Ибрагим; Aljarbou, Ahmed N .; Башир, Адиль Х. Х .; Alhoufie, Sari T. S .; Алькахтани, Саад Саид; Cardone, Rosa A .; Фаис, Стефано; Харгинди, Сальвадор; Решкин, Стефан Дж. (7 апреля 2020 г.). "Взаимодействие дисрегуляции pH и электролитного дисбаланса при раке". Рак. 12 (4): 898. Дои:10.3390 / раки12040898. ЧВК 7226178. PMID 32272658.
- ^ J, Эстевес Э; Бакеро Э; Мора-Родригес Р. (2008). «Анаэробные показатели при регидратации водой или имеющимися в продаже спортивными напитками во время длительных тренировок в жару». Прикладная физиология, питание и обмен веществ. 33 (2): 290–298. Дои:10.1139 / H07-188. PMID 18347684.
- ^ «Регидратирующие напитки». Webmd.com. 28 апреля 2008 г. Архивировано с оригинал 23 октября 2008 г.. Получено 25 декабря 2018.
- ^ "Поставщики соли для пероральной регидратации". Rehydrate.org. 7 октября 2014 г.. Получено 4 декабря 2014.
- ^ а б Камил Пержина; Регина Борковская; Ярослав Сыздек; Алдона Залевская; Владислав Вечорек (2011). «Влияние добавки типа кислоты Льюиса на характеристики литий-гелевого электролита». Electrochimica Acta. 57: 58–65. Дои:10.1016 / j.electacta.2011.06.014.
- ^ а б c d Цзяншуй Луо; Аннеметта Х. Йенсен; Нил Р. Брукс; Йерун Сникерс; Мартин Книппер; Дэвид Айли; Цинфэн Ли; Брэм Ванрой; Михаэль Вуббенхорст; Фэн Янь; Люк Ван Меервельт; Чжиган Шао; Цзяньхуа Фанг; Чжэн-Хун Ло; Дирк Э. Де Вос; Коэн Биннеманс; Ян Франсаер (2015). «Перфторбутансульфонат 1,2,4-триазолия в качестве типичного чистого протонного органического ионного пластичного кристаллического электролита для твердотельных топливных элементов». Энергетика и экология. 8 (4): 1276–1291. Дои:10.1039 / C4EE02280G. S2CID 84176511.
- ^ «Революция рулонных батарей». Ev World. Архивировано из оригинал 10 июля 2011 г.. Получено 20 августа 2010.
- ^ Сыздек Дж., Борковска Р., Пержина К., Тараскон Дж. М., Вичорек В. (2007). «Новые композиционные полимерные электролиты с поверхностно-модифицированными неорганическими наполнителями». Журнал источников энергии. 173 (2): 712–720. Bibcode:2007JPS ... 173..712S. Дои:10.1016 / j.jpowsour.2007.05.061. ISSN 0378-7753.
- ^ Сыздек Дж., Арманд М., Марцинек М., Залевска А., Луковска Г., Вецзорек В. (2010). «Детальные исследования модификации наполнителей и их влияния на композитные полимерные электролиты на основе поли (оксиэтилена)». Electrochimica Acta. 55 (4): 1314–1322. Дои:10.1016 / j.electacta.2009.04.025. ISSN 0013-4686.
- ^ Сыздек Дж., Арман М., Гизовска М., Марцинек М., Сасим Э., Шафран М., Вичорек В. (2009). «Керамика в полимере против полимерных электролитов в керамике - новый подход». Журнал источников энергии. 194 (1): 66–72. Bibcode:2009JPS ... 194 ... 66S. Дои:10.1016 / j.jpowsour.2009.01.070. ISSN 0378-7753.
- ^ Цзяншуй Луо; Олаф Конрад; Иво Ф. Дж. Ванкелеком (2013). «Метансульфонат имидазолия как высокотемпературный протонный проводник». Журнал химии материалов A. 1 (6): 2238–2247. Дои:10.1039 / C2TA00713D. S2CID 96622511.