Декалин - Decalin
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Декагидронафталин[1] | |
| Другие имена Бицикло [4.4.0] декан[1] Декалин | |
| Идентификаторы | |
3D модель (JSmol ) | |
| 878165 | |
| ЧЭБИ |
|
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.001.861 |
| Номер ЕС |
|
| 185147 | |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 1147 |
| |
| |
| Характеристики | |
| C10ЧАС18 | |
| Молярная масса | 138,25 г / моль |
| Внешность | бесцветная жидкость |
| Плотность | 0,896 г / см3 |
| Температура плавления | транс: -30,4 ° C (-22,7 ° F, 242,7 К) цис: -42,9 ° С (-45,2 ° F, 230,3 К)[2] |
| Точка кипения | транс: 187 ° C (369 ° F) цис: 196 ° C (384 ° F) |
| Нерастворимый | |
| |
| 1.481 | |
| Опасности | |
| Паспорт безопасности | Декалин MSDS |
| Пиктограммы GHS |       |
| Сигнальное слово GHS | Опасность |
| H226, H304, H314, H318, H331, H332, H400, H410, H411 | |
| P210, P233, P240, P241, P242, P243, P260, P261, P264, P271, P273, P280, P301 + 310, P301 + 330 + 331, P303 + 361 + 353, P304 + 312, P304 + 340, P305 + 351 + 338, P310, P311, P312, P321, P331, P363, P370 + 378 | |
| точка возгорания | 57 ° С (135 ° F, 330 К) |
| 250 ° С (482 ° F, 523 К) | |
| Родственные соединения | |
Родственные соединения | Нафталин; Тетралин |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Декалин (декагидронафталин, также известный как бицикло [4.4.0] декан и иногда декалин),[3] а бициклический органическое соединение, является промышленным растворитель. Бесцветная жидкость с ароматным запахом, используется как растворитель для многих смолы или топливные присадки.[4] Это насыщенный аналог нафталин и может быть приготовлен из него гидрирование в присутствии катализатор. Декагидронафталин легко образует взрывной[5] органические пероксиды при хранении на воздухе.[6][7]
Изомеры
Декагидронафталин встречается в СНГ и транс формы. В транс форма энергетически более устойчива из-за меньшего количества стерические взаимодействия. СНГ-Декалин - хиральная молекула без хирального центра; он имеет двойную ось симметрии вращения, но не имеет отражательной симметрии. Тем не менее хиральность отменяется посредством процесса переворачивания стула, который превращает молекулу в ее зеркальное отображение.
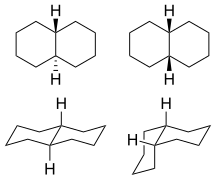
1: транс (слева) и СНГ (справа) изомеры  2:
2:клюшка из СНГ-декалин  3:
3:транс-декалин  4:
4:СНГ-декалин кольцо-флип 
5: Половина молекулы декалина: циклогексан в стул конформация. Осевые положения показаны красным, а экваториальные - синим. 
6: Андростандиол, биомолекула с тремя транс конденсированные шестичленные кольца (а также транс слился пятичленный)
транс-Декалин
Единственно возможный способ соединения двух шестичленных колец в транс Положение означает, что второе кольцо должно начинаться с двух экваториальных связей (синего цвета) первого кольца. Шестичленное кольцо не предлагает достаточно места для начала в осевом положении (вверх) и достижения аксиального положения соседнего атома углерода, который затем окажется на нижней стороне молекулы (см. Модель циклогексан на рисунке 5). Структура конформационно заморожена, а не имеет способности претерпевать переворачивание стула, как в СНГ изомер. В биология эта фиксация широко используется в стероидный препарат скелет построить молекулы (например, фиг. 6), которые играют ключевую роль в передаче сигналов между удаленными друг от друга клетками.
Реакции
Окисление декалина дает третичное гидропероксид, который перестраивается в циклодеценон, предшественник себациновая кислота.[8]
Смотрите также
Рекомендации
- ^ а б Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. С. 33, 394, 601. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Хейнс, Уильям М. (2010). Справочник по химии и физике (91 изд.). Бока-Ратон, Флорида, США: CRC Press. п. 3-134. ISBN 978-1-43982077-3.
- ^ "Dictionary.com".
- ^ «Топливная присадка». Архивировано из оригинал на 2009-03-12.
- ^ "PDF - Суррогатное исследование авиационного топлива JP-8 - Диссертация Алессандро Агосты, Университет Дрекселя" (PDF). Архивировано из оригинал (PDF) 19 июня 2010 г.
- ^ «Данные Inchem.org».
- ^ «Паспорт безопасности материалов - JT Baker».
- ^ Грисбаум, Карл; Бер, Арно; Биденкапп, Дитер; Фогес, Хайнц-Вернер; Гарбе, Доротея; Паец, Кристиан; Коллин, Герд; Майер, Дитер; Хёке (2000). «Углеводороды». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a13_227.






