Мезитилен - Mesitylene
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC 1,3,5-триметилбензол[1] | |||
| Другие имена Мезитилен[1] сим-Триметилбензол | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.278 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
PubChem CID | |||
| UNII | |||
| Номер ООН | 2325 | ||
| |||
| |||
| Характеристики | |||
| C9ЧАС12 | |||
| Молярная масса | 120,19 г / моль | ||
| Внешность | Прозрачная бесцветная жидкость[2] | ||
| Запах | Самобытный, ароматный[2] | ||
| Плотность | 0,8637 г / см3 при 20 ° C | ||
| Температура плавления | -44,8 ° С (-48,6 ° F, 228,3 К) | ||
| Точка кипения | 164,7 ° С (328,5 ° F, 437,8 К) | ||
| 0,002% (20 ° С)[2] | |||
| Давление газа | 2 мм рт. Ст. (20 ° C)[2] | ||
| -92.32·10−6 см3/ моль | |||
| Структура | |||
| 0.047 D [3] | |||
| Опасности | |||
| Паспорт безопасности | Данные по безопасности от Sigma Aldrich | ||
| точка возгорания | 50 ° С; 122 ° F; 323 К[2] | ||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | никто[2] | ||
REL (Рекомендуемые) | TWA 25 частей на миллион (125 мг / м3)[2] | ||
IDLH (Непосредственная опасность) | N.D.[2] | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Мезитилен или же 1,3,5-триметилбензол является производным от бензол с тремя метил заместители расположены симметрично вокруг кольца. Два других изомерных триметилбензолы находятся 1,2,4-триметилбензол (псевдокумол) и 1,2,3-триметилбензол (гемимеллитен). Все три соединения имеют формула C6ЧАС3(CH3)3, который обычно обозначается как C6ЧАС3Мне3. Мезитилен - бесцветная жидкость со сладким ароматным запахом. Это компонент каменноугольная смола, который является его традиционным источником. Это предшественник разнообразных тонкие химикаты. В мезитил группа (Mes) представляет собой заместитель с формулой C6ЧАС2Мне3 и содержится в различных других соединениях.[4]
Подготовка
Мезитилен получают путем уравновешивания ксилол (или простой метил алкилирование из этого) над твердым кислотный катализатор:[4]
- 2 C6ЧАС4(CH3)2 ⇌ C6ЧАС3(CH3)3 + C6ЧАС5CH3
- C6ЧАС4(CH3)2 + CH3ОН → С6ЧАС3(CH3)3 + H2О
Тримеризация из ацетон через альдольная конденсация, который катализируется и обезвоженный к серная кислота дает смесь 1,3,5- и 1,2,4-триметилбензолов.[5]
Реакции
Окисление мезитилена азотная кислота дает тримезиновая кислота, С6ЧАС3(COOH)3. С помощью диоксид марганца, более мягкий окислитель, 3,5-диметилбензальдегид сформирован. Мезитилен окисляется трифторопераксусная кислота производить мезитол (2,4,6-триметилфенол).[6]
Приложения
Мезитилен в основном используется как предшественник 2,4,6-триметиланилин, предшественник красителей. Это производное получают путем селективного мононитрирования мезитилена, избегая окисления метильных групп.[7]
Добавка и компонент некоторых avgas (авиационный бензин) смеси.
Ниша использует
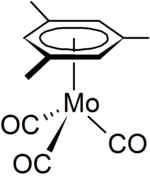
Мезитилен используется в лаборатории как специальный растворитель. Он также может действовать как лиганд в металлоорганическая химия, одним из примеров является органо-молибден сложный [(η6 -C6ЧАС3Мне3) Мо (CO)3].[8] который можно приготовить из гексакарбонил молибдена.
В электронной промышленности мезитилен используется в качестве разработчик для фотошаблонов силиконы благодаря своим свойствам растворителя.
Три ароматный атомы водорода мезитилена находятся в идентичных средах химического сдвига. Следовательно, они дают только один пик около 6,8 ppm в 1H ЯМР спектр; то же самое верно и для девяти метил протонов, которые дают синглет около 2.3 м.д. По этой причине мезитилен иногда используют в качестве внутренний стандарт в образцах ЯМР, содержащих ароматические протоны.[9]
Увитовая кислота получается окислением мезитилена или конденсацией пировиноградная кислота с баритовая вода.[10]
В Реакция Гаттермана можно упростить, заменив HCN / AlCl3 сочетание с цианид цинка (Zn (CN)2).[11] Хотя он очень токсичен, Zn (CN)2 представляет собой твердое вещество, поэтому с ним безопаснее работать, чем с газообразным цианистым водородом (HCN).[12] Zn (CN)2 реагирует с HCl с образованием основного реагента HCN и Zn (CN)2 который служит катализатором кислоты Льюиса на месте. Пример Zn (CN)2 метод - синтез мезитальдегид из мезитилена.[13]
История
Мезитилен был впервые получен в 1837 г. Роберт Кейн, ирландский химик, нагревая ацетон с концентрированной серной кислотой.[14] Он назвал свое новое вещество «мезитилен», потому что немецкий химик Карл Райхенбах назвал ацетон «месит» (от греческого μεσίτης, посредник),[15] и Кейн считал, что его реакция обезвожила мезит, превратив его в алкен, «мезитилен».[16] Однако определение Кейном химического состава («эмпирической формулы») мезитилена было неверным. Правильная эмпирическая формула была предоставлена Август В. фон Хофманн в 1849 г.[17] В 1866 г. Адольф фон Байер показали, что структура мезитилена соответствует структуре 1,3,5-триметилбензола;[18] однако убедительное доказательство того, что мезитилен идентичен 1,3,5-триметилбензолу, было предоставлено Альберт Ладенбург в 1874 г.[19]
Мезитиловая группа
Группа (CH3)3C6ЧАС2- называется мезитил (символ органической группы: Mes). Производные мезитила, например тетрамезитилдиирон, обычно готовятся из Реактив Гриньяра (CH3)3C6ЧАС2MgBr. Из-за большой стерической потребности мезитильная группа используется в качестве большой блокирующей группы в асимметричном катализе (для повышения диастерео- или энантиоселективности) и в металлоорганической химии (для стабилизации металлических центров с низким уровнем окисления или с низким координационным числом). Например, более крупные аналоги с еще большей стерической потребностью. 2,6-диизопропилфенил (Дипп) и одноименный Трипп ((яPr)3C6ЧАС2, Is) и супермеситил ((тБу)3C6ЧАС2, Mes *), могут быть даже более эффективными в достижении этих целей.
Безопасность и окружающая среда
Мезитилен также является крупным городским летучие органические соединения (VOC) в результате горение. Он играет значительную роль в аэрозолях и тропосферный озон образование, а также другие реакции в химия атмосферы.
Рекомендации
- ^ а б Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 139. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ а б c d е ж грамм час Карманный справочник NIOSH по химической опасности. "#0639". Национальный институт охраны труда и здоровья (NIOSH).
- ^ Чжао, Цзюнь; Чжан, Реньи (2004). «Константы скорости реакции переноса протона между ионом гидроксония (H3О+) и летучие органические соединения ». Атмосферная среда. 38 (14): 2177–2185. Дои:10.1016 / j.atmosenv.2004.01.019.
- ^ а б Карл Грисбаум, Арно Бер, Дитер Биденкапп, Хайнц-Вернер Фогес, Доротея Гарбе, Кристиан Паец, Герд Коллин, Дитер Майер, Хартмут Хёке «Углеводороды» в Энциклопедии промышленной химии Ульманна 2002 Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a13_227.
- ^ Камминг, У. М. (1937). Систематическая органическая химия (3E). Нью-Йорк, США: Компания Д. Ван Ностранд. п. 57.
- ^ Чемберс, Ричард Д. (2004). «Функциональные соединения, содержащие кислород, серу или азот, и их производные». Фтор в органической химии. CRC Press. С. 242–243. ISBN 9780849317903.
- ^ Джеральд Бут (2007). «Нитросоединения ароматические». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a17_411.
- ^ Girolami, G.S .; Раухфус, Т. Б. и Анджеличи, Р. Дж., Синтез и техника в неорганической химии, Университетские научные книги: Милл-Вэлли, Калифорния, 1999. ISBN 0-93570248-2.
- ^ http://chemicalland21.com/industrialchem/organic/MESITYLENE.htm
- ^ «Определение увитиновой кислоты». merriam-webster.com. Получено 31 октября 2016.
- ^ Адамс Р.; Левин, И. (1923). «Упрощение синтеза гидроксиальдегидов по Гаттерману». Варенье. Chem. Soc. 45 (10): 2373–77. Дои:10.1021 / ja01663a020.
- ^ Адамс, Роджер (1957). Органические реакции, Том 9. Нью-Йорк: John Wiley & Sons, Inc., стр. 38 и 53–54. Дои:10.1002 / 0471264180.or009.02. ISBN 9780471007265.
- ^ Fuson, R.C .; Хорнинг, Э. С .; Rowland, S.P .; Уорд, М. Л. (1955). «Мезитальдегид». Органический синтез. Дои:10.15227 / orgsyn.023.0057.; Коллективный объем, 3, п. 549
- ^ Роберт Кейн (1839) "О ряде комбинаций производных пироуксусного спирта. [ацетон]" Труды Ирландской королевской академии, т. 18, страницы 99–125.
- ^ Цитата из исследования Райхенбаха: К. Райхенбах (1834 г.) "Ueber Mesit (Essiggeist) und Holzgeist" (О месите (уксусный спирт) и древесных спиртах), Annalen der Pharmacie, т. 10, вып. 3, страницы 298–314.
- ^ Для объяснения оригинала названия «мезитилен» см. Также: Henry E. Roscoe, Трактат по химии (Нью-Йорк, Нью-Йорк: Д. Эпплтон и Ко, 1889), т. III, стр.102, сноска 2.
- ^ A.W. Хофманн (1849 г.) «О составе мезитилола [мезитилена] и некоторых его производных», Ежеквартальный журнал Лондонского химического общества, т. 2, страницы 104–115. (Примечание: эмпирическая формула мезитилена, изложенная в статье Хофмана (C18ЧАС12 ) это неверно; однако это произошло из-за того, что Хофманн использовал 6 в качестве атомного веса углерода вместо правильного атомного веса 12. Как только правильный атомный вес используется в расчетах Хофмана, его результаты дают правильную эмпирическую формулу C9ЧАС12.)
- ^ Адольф фон Байер (1866) "Ueber die Condensationsproducte des Acetons" (О продуктах конденсации ацетона), Annalen der Chemie und Pharmacie, т. 140, страницы 297–306.
- ^ Альберт Ладенбург (1874 г.) "Ueber das Mesitylen" (О мезитилене), Berichte der deutschen chemischen Gesellschaft, т. 7, страницы 1133–1137. Дои: 10.1002 / cber.18740070261


