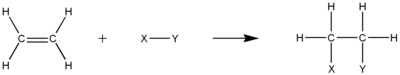Алкен - Alkene - Wikipedia

В химия, алкен это углеводород который содержит углерод –Углерод двойная связь.[1]
Этот термин часто используется как синоним олефин, то есть любой углеводород содержащие одну или несколько двойных связей.[2] Тем не менее ИЮПАК рекомендует использовать название «алкен» только для ациклических углеводородов с одной двойной связью; алкадиен, алкатриени т. д., или полиен для ациклических углеводородов с двумя или более двойными связями; циклоалкен, циклоалкадиени т.д. для циклических; и «олефин» для общего класса - циклический или ациклический, с одной или несколькими двойными связями.[3][4][5]
Ациклические алкены только с одной двойной связью и без другой функциональные группы (также известный как моноены) образуют гомологическая серия из углеводороды с общей формулой CпЧАС2п с п 2 или более (то есть два водород меньше соответствующего алкан ). Когда п четыре или больше, есть несколько изомеры с этой формулой, отличающейся положением и конформация двойной связи.
Алкены обычно бесцветны неполярный соединения, отчасти похожие на алканы, но более реактивные. Первые несколько членов этого ряда - это газы или жидкости при комнатной температуре. Простейший алкен, этилен (C2ЧАС4) (или "этен" в Номенклатура ИЮПАК ) это органическое соединение производятся в промышленных масштабах.[6]
Ароматный соединения часто изображаются как циклические алкены, но их структура и свойства достаточно различны, чтобы не классифицировать их как алкены или олефины.[4] Углеводороды с двумя перекрывающимися двойными связями (C = C = C) называются аллены - простейшее такое соединение само называется аллен - а те, у которых есть три или более перекрывающихся связей (C = C = C = C, C = C = C = C = C и т. Д.), Называются кумулены. Некоторые авторы[ВОЗ? ] не считайте аллены и кумулены «алкенами».
Структурная изомерия
Алкены, имеющие четыре или более углерод атомы могут образовывать разнообразные структурные изомеры. Большинство алкенов также являются изомерами циклоалканы. Структурные изомеры ациклических алкенов только с одной двойной связью:[7][ненадежный источник? ]
- C2: этилен Только
- C3: пропилен Только
- C4: 3 изомера: 1-бутен, 2-бутен, и изобутилен
- C5: 5 изомеры: 1-пентен, 2-пентен, 2-метил-1-бутен, 3-метил-1-бутен, 2-метил-2-бутен
- C6: 13 изомеры: 1-гексен, 2-гексен, 3-гексен, метилпентен (7 изомеров), диметилбутен (3 изомера)
- C7: 27 изомеров (рассчитано)
- C12: 2281 изомеров (то же самое)
- C31: 193 706 542 776 изомеров (то же самое)
Многие из этих молекул проявляют цис-транс-изомерия. Также может быть хиральный углерода, особенно внутри более крупных молекул (из C5). Число потенциальных изомеров быстро увеличивается с добавлением дополнительных атомов углерода.
Структура
Склеивание

Как сингл Ковалентная связь, двойные связи можно описать в терминах перекрытия атомный орбитали, за исключением того, что в отличие от одинарной связи (которая состоит из одинарной сигма-облигация ) двойная связь углерод – углерод состоит из одного сигма-облигация и один пи бонд. Эта двойная связь сильнее одинарной. Ковалентная связь (611 кДж /моль для C = C против 347 кДж / моль для C – C)[1] а также короче, со средним длина облигации из 1,33 Ангстремс (133 вечера ).
Каждый углерод двойной связи использует свои три sp.2 гибридные орбитали чтобы образовать сигма-связи с тремя атомами (другим углеродом и двумя атомами водорода). Негибридизированные атомные орбитали 2p, которые лежат перпендикулярно плоскости, созданной осями трех гибридных орбиталей sp², объединяются, образуя связь пи. Эта связь лежит вне главной оси C – C, причем половина связи находится на одной стороне молекулы, а половина - на другой. При силе 65 ккал / моль пи-связь значительно слабее сигма-связи.
Вращение вокруг двойной связи углерод-углерод ограничено, потому что это требует энергетических затрат, чтобы нарушить выравнивание p орбитали на двух атомах углерода. Как следствие, замещенные алкены могут существовать как один из двух изомеры, называется СНГ или же транс изомеры. Более сложные алкены можно назвать E–Z обозначение для молекул с тремя или четырьмя различными заместители (боковые группы). Например, из изомеры бутена, две метильные группы (Z) -но-2-ene (a.k.a. СНГ-2-бутен) появляются на одной стороне двойной связи, а в (E) -бут-2-ен (также известный как транс-2-бутен) метильные группы появляются с противоположных сторон. Эти два изомера бутена обладают разными свойствами.
Скручивание на двугранный угол 90 ° между двумя группами на атомах углерода требует меньше энергии, чем сила пи бонд, и облигация остается в силе. Атомы углерода двойной связи становятся пирамидальный, что позволяет сохранить некоторые p орбитальный выравнивание - и, следовательно, связь пи. Две другие присоединенные группы остаются под большим двугранным углом. Это противоречит распространенному в учебниках утверждению, что два атома углерода сохраняют свою планарную природу при скручивании, и в этом случае p-орбитали повернутся достаточно далеко друг от друга, чтобы не поддерживать пи-связь. В алкене, закрученном на 90 °, p-орбитали смещены только на 42 °, а энергия деформации составляет всего около 40 ккал / моль. Напротив, полностью разорванная пи-связь имеет энергетические затраты около 65 ккал / моль.[8]
Немного пирамидальные алкены стабильны. Например, транс-циклооктен представляет собой стабильный напряженный алкен, а смещение орбиты составляет всего 19 °, несмотря на то, что двугранный угол 137 ° (плоская система имеет двугранный угол 180 °) и степень пирамидализации 18 °. Четное транс-циклогептен устойчив при низких температурах.[8]
Форма
Как и было предсказано VSEPR модель электрон парное отталкивание, молекулярная геометрия алкенов включает валентные углы около каждого углерода в двойной связи около 120 °. Угол может меняться из-за стерическое напряжение представлен несвязанные взаимодействия между функциональные группы присоединены к атомам углерода двойной связи. Например, валентный угол C – C – C в пропилен составляет 123,9 °.
Для мостиковых алкенов Правило Бредта утверждает, что двойная связь не может возникать на мостике мостиковой кольцевой системы, если кольца не достаточно большие.[9] Следуя Фосетту и определяя S как общее количество немостовых атомов в кольцах,[10] бициклические системы требуют S ≥ 7 для стабильности[9] и трициклические системы требуют S ≥ 11.[11]
Физические свойства
Многие физические свойства алкенов и алканы похожи: они бесцветны, неполярны, горючие. В физическое состояние зависит от молекулярная масса: как и соответствующие насыщенные углеводороды, простейшие алкены (этилен, пропилен, и бутен ) являются газами при комнатной температуре. Линейные алкены, содержащие приблизительно от пяти до шестнадцати атомов углерода, являются жидкостями, а высшие алкены - воскообразными твердыми веществами. Температура плавления твердых веществ также увеличивается с увеличением молекулярной массы.
Алкены обычно имеют более сильный запах, чем соответствующие алканы. У этилена сладкий и затхлый запах. Связывание иона меди с олефином в обонятельном рецепторе млекопитающих MOR244-3 связано с запахом алкенов (а также тиолов). Напряженные алкены, в частности норборнен и транс-циклооктен Известно, что они имеют сильный неприятный запах, что согласуется с более сильными π-комплексами, которые они образуют с ионами металлов, включая медь.[12]
Реакции
Алкены - относительно стабильные соединения, но они более реакционноспособны, чем алканы, либо из-за реакционной способности пи-связи углерод-углерод, либо из-за наличия аллильный CH центров. Большинство реакций алкенов включает присоединения к этой пи-связи, образуя новые одинарные облигации. Алкены служат сырьем для нефтехимическая промышленность потому что они могут участвовать в большом количестве реакций, особенно в полимеризации и алкилировании.
Реакции сложения
Алкены реагируют на многие реакции присоединения, которые возникают при раскрытии двойной связи. Большинство этих реакций присоединения следуют механизму электрофильная добавка. Примеры гидрогалогенирование, галогенирование, образование галогидрина, оксимеркурация, гидроборирование, добавление дихлоркарбена, Реакция Симмонса – Смита, каталитическое гидрирование, эпоксидирование, радикальная полимеризация и гидроксилирование.
Гидрирование алкенов производит соответствующие алканы. Иногда реакцию проводят под давлением и при повышенной температуре. Металлический катализатор почти всегда требуются. Общепромышленные катализаторы основаны на платина, никель, и палладий. Широкомасштабное применение - производство маржерина.
Помимо добавления H-H по двойной связи, могут быть добавлены многие другие H-X. Эти процессы часто имеют большое коммерческое значение. Одним из примеров является добавление H-SiR3, т.е. гидросилилирование. Эта реакция используется для генерации кремнийорганические соединения. Другая реакция гидроцианирование, добавление H-CN по двойной связи.
Гидратация
Гидратация, добавление воды через двойную связь алкенов дает спирты. Реакция катализируется фосфорная кислота или же серная кислота. Эта реакция проводится в промышленных масштабах для получения синтетического этиловый спирт.
- CH2= CH2 + H2O → CH3–CH2ОЙ
Алкены можно также превратить в спирты через реакция оксимеркурации-демеркурации , то реакция гидроборирования – окисления или по Мукайяма увлажнение.
Галогенирование
В электрофильное галогенирование добавление элементалей бром или же хлор в алкены дает вицинальный дибром- и дихлоралканы (1,2-дигалогениды или этилендигалогениды) соответственно. Обесцвечивание раствора брома в воде - это аналитический тест на наличие алкенов:
- CH2= CH2 + Br2 → BrCH2–CH2Br
Родственные реакции также используются в качестве количественных показателей ненасыщенности, выражаемой как бромное число и йодное число соединения или смеси.
Гидрогалогенирование
Гидрогалогенирование добавление галогениды водорода, Такие как HCl или же ЗДРАВСТВУЙ, в алкены с получением соответствующего галогеналканы:
Если два атома углерода в двойной связи связаны с разным числом атомов водорода, галоген предпочтительно находится у углерода с меньшим количеством водородных заместителей. Этот паттерн известен как Правило марковникова. Использование радикальные инициаторы или другие соединения могут привести к противоположному результату продукта. Бромистоводородная кислота в частности, склонен к образованию радикалов в присутствии различных примесей или даже кислорода воздуха, что приводит к обратному результату Марковникова:[13]
Образование галогидрина
Алкены реагируют с водой и галогенами с образованием галогидрины реакцией присоединения. Марковниковская региохимия и возникают антистереохимия.
- CH2= CH2 + X2 + H2O → XCH2–CH2OH + HX
Окисление
Алкены реагируют с перкарбоновые кислоты и даже перекись водорода для получения эпоксиды:
- RCH = CH2 + RO2H → RCHOCH2 + RO2ЧАС
Для этилена эпоксидирование проводится в очень крупных промышленных масштабах. Этот коммерческий маршрут использует кислород в присутствии катализаторов:
- C2ЧАС4 + 1/2 O2 → С2ЧАС4О
Алкены реагируют с озоном, приводя к разрыву двойной связи. Процесс называется озонолиз. Часто процедура реакции включает мягкий восстановитель, такой как диметилсульфид (SMe2):
- RCH = CHR '+ O3 + SMe2 → RCHO + R'CHO + O = SMe2
- р2С = CHR '+ O3 → R2CHO + R'CHO + O = SMe2
При обработке горячим концентрированным подкисленным раствором KMnO4, алкены расщепляются кетоны и / или карбоновые кислоты. Стехиометрия реакции зависит от условий. Эта реакция и озонолиз могут быть использованы для определения положения двойной связи в неизвестном алкене.
Окисление можно остановить на вицинальный диол вместо полного расщепления алкена с помощью четырехокись осмия или другие окислители:
- R'CH = CR2 + 1/2 O2 + H2O → R'CH (OH) -C (OH) R2
Эта реакция называется дигидроксилирование.
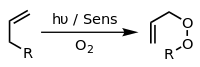
При наличии соответствующего фотосенсибилизатор, Такие как метиленовый синий и свет, алкены могут вступать в реакцию с активными формами кислорода, генерируемыми фотосенсибилизатором, такими как гидроксильные радикалы, синглетный кислород или же супероксид ион. Реакции возбужденного сенсибилизатора могут включать перенос электрона или водорода, обычно с восстанавливающим субстратом (реакция типа I) или взаимодействие с кислородом (реакция типа II).[14] Этими различными альтернативными процессами и реакциями можно управлять путем выбора конкретных условий реакции, что позволяет получать широкий спектр продуктов. Типичный пример - [4 + 2] -циклоприсоединение синглетного кислорода с диен Такие как циклопентадиен дать эндопероксид:
![Generation of singlet oxygen and its [4+2]-cycloaddition with cyclopentadiene](http://upload.wikimedia.org/wikipedia/commons/thumb/1/12/4%2B2_cycloaddition_cyclopentadiene_O2.svg/350px-4%2B2_cycloaddition_cyclopentadiene_O2.svg.png)
Другой пример - Реакция Шенкена, в котором синглетный кислород реагирует с аллильный структура для получения транспонированного аллила перекись:
Полимеризация
Полимеризация алкенов - это реакция, которая дает полимеры высокой промышленной ценности при большой экономии, например, пластмассы полиэтилен и полипропилен. Полимеры из алкена мономеры называются в общем как полиолефины или в редких случаях как полиалкены. Полимер из альфа-олефины называется полиальфаолефином (ПАО). Полимеризация может протекать либо по свободномурадикальный или ионный механизм, превращающий двойную связь в одинарную и формирующий одинарные связи для соединения других мономеров. Полимеризация сопряженный диены Такие как бута-1,3-диен или же изопрен (2-метилбута-1,3-диен) приводит в основном к 1,4-присоединению с возможным некоторым 1,2-присоединением диенового мономера к растущей полимерной цепи.
Металлообразование
 Структура бис (циклооктадиен) никель (0), металл-алкеновый комплекс
Структура бис (циклооктадиен) никель (0), металл-алкеновый комплекс
Алкены лиганды в алкеновые комплексы переходных металлов. Два углеродных центра связываются с металлом с помощью пи- и пи * -орбиталей C – C. Моно- и диолефины часто используются в качестве лигандов в стабильных комплексах. Циклооктадиен и норборнадиен являются популярными хелатирующими агентами, и даже этилен сам иногда используется в качестве лиганда, например, в Соль Цейзе. Кроме того, комплексы металл-алкен являются промежуточными продуктами во многих катализируемых металлами реакциях, включая гидрирование, гидроформилирование и полимеризацию.
Обзор реакции
| Название реакции | Товар | Комментарий |
|---|---|---|
| Гидрирование | алканы | добавление водорода |
| Гидроалкенилирование | алкены | гидрометаллирование / введение / бета-отщепление металлическим катализатором |
| Реакция присоединения галогена | 1,2-дигалогенид | электрофильное добавление галогенов |
| Гидрогалогенирование (Марковников ) | галогеналканы | добавление галогеноводородных кислот |
| Антимарковников гидрогалогенирование | галогеналканы | свободные радикалы, опосредованное добавлением галогеноводородных кислот |
| Гидроаминирование | амины | добавление связи N – H через двойную связь C – C |
| Гидроформилирование | альдегиды | промышленный процесс, добавление CO и H2 |
| Гидрокарбоксилирование и Реакция Коха | карбоновая кислота | промышленный процесс, добавление CO и H2О. |
| Карбоалкоксилирование | сложный эфир | промышленный процесс, добавление CO и спирта. |
| алкилирование | сложный эфир | промышленный процесс: алкилирование карбоновой кислоты алкеном кремневольфрамовая кислота катализатор. |
| Бишидроксилирование по методу Sharpless | диолы | окисление, реагент: четырехокись осмия, хиральный лиганд |
| Woodward СНГ-гидроксилирование | диолы | окисление, реагенты: йод, ацетат серебра |
| Озонолиз | альдегиды или кетоны | реагент: озон |
| Метатезис олефинов | алкены | два алкена перегруппировываются с образованием двух новых алкенов |
| Реакция Дильса – Альдера | циклогексены | циклоприсоединение с диеном |
| Реакция Паусона-Ханда | циклопентеноны | циклоприсоединение с алкином и CO |
| Гидроборирование – окисление | спирты | реагенты: боран, затем пероксид |
| Оксимеркурация-редукция | спирты | электрофильное добавление ацетата ртути, затем восстановление |
| Реакция принса | 1,3-диолы | электрофильное присоединение с альдегидом или кетоном |
| Реакция Патерно – Бюхи | оксетаны | фотохимическая реакция с альдегидом или кетоном |
| Эпоксидирование | эпоксид | электрофильное добавление пероксида |
| Циклопропанирование | циклопропаны | добавление карбенов или карбеноидов |
| Гидроацилирование | кетоны | окислительное добавление / восстановительное удаление металлическим катализатором |
| Гидрофосфинирование | фосфины |
Синтез
Промышленные методы
Алкены производятся из углеводородов. треск. Сырье в основном конденсат природного газа компоненты (в основном этан и пропан) в США и на Ближнем Востоке и нафта в Европе и Азии. Алканы распадаются при высоких температурах, часто в присутствии цеолит катализатор для получения смеси преимущественно алифатических алкенов и алканов с более низкой молекулярной массой. Смесь зависит от сырья и температуры и разделяется фракционной перегонкой. В основном он используется для производства небольших алкенов (до шести атомов углерода).[15]
Связанный с этим каталитический дегидрирование, где алкан теряет водород при высоких температурах с образованием соответствующего алкена.[1] Это обратное каталитическое гидрирование алкенов.

Этот процесс также известен как реформирование. Оба процесса являются эндотермическими и при высоких температурах движутся к алкену за счет энтропия.
Каталитический синтез высших α-алкенов (типа RCH = CH2) также может быть достигнута реакцией этилена с металлоорганическое соединение триэтилалюминий в присутствии никель, кобальт, или же платина.
Реакции элиминации
Одним из основных методов синтеза алкенов в лаборатории является комнатная устранение алкилгалогенидов, спиртов и подобных соединений. Наиболее распространенным является β-устранение по механизму E2 или E1,[16] но известны и α-исключения.
Механизм E2 обеспечивает более надежный метод β-элиминирования, чем E1, для большинства синтезов алкенов. Большинство случаев удаления E2 начинается с алкилгалогенида или сложного эфира алкилсульфоновой кислоты (такого как тозилат или же тройной ). Когда используется алкилгалогенид, реакция называется дегидрогалогенирование. Для несимметричных продуктов, как правило, преобладают более замещенные алкены (с меньшим количеством атомов водорода, присоединенным к C = C) (см. Правление Зайцева ). Двумя распространенными методами реакций элиминирования являются дегидрогалогенирование алкилгалогенидов и дегидратация спиртов. Типичный пример показан ниже; обратите внимание, что если возможно, H анти уходящей группе, хотя это приводит к менее стабильной Z-изомер.[17]
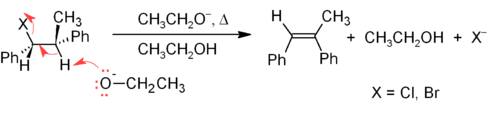
Алкены можно синтезировать из спиртов с помощью обезвоживание, и в этом случае вода теряется по механизму E1. Например, обезвоживание этиловый спирт производит этилен:
- CH3CH2ОН → Н2C = CH2 + H2О
Спирт также может быть преобразован в более удаляемую группу (например, ксантогенат ), чтобы позволить более мягкий син- устранение таких как Ликвидация Чугаева и Устранение Грико. Связанные реакции включают удаление β-галогенэфирами ( Бордовый синтез олефинов ) и сложные эфиры (пиролиз сложного эфира ).
Алкены могут быть получены косвенно из алкила амины. Амин или аммиак не являются подходящей уходящей группой, поэтому амин сначала либо алкилированный (как в Устранение Хофмана ) или окисленный до оксид амина (в Справиться реакция ), чтобы сделать возможным плавное исключение. Реакция Копа - это син- устранение, которое происходит при температуре 150 ° C или ниже, например:[18]

Исключение Хофмана необычно тем, что меньше замещенный (неСайцев ) алкен обычно является основным продуктом.
Алкены образуются из α-галосульфоны в Реакция Рамберга – Бэклунда через трехчленное кольцевое промежуточное соединение сульфона.
Синтез из карбонильных соединений
Другой важный метод синтеза алкена включает создание новой двойной углерод-углеродной связи путем сочетания карбонильного соединения (такого как альдегид или же кетон ) к карбанион эквивалент. Такие реакции иногда называют олефинации. Самым известным из этих методов является Реакция Виттига, но известны другие связанные методы, включая Реакция Хорнера – Уодсворта – Эммонса.
Реакция Виттига включает реакцию альдегида или кетона с Реагент Виттига (или фосфоран) типа Ph3P = CHR с образованием алкена и Ph3P = O. Реагент Виттига легко готовится из трифенилфосфин и алкилгалогенид. Реакция является довольно общей, и допускаются многие функциональные группы, даже сложные эфиры, как в этом примере:[19]

С реакцией Виттига связана Олефинирование Петерсона, который использует реагенты на основе кремния вместо фосфорана. Эта реакция позволяет выбрать E- или же Z-товары. Если E-продукт желателен, другой альтернативой является Юлия олефинирование, который использует карбанион, полученный из фенил сульфон. В Такай олефинирование на основе хроморганического интермедиата также поставляет электронные продукты. Соединение титана, Реактив Теббе, полезен для синтеза соединений метилена; в этом случае вступают в реакцию даже сложные эфиры и амиды.
Пара кетонов или альдегидов может быть дезоксигенированный для образования алкена. Симметричные алкены могут быть получены путем сочетания одного альдегида или кетона с самим собой, используя титан восстановление металла ( Реакция Макмерри ). Если необходимо связать разные кетоны, требуется более сложный метод, такой как Реакция Бартона – Келлогга.
Отдельный кетон можно также превратить в соответствующий алкен через его тозилгидразон, используя метоксид натрия (в Реакция Бэмфорда – Стивенса ) или алкиллитий ( Реакция Шапиро ).
Синтез из алкенов: метатезис олефинов и гидровинилирование
Рений- и молибденосодержащие гетерогенный катализ В этом процессе используются в коммерческих целях для взаимного превращения этилена и 2-бутена в пропилен:[20]
- CH2= CH2 + CH3CH = CHCH3 → 2 канала2= CHCH3
Катализируемый переходным металлом гидровинилирование - еще один важный процесс синтеза алкена, начинающийся с самого алкена.[21] Он включает присоединение водорода и винильной группы (или алкенильной группы) через двойную связь.
Из алкинов
Сокращение алкины полезный метод для стереоселективный синтез дизамещенных алкенов. Если СНГ-алкен желателен, гидрирование в присутствии Катализатор Линдлара (гетерогенный катализатор, состоящий из палладия, нанесенного на карбонат кальция и обработанного различными формами свинца), хотя гидроборирование с последующим гидролизом представляет собой альтернативный подход. Восстановление алкина за счет натрий металл в жидкости аммиак дает транс-алкен.[22]
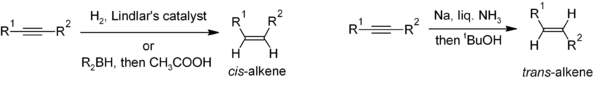
Для получения мультивещенных алкенов, карбометализация алкинов может дать начало большому разнообразию производных алкена.
Алкены могут быть синтезированы из других алкенов через реакции перегруппировки. Помимо метатезис олефинов (описал над ), много перициклические реакции можно использовать как ее реакция и Справиться перестановкой.
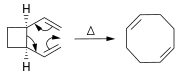
в Реакция Дильса – Альдера, а циклогексен производное получают из диена и реакционноспособного или электронодефицитного алкена.
Номенклатура ИЮПАК
Хотя номенклатура широко не соблюдается, согласно IUPAC, алкен представляет собой ациклический углеводород с одной двойной связью между атомами углерода.[3] Олефины включают более крупный набор циклических и ациклических алкенов, а также диенов и полиенов.[4]
Чтобы сформировать корень Имена ИЮПАК для алкенов с прямой цепью измените -an- инфикс родителя к -en-. Например, CH3-CH3 это алкан этан. Имя CH2= CH2 следовательно является ЭТЕН.
Для алкенов с прямой цепью с 4 или более атомами углерода это название не полностью идентифицирует соединение. Для этих случаев и для разветвленных ациклических алкенов применяются следующие правила:
- Найдите самую длинную углеродную цепь в молекуле. Если эта цепь не содержит двойной связи, назовите соединение в соответствии с правилами наименования алканов. Иначе:
- Пронумеруйте атомы углерода в этой цепочке, начиная с конца, ближайшего к двойной связи.
- Определите местоположение k двойной связи как число ее первого углерода.
- Назовите боковые группы (кроме водорода) согласно соответствующим правилам.
- Определите положение каждой боковой группы как номер углеродной цепи, к которой она присоединена.
- Напишите позицию и название каждой боковой группы.
- Напишите названия алканов с той же цепочкой, заменив суффикс «-ан» на «k-ene ".
Положение двойной связи часто вставляется перед названием цепи (например, «2-пентен», а не перед суффиксом («пент-2-ен»).
Позиции указывать не нужно, если они уникальны. Обратите внимание, что двойная связь может означать другую нумерацию цепей, чем та, которая используется для соответствующего алкана: (ЧАС
3C)
3C–CH
2–CH
3 представляет собой «2,2-диметилпентан», тогда как (ЧАС
3C)
3C–CH=CH
2 представляет собой «3,3-диметил-1-пентен».
Для полиенов и циклоалкенов применяются более сложные правила.[5]

СНГ–транс изомерия
Если двойная связь ациклического моноена не является первой связью цепи, имя, построенное выше, все равно не полностью идентифицирует соединение из-за СНГ-транс изомерия. Затем необходимо указать, находятся ли две одинарные связи C – C, смежные с двойной связью, на одной стороне ее плоскости или на противоположных сторонах. Для моноалкенов конфигурация часто обозначается префиксами СНГ- (из латинский "по эту сторону"]] или транс- («поперек», «по ту сторону») перед именем соответственно; как в СНГ-2-пентен или транс-2-бутен.

В более общем смысле, СНГ-транс изомерия будет существовать, если к каждому из двух атомов углерода в двойной связи присоединены два разных атома или группы. Учитывая эти случаи, ИЮПАК рекомендует более общие Обозначение E-Z, вместо СНГ и транс префиксы. В этой записи рассматривается группа с наивысшим Приоритет CIP в каждом из двух атомов углерода. Если эти две группы находятся на противоположных сторонах плоскости двойной связи, конфигурация помечена E (от Немецкий Entgegen означает «противоположный»); если они находятся на одной стороне, это помечается Z (с немецкого Zusammen, "вместе"). Этой маркировке можно научить с помощью мнемоники "Z означает «на ze ze zame zide» ».[23]

Группы, содержащие двойные связи C = C
ИЮПАК признает два названия углеводородных групп, содержащих двойные углерод-углеродные связи: виниловая группа и аллил группа.[5]

Смотрите также
- Альфа-олефин
- Аннулен
- Ароматический углеводород ("Арен")
- Циклоалкен
- Дендрален
- Диен
- Нитроалкен
- Полиен
- Radialene
Номенклатурные ссылки
- Правило А-3. Ненасыщенные соединения и одновалентные радикалы [1] Синяя книга ИЮПАК.
- Правило А-4. Двухвалентные и многовалентные радикалы [2] Синяя книга ИЮПАК.
- Правила A-11.3, A-11.4, A-11.5 Ненасыщенные моноциклические углеводороды и заместители [3] Синяя книга ИЮПАК.
- Правило А-23. Гидрированные соединения конденсированных полициклических углеводородов [4] Синяя книга ИЮПАК.
Рекомендации
- ^ а б c Уэйд, Л. (2006). Органическая химия (6-е изд.). Пирсон Prentice Hall. стр.279. ISBN 978-1-4058-5345-3.
- ^ Х. Стивен Стокер (2015): Общая, органическая и биологическая химия. 1232 страницы. ISBN 9781305686182
- ^ а б ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "алкены ". Дои:10.1351 / goldbook.A00224
- ^ а б c ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "олефины ". Дои:10.1351 / goldbook.O04281
- ^ а б c Moss, G.P .; Смит, П. А. С .; Тавернье, Д. (1995). «Глоссарий названий классов органических соединений и реакционноспособных промежуточных продуктов на основе структуры (Рекомендации IUPAC 1995 г.)». Чистая и прикладная химия. 67 (8–9): 1307–1375. Дои:10.1351 / pac199567081307. S2CID 95004254.
- ^ «Производство: рост - это норма». Новости химии и техники. 84 (28): 59–236. 10 июля 2006 г. Дои:10.1021 / cen-v084n034.p059.
- ^ Слоан, Н. Дж. А. (ред.). «Последовательность A000631 (Число производных этилена с n атомами углерода)». В Он-лайн энциклопедия целочисленных последовательностей. Фонд OEIS.
- ^ а б Barrows, Susan E .; Эберлейн, Томас Х. (2005). «Понимание вращения о двойной связи C = C». J. Chem. Образовательный. 82 (9): 1329. Bibcode:2005JChEd..82.1329B. Дои:10.1021 / ed082p1329.
- ^ а б Бансал, Радж К. (1998). "Правило Бредта". Механизмы органических реакций (3-е изд.). McGraw-Hill Education. С. 14–16. ISBN 978-0-07-462083-0.
- ^ Фосетт, Фрэнк С. (1950). "Правило Бредта двойных связей в атомно-мостиковых кольцевых структурах". Chem. Ред. 47 (2): 219–274. Дои:10.1021 / cr60147a003. PMID 24538877.
- ^ «Правило Бредта». Комплексные органические названия реакций и реагенты. 116. 2010. С. 525–528. Дои:10.1002 / 9780470638859.conrr116. ISBN 978-0-470-63885-9.
- ^ Дуань, Сюйфан; Блок, Эрик; Ли, Чжэнь; Коннелли, Тимоти; Чжан, Цзянь; Хуанг, Чжимин; Су, Сюбо; Пан, Йи; Ву, Лифанг (28 февраля 2012 г.). «Решающая роль меди в обнаружении запахов, координирующих металл». Труды Национальной академии наук Соединенных Штатов Америки. 109 (9): 3492–3497. Bibcode:2012PNAS..109.3492D. Дои:10.1073 / pnas.1111297109. ISSN 0027-8424. ЧВК 3295281. PMID 22328155.
- ^ Штрейвизер, А.; Хиткок, К.; Косовер, Э.М. (1992). «11.6.G. Алкены: реакции: присоединения свободных радикалов». Введение в органическую химию (4-е изд.). Нью-Йорк: Макмиллан. п. 288.
- ^ Baptista, Maurício S .; Кадет Жан; Маскио, Паоло Ди; Ghogare, Ashwini A .; Грир, Александр; Hamblin, Michael R .; Лоренте, Каролина; Нуньес, Сильвия Кристина; Рибейро, Марта Симойнс; Thomas, Andrés H .; Виньони, Мариана; Йошимура, Таня Матеус (2017). «Реакции фотосенсибилизированного окисления типа I и типа II: рекомендации и механизмы». Фотохимия и фотобиология. 93 (4): 912–919. Дои:10.1111 / php.12716.
- ^ Уэйд, Л. (2006). Органическая химия (6-е изд.). Пирсон Prentice Hall. стр.309. ISBN 978-1-4058-5345-3.
- ^ Сондерс, В. Х. (1964). Патай, Саул (ред.). Химия алкенов. Wiley Interscience. С. 149–150.
- ^ Cram, D.J .; Грин, Фредерик Д.; Депуи, К. Х. (1956). "Исследования по стереохимии. XXV. Затменные эффекты в реакции E21". Журнал Американского химического общества. 78 (4): 790–796. Дои:10.1021 / ja01585a024.
- ^ Bach, R.D .; Анджеевский, Денис; Дусольд, Лоуренс Р. (1973). «Механизм ликвидации Коупа». J. Org. Chem. 38 (9): 1742–3. Дои:10.1021 / jo00949a029.
- ^ Снайдер, Барри Б.; Мацуо, Y; Снайдер, BB (2006). «Синтез энт-таллузина». Орг. Латыш. 8 (10): 2123–6. Дои:10.1021 / ol0605777. ЧВК 2518398. PMID 16671797.
- ^ Лайонел Делод, Альфред Ф. Ноэлс (2005). «Метатезис». Энциклопедия химической технологии Кирка-Отмера. Вайнхайм: Wiley-VCH. Дои:10.1002 / 0471238961.metanoel.a01. ISBN 978-0471238966.CS1 maint: использует параметр авторов (связь)
- ^ Фогт, Д. (2010). «Катализируемое кобальтом асимметричное гидровинилирование». Энгью. Chem. Int. Эд. 49 (40): 7166–8. Дои:10.1002 / anie.201003133. PMID 20672269.
- ^ Цвайфель, Джордж С .; Нантц, Майкл Х. (2007). Современный органический синтез: введение. Нью-Йорк: W.H. Freeman & Co., стр.366. ISBN 978-0-7167-7266-8.
- ^ Джон Э. Макмерри (2014): Органическая химия с биологическим применением; 3-е издание. 1224 страницы. ISBN 9781285842912