Реакция присоединения галогена - Halogen addition reaction
А реакция присоединения галогена это простой органическая реакция где галоген молекула добавляется к углерод-углеродная двойная связь из алкен функциональная группа.[1]
Генерал химическая формула реакции присоединения галогена:
- С = С + Х2 → Х-С-С-Х
(X представляет собой галогены бром или же хлор, и в этом случае растворителем может быть CH2Cl2 или же CCl4 ). Продукт является вицинальный дигалогенид.
Этот тип реакции является галогенирование и электрофильная добавка.
Механизм реакции
В механизм реакции бромирование алкена можно описать следующим образом. На первом этапе реакции молекула брома приближается к богатой электронами алкен углерод-углеродная двойная связь. Атом брома, расположенный ближе к связи, принимает частичный положительный заряд, поскольку его электроны отталкиваются электронами двойной связи.
 |  |
| Присоединение брома к механизму реакции алкена | Бромид-ион атакует антисвязывающую молекулярную орбиталь C – Br σ * иона бромония. |
Атом электрофильный в это время и подвергается атаке пи-электронами алкена [углерод-углеродная двойная связь]. Он на мгновение образует сингл сигма-облигация к обе вовлеченных атомов углерода. Связь бром является особенным в этом промежуточном продукте из-за его относительно большого размера по сравнению с углерод, бромид ион способен взаимодействовать с обоими атомами углерода, которые когда-то разделяли π-связь, образуя трехчленное кольцо. Бромид-ион приобретает положительный формальный заряд. На данный момент галоген ион называется "ион бромония " или же "ион хлорония ", соответственно.
Когда первый атом брома атакует углерод-углерод π-связь, он оставляет один из своих электронов с другим бромом, с которым он был связан в Br2. Этот другой атом теперь отрицательный бромид анион и притягивается к небольшому положительному заряду на атомах углерода. Он заблокирован от нуклеофильная атака на одной стороне углеродной цепи первым атомом брома и может атаковать только с другой стороны. Когда он атакует и образует связь с одним из атомов углерода, связь между первым атомом брома и другими атомами углерода разрывается, оставляя каждый атом углерода с галогеновым заместителем.
Таким образом, два галогена добавляют анти добавление моды, и когда алкен является частью цикла, дибромид принимает транс конфигурация. Для максимального перекрытия C – Br σ * разрушение молекулярная орбиталь ( LUMO, показан справа красным) и нуклеофил (X−) одинокая пара (в HOMO, показаны справа внизу зеленым цветом), X− должен атаковать ион бромония сзади, на углерод.
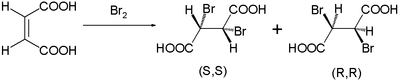
Этот механизм реакции был предложен Робертсом и Кимбаллом в 1937 году.[2] Этим они объяснили наблюдаемые стереоспецифические транс-добавки в бромирование малеиновая кислота и фумаровая кислота. Малеиновая кислота с СНГ-двойная связь образует дибромид в виде смеси энантиомеры:
в то время как транс-изомер фумаровой кислоты образует один мезо сложный:
Реакция стереоспецифична даже в алкенах с двумя объемными терт-бутил группы в СНГ положение как в соединении СНГ-ди-терт-бутилэтилен.[3] Несмотря на стерическое отталкивание присутствующий в ионе хлорония, единственный образующийся продукт - это анти-аддукт.
β-галокарбокации
В альтернативной схеме реакции, изображенной ниже, реакционноспособным промежуточным продуктом является ион β-бромкарбония или β-бромкарбония с одним из атомов углерода, являющимся подлинным карбокатион.
Для реакций, протекающих через этот механизм, нет стереоспецифичность ожидается и действительно не найден.
Робертс и Кимбалл в 1937 г. уже учли тот факт, что бромирование малеат ион привел к СНГ-добавление, вызванное отталкиванием между отрицательно заряженными анионами карбоновой кислоты, более сильным, чем образование иона галогена. В алкенах, таких как анетолы и стильбены заместители способны стабилизировать карбокатион, отдавая электроны за счет иона галония.[4]
Ионы галония можно идентифицировать с помощью ЯМР-спектроскопия. В 1967 году группа Джордж А. Олах получены спектры ЯМР ионов тетраметилэтиленбромония растворением 2,3-дибром-2,3-диметилбутана в волшебная кислота при -60 ° С.[5] Спектр для соответствующих фтор соединение, с другой стороны, соответствовало быстрому уравновешивание пара β-фторкарбокатионов.
Смотрите также
- Пример бромирования в Синтез ауверса
Рекомендации
- ^ Органическая химия 4-е изд. Моррисон и Бойд ISBN 0-205-05838-8
- ^ Робертс, Ирвинг; Кимбалл, Джордж Э. (1937). «Галогенирование этиленов». Журнал Американского химического общества. 59 (5): 947. Дои:10.1021 / ja01284a507.
- ^ Фэйи, Роберт С. (1966). «Полярные добавки к олефинам. II. Хлорирование ди-трет-бутилэтилена». Журнал Американского химического общества. 88 (20): 4681. Дои:10.1021 / ja00972a030.
- ^ Руасс, Мария Франсуаза (1990). «Ионы бромония или β-бромокарбокатионы в бромировании олефинов. Кинетический подход к селективности продукта». Отчеты о химических исследованиях. 23 (3): 87. Дои:10.1021 / ar00171a006.
- ^ Olah, George A .; Боллинджер, Дж. Мартин (1967). «Стабильные ионы карбония. XLVIII. Образование иона галония за счет участия соседних галогенов. Ионы тетраметилэтиленгалогония». Журнал Американского химического общества. 89 (18): 4744. Дои:10.1021 / ja00994a031.