Дендрален - Dendralene
А дендрален дискретный ациклический перекрестно сопряженный полиен.[1] [2] [3] Самый простой дендрален - это бута-1,3-диен (1) или [2] дендрален с последующим [3] дендрален (2), [4] дендрален (3) и [5] дендрален (4) и так далее. [2] дендрален (бутадиен) - единственный дендрален, который не подвергается перекрестному сопряжению.
Название дендрален состоит из слов дендример, линейный и алкен. Высшие дендралены представляют научный интерес, потому что они открывают большое количество новых органические соединения из относительно простого предшественника, особенно с помощью Дильс-Альдер химия. Их циклические аналоги метко называют радиалены.
Синтез
Винилбутадиен ([3] дендрален) был впервые получен в 1955 г. пиролиз триацетата:[4] [5]
Это соединение реагирует с двумя эквивалентами малеиновый ангидрид в тандемной реакции DA:[6]
С бензохинон продукт реакции - линейный полимер.
Сообщалось о нескольких синтезах замещенных [3] дендраленов, один с помощью аллен,[7] один через Реакция Хорнера – Уодсворта – Эммонса,[8] один через реакция кросс-сочетания [9] и один из аллильного карбоната.[10]
Один синтетический маршрут к [4] дендралену начинается от хлоропрен.[11] Это соединение превращается в Реактив Гриньяра действием магний металл, который затем вступает в реакцию с хлорид меди (I) для органо-медь промежуточное соединение, которое, в свою очередь, димеризуется с использованием хлорид меди (II) в окислительная связь реакция дать бутадиен димер называется [4] дендраленом.
Сообщается о газовой молекулярной структуре [4] дендралена. [12]
О соединении [8] -дендралена сообщалось в 2009 г .:[13]
в следующем Связь Кумада – Тамао – Корриу и Муфта Негиши.
В 2016 г. сообщалось о серии от [9] до [12] -дендраленов. [14]
Характеристики
Четночленные дендралены (например, [6] дендрален, [8] дендрален), как правило, ведут себя как цепочки разделенных и изолированных диен единицы. В ультрафиолетовый поглощение максимумы равны самому бутадиену. Дендралены с нечетным числом алкен единицы более реакционноспособны из-за наличия благоприятного s-цис-диена конформации и Реакции Дильса-Альдера проходить легче с предпочтением конечных точек.
Реакции
С простыми диенофилами дендралы могут дать быстрый доступ к сложным молекулам в Реакции Дильса-Альдера. Сообщалось о нескольких схемах реакции. [11] [15] [16] [17] [18] [19] [20] [21] [22]
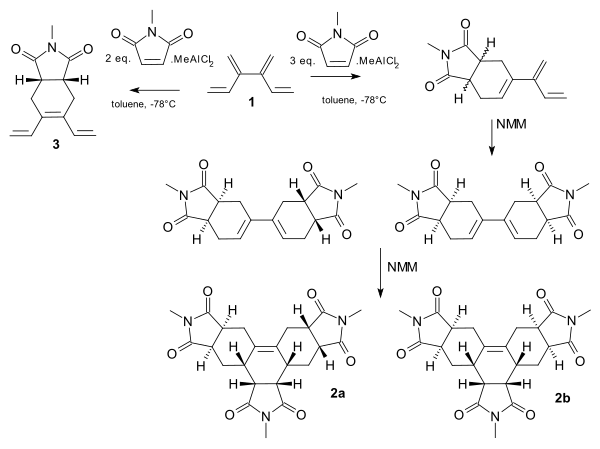
[4] дендрален показывает тандем Реакция Дильса-Альдера с диенофил N-метил-малеимид (NMM).[11] Полная селективность сайта возможна с добавлением Кислота Льюиса метилдихлоралюминий. С одним набором предварительного смешивания и 2 эквивалентами NMM центральная диеновая группа нацелена на моноаддукт 3. При другом наборе и большем количестве диенофила концевые группы реагируют, и реакция протекает от моноаддукта к трисаддукту 2 и 2b.
Один из вариантов реакции циклопропанирование в составной класс, называемый ivyanes с сообщенным синтезом в Реакция Симмонса – Смита (диэтилцинк / трифторуксусная кислота ) первых 6 членов.[23] Эти 1,1-олигоциклопропаны стабильны (за исключением воздействия кислот) и имеют большую теплота сгорания с [6] ivyane, превышающим кубан. Цепи олигоциклопропана имеют спиральную конформацию. Для [3] дендралена описана реакция фотохимической циклизации. [24]
Производные
Сообщалось о бициклическом [4] дендраленовом соединении. [25]
Рекомендации
- ^ Хеннинг Хопф, Классика по химии углеводородов, Вайли ВЧ, 2000.
- ^ Hopf, H .; Шербурн, М. С. (2012). «Разветвление дендраленов: кросс-конъюгированные олигоены позволяют быстрое образование молекулярной сложности». Angewandte Chemie International Edition на английском языке. 51: 2298–2338. Дои:10.1002 / anie.201102987.
- ^ Получение и синтетическая ценность разветвленных углеводородов с высоким содержанием π-связей Отчет Майкла С. Шерберна о химических исследованиях, 2015 г. 48 (7), 1961-1970 гг. Дои:10.1021 / acs.accounts.5b00242
- ^ Бейли, Уильям Дж .; Экономика, Джеймс (1955). «Пиролиз сложных эфиров. III. Синтез 2-винилбутадиена». Варенье. Chem. Soc. 77 (5): 1133–1136. Дои:10.1021 / ja01610a014.
- ^ Бломквист, А. Т .; Вердоль, Джозеф А. (1955). «2-Винил-1,3-бутадиен». Варенье. Chem. Soc. 77 (1): 81–83. Дои:10.1021 / ja01606a025.
- ^ Бейли, Уильям Дж .; Экономика, Джеймс; Гермес, Мэтью Э. (1962). «Полимеры. IV. Полимерные реакции Дильса-Альдера». J. Org. Chem. 27 (9): 3295–3299. Дои:10.1021 / jo01056a074.
- ^ Миеко Арисава, Такумичи Сугихара и Масахико Ямагути Синтез кросс-сопряженных триенов димеризацией алленов на палладий-фенольном катализаторе Chem. Commun. 1998; 2615-2616 Дои:10.1039 / A807527A
- ^ Рекха Сингх и Сунил К. Гош Синтез замещенных [3] дендраленов и их уникальные реакции циклоприсоединения. Chem. Commun. 2011; Предварительная статья Дои:10.1039 / C1CC14211A
- ^ Брэдфорд, Таня А .; Пейн, Алан Д .; Уиллис, Энтони С .; Пэддон-Роу, Майкл Н .; Шерберн, Майкл С. (2007). "Перекрестное связывание для кросс-конъюгации:? Практический синтез и Дильс? Реакции Альдера [3] дендраленов". Органические буквы. 9 (23): 4861–4864. Дои:10.1021 / ol7021998.
- ^ Кассем Бейдун, Хуэй-Цзюнь Чжан, Баскер Сундарараджу, Бернар Демерсеман, Матье Ахард, Чжэньфэн Си и Кристиан Бруно Эффективный катализируемый рутением синтез [3] дендраленов из 1,3-диеновых аллильных карбонатов Chem. Commun. 2009; 6580-6582 Дои:10.1039 / B913595B
- ^ а б c Пейн, Алан Д .; Уиллис, Энтони С .; Шерберн, Майкл С. (2005). "Практический синтез и химия Дильса-Альдера [4] дендралена". Журнал Американского химического общества. 127 (35): 12188–12189. Дои:10.1021 / ja053772 +. ISSN 0002-7863. PMID 16131173.
- ^ Молекулярная структура 3,4-диметиленгекса-1,5-диена ([4] дендралена), C8H10, в газовой фазе, определенная с помощью электронной дифракции и расчетов ab Initio Пол Т. Брэйн, Брюс А. Смарт, Хизер Э. Робертсон, Мартин Дж. Дэвис †, Дэвид В. Х. Ранкин *, Уильям Дж. Генри и Ян Госни. Журнал органической химии 1997 62 (9), 2767-2773 Дои:10.1021 / jo962091h
- ^ Практический синтез семейства дендраленов выявляет чередование в поведении Алан Д. Пейн, Гомотсанг Боджасе, Майкл Н. Пэддон-Роу и Майкл С. Шерберн Энгью. Chem. Int. Эд. 2009, 48, Дои:10.1002 / anie.200901733
- ^ Открытие и вычислительная рационализация убывающего чередования в [n] дендраленах Мехмет Ф. Саглам, Томас Фэллон, Майкл Н. Паддон-Роу и Майкл С. Шерберн Журнал Американского химического общества 2016 138 (3), 1022-1032 Дои:10.1021 / jacs.5b11889
- ^ Brummond, Kay M .; Вы, Линфэн (2005). «Последовательная последовательность реакций Альдерена / Дильса-Альдера / Дильса-Альдера, катализируемая Rh (I), обеспечивающая быстрое вступление в полициклические соединения». Тетраэдр. 61 (26): 6180–6185. Дои:10.1016 / j.tet.2005.03.141.
- ^ Hopf, H .; Йылдыжан, Ş. (2011). «Высокофункциональные, анеллированные угловые ароматические соединения из дендраленов». Европейский журнал органической химии. 2011: 2029–2034. Дои:10.1002 / ejoc.201001536.
- ^ Новый и простой стереоконтролируемый метод синтеза полигидро-хинолинов и пиридопиридазинов с помощью диен-трансмиссивной реакции Дильса-Альдера, включающей обратное циклоприсоединение гетеро-Дильса-Альдера к кросс-конъюгированным азатриенам с потребностью в электронах. Тетраэдр, том 64, выпуск 41, 6 октября 2008 г., страницы 9705-9716 Сатору Кобаяши, Томоки Фуруя, Такаши Отани и Такао Сайто Дои:10.1016 / j.tet.2008.07.102
- ^ Синтез мощного противомалярийного амфилектена Сергей В. Пронин и Райан А. Шенви Журнал Американского химического общества, 2012 г. 134 (48), 19604-19606 гг. Дои:10.1021 / ja310129b
- ^ Green, N.J .; Lawrence, A. L .; Bojase, G .; Уиллис, А. С .; Paddon-Row, M.N .; Шербурн, М. С. (2013). "Органокаскады домино циклоприсоединения дендраленов". Энгью. Chem. Int. Эд. 52: 8333–8336. Дои:10.1002 / anie.201302185.
- ^ Практический синтез и реакционная способность [3] дендралена. Таня А. Брэдфорд, Алан Д. Пейн, Энтони К. Уиллис, Майкл Н. Паддон-Роу и Майкл С. Шерберн Журнал органической химии 2010 75 (2), 491-494 Дои:10.1021 / jo9024557
- ^ Многокомпонентные диен-трансмиссивные последовательности Дильса – Ольхи, содержащие аминодендралены С. М. Тан, А. К. Уиллис, М. Н. Паддон-Роу, М. С. Шерберн, Angew. Chem. Int. Эд. 2016, 55, 3081. Дои:10.1002 / anie.201510925
- ^ Синтез и реакционная способность по Дильсу – Альдеру замещенных [4] дендраленов Мехмет Ф. Саглам, Али Р. Альборзи, Алан Д. Пейн, Энтони К. Уиллис, Майкл Н. Паддон-Роу и Майкл С. Шерберн Журнал органической химии 2016 81 (4), 1461-1475 Дои:10.1021 / acs.joc.5b02583
- ^ Боджасе, Гомотсанг; Nguyen, Thanh V .; Пейн, Алан Д .; Уиллис, Энтони С .; Шерберн, Майкл С. (2011). «Синтез и свойства иванов: исходных 1,1-олигоциклопропанов» (PDF). Chem. Наука. 2: 229–232. Дои:10.1039 / C0SC00500B.
- ^ Tetrahedron Letters Том 35, выпуск 29, 18 июля 1994 г., страницы 5251–5252 Новая фотохимическая реакция [3] производных дендралена. Кейджи Окада, Кацудзи Маэхара, Масаджи Ода Дои:10.1016 / S0040-4039 (00) 77076-6
- ^ Превращение азуленов в производные бициклического [4] дендралена и гептафульвена путем фотохимического циклоприсоединения диалкилсилилена. Томоюки Косай, Синтаро Исида, Такеаки Ивамото Чем. Commun., 2015,51, 10707-10709 Дои:10.1039 / C5CC03424H




![[4] схема синтеза дендралена из хлоропрена](http://upload.wikimedia.org/wikipedia/commons/thumb/4/40/4-dendralene.svg/569px-4-dendralene.svg.png)
![[8] -дендраленовый синтез](http://upload.wikimedia.org/wikipedia/commons/thumb/9/9d/8-dendralene.svg/411px-8-dendralene.svg.png)