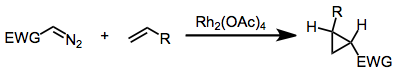Циклопропанирование - Cyclopropanation
Циклопропанирование относится к любому химическому процессу, который приводит к циклопропан кольца. Это важный процесс в современной химии, так как многие полезные соединения имеют этот мотив; Например пиретроиды и ряд хинолоновые антибиотики (ципрофлоксацин, спарфлоксацин, так далее.). Однако высокий напряжение кольца присутствие в циклопропанах затрудняет их производство и обычно требует использования высокореактивных частиц, таких как карбены, илиды и карбанионы.[1] Многие реакции протекают в хелетропный манера.

Подходы
Из алкенов с помощью карбеноидных реагентов
Существует несколько методов преобразования алкенов в циклопропановые кольца с использованием карбен типа реагенты. Поскольку сами карбены обладают высокой реакционной способностью, их обычно используют в стабилизированной форме, называемой карбеноид.[2]
Реакция Симмонса – Смита
в Реакция Симмонса – Смита реактивный карбеноид йодметилцинк йодид, который обычно образуется в результате реакции между дииодметан и цинк-медная пара. Были разработаны модификации, включающие более дешевые альтернативы, такие как дибромметан[3] или же диазометан и йодид цинка.[4] Реакционная способность системы также может быть увеличена путем замены пары цинк-медь на диэтилцинк.[5] Известны асимметричные версии.[6]
Использование диазосоединений
Определенный диазосоединения, Такие как диазометан, может реагировать с олефинами с образованием циклопропанов в 2 стадии. Первый шаг включает 1,3-диполярное циклоприсоединение сформировать пиразолин который затем подвергается денитрогенизации, либо фотохимически или по термическое разложение, чтобы дать циклопропан. Термальный маршрут, который часто используется КОН и платина в качестве катализаторов, также известен как Кишнер синтез циклопропана после русского химика Николай Кишнер[7][8] а также может выполняться с помощью гидразин и α, β-ненасыщенные карбонильные соединения.[9] Механизм разложения был предметом нескольких исследований и остается несколько спорным, хотя в целом считается, что он происходит через бирадикальные виды.[10][11] С точки зрения зеленая химия этот метод превосходит другие циклопропанирования на основе карбена; так как он не содержит металлов или галогенированных реагентов и производит только N2 как побочный продукт. Однако реакция может быть опасной, поскольку следовые количества непрореагировавших диазосоединений могут взорваться во время термической перегруппировки пиразолина.
Использование диазосоединений с металлическим катализом
Метил фенилдиазоацетат и многие родственные диазопроизводные являются предшественниками донорно-акцепторные карбены, которые можно использовать для циклопропанирования или для вставки в связи C-H органических субстратов. Эти реакции катализируются тетраацетат диродия или, что более эффектно, родственные хиральные производные.[12] [13][14]
Использование свободных карбенов
Свободный карбены могут быть использованы для реакций циклопропанирования, однако возможности для этого ограничены, так как немногие из них могут быть удобно получены, и почти все они нестабильны (см .: димеризация карбена ). Исключением являются дигалокарбены, такие как дихлоркарбен или же дифторкарбен, которые достаточно стабильны и будут реагировать с образованием близнец дигало-циклопропаны.[15] Эти соединения затем можно использовать для образования аллены через Перестройка скаттебёля.
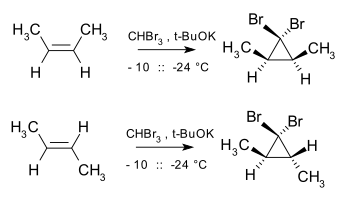
В Расширение кольца Бюхнера реакция также включает образование стабилизированного карбена. стереоспецифический поскольку добавление карбена и карбеноидов к алкенам является формой хелетропная реакция, причем сложение происходит в син манера. Например, дибромокарбен и СНГ-2-бутен выход СНГ-2,3-диметил-1,1-дибромциклопропан, тогда как транс изомер дает исключительно транс циклопропан.[16]
Из алкенов с помощью илидов
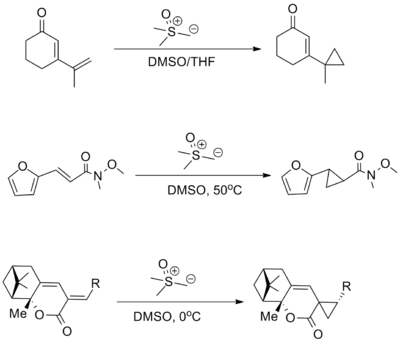
Циклопропаны могут быть получены с использованием серы. илида в Реакция Джонсона – Кори – Чайковского,[17] однако этот процесс в значительной степени ограничен использованием олефинов с низким содержанием электронов, особенно α, β-ненасыщенных карбонил соединения.
Внутримолекулярная циклизация
Циклопропаны могут быть получены различными внутримолекулярными циклизация реакции. Простым методом является использование первичных галогеналканов, содержащих соответствующим образом расположенные электроноакцепторные группы. Лечение сильным основанием вызовет карбанион который будет циклизироваться в 3-экзо-триггерный способом, с вытеснением галогенида. Примеры включают образование циклопропилцианид[18] и циклопропилацетилен[19] Этот механизм также составляет основу Перестановка Фаворского.
Связанный процесс - это циклизация 1,3-дибромпропан через Муфта Вюрца. Это было использовано для первого синтеза циклопропан к Август Фройнд в 1881 году. Первоначально эту реакцию проводили с использованием натрия,[20] однако урожай можно повысить, заменив его на цинк.[21]
- BrCH2CH2CH2Br + 2 Na → (CH2)3 + 2 NaBr
Другие подходы
- В Кулинковича реакция форма циклопропанолы посредством реакции сложных эфиров и Реактивы Гриньяра в присутствии алкоголята титана.
- В Реакция Бингеля это специализированная реакция циклопропанирования, используемая для функционализации фуллерен.
- в ди-пи-метановая перегруппировка фотохимический стимуляция заставляет 1,4-диены переставить с образованием винилциклопропанов.[22] Затем они могут пройти винилциклопропановые перегруппировки
- Циклопропан-жирная-ацил-фосфолипид-синтаза выполняет циклопропанирование в биологических системах
Биосинтез

Хотя циклопропаны относительно редки в биохимии, многие пути циклопропанирования были идентифицированы в природе. Наиболее распространенные пути включают реакции замыкания кольца карбокатионов в терпеноиды. Циклопропановые жирные кислоты происходят от атаки S-аденозилметионин (SAM) по ненасыщенным жирным кислотам. Предшественник гормона этилен, 1-аминоциклопропан-1-карбоновая кислота происходит непосредственно из SMM посредством внутримолекулярного нуклеофильного замещения SMe2 группа после конденсации с пиридоксальфосфат.[23] Прямой переход карбена из диазоэфиров в олефины также достигается за счет in vitro биокатализ с использованием модифицированных вариантов цитохром P450 фермент из Bacillus megaterium которые были оптимизированы направленная эволюция.[24]
Рекомендации
- ^ Пеллиссье, Элен (июль 2008 г.). «Последние разработки в области асимметричного циклопропанирования». Тетраэдр. 64 (30–31): 7041–7095. Дои:10.1016 / j.tet.2008.04.079.
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "карбеноиды ". Дои:10.1351 / goldbook.C00813.html
- ^ Фабиш, Бодо; Митчелл, Теренс Н. (1984). «Недорогая модификация реакции Симмонса-Смита: образование бромметилцинка бромида по данным ЯМР-спектроскопии». Журнал металлоорганической химии. 269 (3): 219–221. Дои:10.1016 / 0022-328X (84) 80305-8.
- ^ Виттиг, Георг; Винглер, Франк (1 августа 1964). "Über methylenierte Metallhalogenide, IV. Cyclopropan-Bildung aus Olefinen mit Bis-halogenmethyl-zink". Chemische Berichte. 97 (8): 2146–2164. Дои:10.1002 / cber.19640970808.
- ^ Furukawa, J .; Kawabata, N .; Нисимура, Дж. (1968). «Синтез циклопропанов по реакции олефинов с диалкилцинком и йодистым метиленом». Тетраэдр. 24 (1): 53–58. Дои:10.1016/0040-4020(68)89007-6.
- ^ Шаретт, А. Б .; Бошемин, А. (2001). Реакция циклопропанирования Симмонса-Смита. Орг. Реагировать. 58. п. 1. Дои:10.1002 / 0471264180.or058.01. ISBN 978-0471264187.
- ^ Льюис, Дэвид Э. (4 ноября 2013 г.). «Инвалидность, деспотизм, дезоксигенация - от ссылки к академику: Кижнер Николай Матвеевич». Angewandte Chemie International Edition. 52 (45): 11704–11712. Дои:10.1002 / anie.201303165. PMID 24123691.
- ^ Кишнер Н. М., Завадовский А. // Журн. Phys. Chem. Soc. 43, 1132 (1911).
- ^ J. Petersen, R .; П.С. Скелл, П. (1967). «ФЕНИЛЦИКЛОПРОПАН». Орг. Синтезатор. 47: 98. Дои:10.15227 / orgsyn.047.0098.
- ^ Кроуфорд, Роберт Дж .; Мишра, Анупама (сентябрь 1966 г.). «Механизм термического разложения 1-пиразолинов и его связь с изомеризацией циклопропана». Журнал Американского химического общества. 88 (17): 3963–3969. Дои:10.1021 / ja00969a014.
- ^ Мурай, Елена; Илла, Она; Кастильо, Хосе А .; Альварес-Ларена, Анхель; Bourdelande, José L .; Бранчаделл, Висенс; Ортуньо, Роза М. (июнь 2003 г.). «Фотолиз хиральных 1-пиразолинов в циклопропаны: механизм и стереоспецифичность». Журнал органической химии. 68 (12): 4906–4911. Дои:10.1021 / jo0342471. PMID 12790598.
- ^ Дэвис, Х. М. Л .; Мортон, Д. (2011). «Руководящие принципы для сайт-селективной и стереоселективной межмолекулярной функционализации C – H донорными / акцепторными карбенами родия». Обзоры химического общества. 40 (4): 1857–1869. Дои:10.1039 / C0CS00217H.
- ^ Хью М. Л. Дэвис; Вэнь-хао Ху; Дун Син (2015). «Метилфенилдиазоацетат». EEROS: 1–10. Дои:10.1002 / 047084289X.rn00444.pub2. ISBN 9780470842898.
- ^ Лебель, Элен; Марку, Жан-Франсуа; Молинаро, Кармела; Шаретт, Андре Б. (1 апреля 2003 г.). «Стереоселективные реакции циклопропанирования». Химические обзоры. 103 (4): 977–1050. Дои:10.1021 / cr010007e. PMID 12683775.
- ^ Федорински, Михал (1 апреля 2003 г.). «Синтезы дигалоциклопропанов и их использование в органическом синтезе». Химические обзоры. 103 (4): 1099–1132. Дои:10.1021 / cr0100087. PMID 12683778.
- ^ Скелл, П.С.; Гарнер, А. (1956). «Стереохимия реакций карбен-олефин. Реакции дибромокарбена с цис- и транс-2-бутенами». Журнал Американского химического общества. 78 (14): 3409–3411. Дои:10.1021 / ja01595a040.
- ^ Li, A.-H .; Dai, L.-X .; Аггарвал В. К. (1997). «Асимметричные реакции илида: эпоксидирование, циклопропанирование, азиридинирование, олефинирование и перегруппировка». Химические обзоры. 97 (6): 2341. Дои:10.1021 / cr960411r.
- ^ Шлаттер, М. Дж. (1943). «Циклопропилцианид». Органический синтез. 23: 20. Дои:10.15227 / orgsyn.023.0020.; Коллективный объем, 3, п. 223.
- ^ Хантингтон, Марта; Корли, Эдвард Дж .; Томпсон, Эндрю С. (2000). «Циклопропилацетилен». Органический синтез. 77: 231. Дои:10.15227 / orgsyn.077.0231.
- ^ Фройнд, август (1881 г.). «Убер-триметилен» [О триметилене]. Journal für Praktische Chemie (на немецком). 26 (1): 625–635. Дои:10.1002 / prac.18820260125.
- ^ Густавсон, Г. (1887). "Ueber eine neue Darstellungsmethode des Trimethylens" [О новом способе представления триметилена]. J. Prakt. Chem. (на немецком). 36: 300–305. Дои:10.1002 / prac.18870360127.
- ^ ИЮПАК Золотая книга определение[постоянная мертвая ссылка ]
- ^ Wessjohann, Ludger A .; Брандт, Вольфганг; Thiemann, Thies (апрель 2003 г.). «Биосинтез и метаболизм циклопропановых колец в природных соединениях». Химические обзоры. 103 (4): 1625–1648. Дои:10.1021 / cr0100188. PMID 12683792.
- ^ Коэльо, П. С .; Brustad, E.M .; Kannan, A .; Арнольд, Ф. Х. (20 декабря 2012 г.). «Циклопропанирование олефинов с помощью переноса карбена, катализируемого инженерными ферментами цитохрома P450» (PDF). Наука. 339 (6117): 307–310. Bibcode:2013Наука ... 339..307C. Дои:10.1126 / science.1231434. PMID 23258409.