Структурный изомер - Structural isomer
Эта статья читается как учебник и может потребовать уборка. Пожалуйста помоги чтобы улучшить эту статью сделать это нейтральный в тон и познакомьтесь с Википедией стандарты качества. (Август 2020 г.) |
В химия, а структурный изомер (или же конституциональный изомер в ИЮПАК номенклатура[1]) из сложный это другое соединение, молекула которого имеет такое же количество атомов каждого элемента, но с логически различными облигации между ними.[2][3] Период, термин метамер ранее использовался для той же концепции.[4]
Например, бутанол ЧАС
3C–(CH
2)
3-ОЙ, метилпропиловый эфир ЧАС
3C–(CH
2)
2–O–CH
3, и диэтиловый эфир (ЧАС
3C–CH
2–)2О иметь то же самое молекулярная формула C
4ЧАС
10О но представляют собой три различных структурных изомера.
Эта концепция применима также к многоатомным ионам с таким же полным зарядом. Классическим примером является цианат ион O = C = N− и греметь ион C−≡N+О−. Он также распространяется на ионные соединения, так что (например) цианат аммония [NH
4]+ [O = C = N]− и мочевина (ЧАС
2N–)2C = O считаются структурными изомерами,[4] и так формиат метиламмония [ЧАС
3C–NH
3]+ [HCO
2]− и ацетат аммония [NH
4]+ [ЧАС
3C–CO
2]−.
Структурная изомерия - наиболее радикальный тип изомерия. Он противостоит стереоизомерия, в котором атомы и схема связи одинаковы, но отличается только относительное пространственное расположение атомов.[5][6] Примерами последних являются энантиомеры, молекулы которых являются зеркальным отображением друг друга, а СНГ и транс версии 2-бутен.
Среди структурных изомеров можно выделить несколько классов, в том числе скелетные изомеры, позиционные изомеры (или же региоизомеры), функциональные изомеры, таутомеры, и структурные топоизомеры.[7]
Скелетная изомерия
А скелетный изомер соединения представляет собой структурный изомер, который отличается от него атомами и связями, которые, как считается, составляют «скелет» молекулы. За органические соединения, Такие как алканы, это обычно означает атомы углерода и связи между ними.
Например, есть три скелетных изомера пентан: п-пентан (часто называемый просто «пентаном»), изопентан (2-метилбутан) и неопентан (диметилпропан).[8]
 |  | |
| п-Пентан | Изопентан | Неопентан |
Если скелет ациклический, как в приведенном выше примере, можно использовать термин цепная изомерия.
Позиционная изомерия (региоизомерия)
Изомеры положения (также позиционные изомеры или же региоизомеры) являются структурными изомерами, которые можно рассматривать как различающиеся только положением функциональная группа, заместитель, или какой-либо другой элемент «родительской» структуры.[9]
Например, замена одного из 12 атомов водорода –H на гидроксил группа –OH на п-пентан Исходная молекула может давать любой из трех различных изомеров положения:
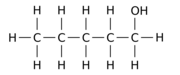 | 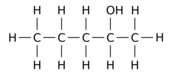 | 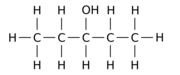 |
| Пентан-1-ол | Пентан-2-ол | Пентан-3-ол |
Функциональная изомерия
Функциональные изомеры структурные изомеры, которые имеют разные функциональные группы, в результате чего химические и физические свойства существенно различаются.[10]
Примером может служить пара пропанал ЧАС3C – CH2–C (= O) -H и ацетон ЧАС3C – C (= O) –CH3: первый имеет функциональную группу –C (= O) H, что делает его альдегид, тогда как второй имеет группу C – C (= O) –C, что делает его кетон.
Другой пример - пара этиловый спирт ЧАС3C – CH2–OH (an алкоголь ) и диметиловый эфир ЧАС3C – O – CH2H (an эфир ). В отличие, 1-пропанол и 2-пропанол являются структурными изомерами, но не функциональными изомерами, поскольку они имеют одну и ту же важную функциональную группу ( гидроксил –ОН) и оба являются спиртами.
Помимо различного химического состава, функциональные изомеры обычно очень разные. инфракрасные спектры. Инфракрасный спектр в значительной степени определяется модами колебаний молекулы, а функциональные группы, такие как гидроксил и сложные эфиры, имеют очень разные моды колебаний. Таким образом, 1-пропанол и 2-пропанол имеют относительно схожие инфракрасные спектры из-за гидроксильной группы, которая значительно отличается от группы метилэтилового эфира.[нужна цитата ]
Структурные изотопомеры
В химии обычно игнорируют различия между изотопы того же элемента. Однако в некоторых ситуациях (например, в Раман, ЯМР, или же микроволновая спектроскопия ) можно рассматривать разные изотопы одного и того же элемента как разные элементы. Во втором случае две молекулы с одинаковым числом атомов каждого изотопа, но с разными схемами связи называются структурные изотопомеры.
Так, например, этен при первой интерпретации не будет иметь структурных изомеров; но заменив два атома водорода (1H) пользователем дейтерий атомы (2H) может давать любой из двух структурных изотопомеров (1,1-дидейтероэтен и 1,2-дидейтероэтен), если оба атома углерода являются одним и тем же изотопом. Если, кроме того, два атома углерода являются разными изотопами (скажем, 12C и 13C), было бы три различных структурных изотопомера, так как 1-13C-1,1-дидейтероэтен будет отличаться от 1-13C-2,2-дидейтероэтен.) И в обоих случаях 1,2-дидейтероструктурный изотопомер может встречаться в виде двух стереоизотопомеров, СНГ и транс.
Структурная эквивалентность и симметрия
Структурная эквивалентность
Один говорит, что две молекулы (включая многоатомные ионы) A и B иметь такую же структуру если каждый атом A может быть спарен с атомом B того же элемента взаимно однозначным образом, так что для каждой связи в A существует связь в B того же типа между соответствующими атомами; наоборот.[3] Это требование распространяется также на сложные связи, которые включают три или более атомов, такие как делокализованная связь в молекуле бензола и других ароматических соединений.
В зависимости от контекста может потребоваться, чтобы каждый атом был спарен с атомом того же изотопа, а не только одного элемента.
Две молекулы тогда можно назвать структурными изомерами (или, если изотопы имеют значение, структурными изотопомерами), если они имеют одинаковую молекулярную формулу, но не имеют одинаковой структуры.
Структурная симметрия и эквивалентные атомы
Структурную симметрию молекулы математически можно определить как перестановка атомов, который обменивается по крайней мере двумя атомами, но не меняет структуру молекулы. Тогда можно сказать, что два атома структурно эквивалент если есть структурная симметрия, которая переводит одно в другое.[11]
Так, например, все четыре атома водорода метан структурно эквивалентны, потому что любая их перестановка сохранит все связи молекулы.
Аналогично, все шесть атомов водорода этан (C
2ЧАС
6) структурно эквивалентны друг другу, как и два атома углерода; потому что любой водород может быть заменен любым другим, либо перестановкой, которая меняет местами только эти два атома, либо перестановкой, которая меняет местами два атома углерода и каждый водород в одной метильной группе с другим водородом на другом метиле. Любая операция сохраняет структуру молекулы. То же самое и с атомами водорода циклопентан, аллен, 2-бутин, гексаметилентетрамин, присмане, кубан, додекаэдран, так далее.
С другой стороны, атомы водорода пропан не все структурно эквивалентны. Шесть атомов водорода, присоединенных к первому и третьему атомам углерода, эквивалентны, как в этане, а два атома, присоединенных к среднему углероду, эквивалентны друг другу; но нет никакого эквивалента между этими двумя классы эквивалентности.
Симметрия и позиционная изомерия
Структурные эквивалентности между атомами исходной молекулы уменьшают количество позиционных изомеров, которые могут быть получены путем замены этих атомов другим элементом или группой. Так, например, структурная эквивалентность шести атомов водорода этан C
2ЧАС
6 означает, что существует только один структурный изомер этиловый спиртCH
5ОЙ, а не 6. Восемь атомов водорода пропан C
3ЧАС
8 подразделяются на два класса структурной эквивалентности (шесть по метильным группам и два по центральному углероду); поэтому существует только два позиционных изомера пропанола (1-пропанол и 2-пропанол ). Точно так же есть только два позиционных изомера бутанол, и три из пентанол или же гексанол.
Нарушение симметрии заменами
Как только в родительской молекуле производится замена, ее структурная симметрия обычно снижается, а это означает, что атомы, которые ранее были эквивалентными, могут перестать быть таковыми. Таким образом, замещение двух или более эквивалентных атомов одним и тем же элементом может дать более одного позиционного изомера.
Классический пример - это производные от бензол. Все его шесть атомов водорода структурно эквивалентны, как и шесть атомов углерода; потому что структура не изменяется, если атомы переставляются способами, которые соответствуют переворачиванию молекулы или ее повороту на кратные 60 градусов. Следовательно, замена любого водорода на хлор дает только один хлорбензол. Однако с этой заменой перестановки атомов, которые переместили этот водород, больше не действительны. Остается только одна перестановка, которая соответствует переворачиванию молекулы с сохранением фиксированного хлора. Затем пять оставшихся атомов водорода попадают в три разных класса эквивалентности: один, противоположный хлору, является отдельным классом (называемым параграф положение), два наиболее близких к хлору образуют другой класс (орто), а оставшиеся два - третий класс (мета). Таким образом, второе замещение водорода хлором может дать три позиционных изомера: 1,2- или орто-, 1,3- или мета-, и 1,4- или параграф-дихлорбензол.
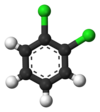 |  | 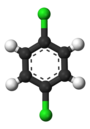 |
| орто-Дихлорбензол | мета-Дихлорбензол | параграф-Дихлорбензол |
| 1,2-дихлорбензол | 1,3-дихлорбензол | 1,4-дихлорбензол |
По той же причине есть только один фенол (гидроксибензол), но три бензендиолы; и один толуол (метилбензол), но три толуолы, и три ксилолы.
С другой стороны, вторая замена (тем же заместителем) может сохранить или даже повысить симметрию молекулы и, таким образом, может сохранить или уменьшить количество классов эквивалентности для следующей замены. Таким образом, четыре оставшихся атома водорода в мета-дихлорбензол по-прежнему делится на три класса, в то время как орто- делятся на два, а те из параграф- снова все равнозначны. Тем не менее, некоторые из этих 3 + 2 + 1 = 6 замен в конечном итоге дают одинаковую структуру, поэтому существует только три структурно различных трихлорбензолы: 1,2,3-, 1,2,4-, и 1,3,5-.
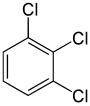 |  | 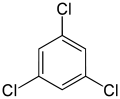 |
| 1,2,3-трихлорбензол | 1,2,4-трихлорбензол | 1,3,5-трихлорбензол |
Если заместители на каждой стадии разные, обычно структурных изомеров будет больше. Ксиленол, который представляет собой бензол с одним гидроксильным заместителем и двумя метильными заместителями, имеет всего 6 изомеров:
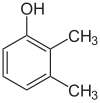 | 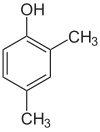 | 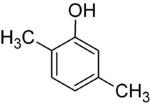 |
| 2,3-ксиленол | 2,4-ксиленол | 2,5-ксиленол |
 |  | 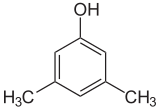 |
| 2,6-ксиленол | 3,4-ксиленол | 3,5-ксиленол |
Подсчет и подсчет изомеров
Подсчет или подсчет структурных изомеров в целом представляет собой сложную задачу, поскольку необходимо учитывать несколько типов связей (включая делокализованные), циклические структуры и структуры, которые невозможно реализовать из-за валентных или геометрических ограничений, а также неразделимые таутомеры.
Например, есть девять структурных изомеров с молекулярной формулой C3ЧАС6О имеющие разные связи. Семь из них устойчивы на воздухе при комнатной температуре, и они приведены в таблице ниже.
| Химическое соединение | Молекулярная структура | Плавление точка (° C) | Кипячение точка (° C) | Комментарий |
|---|---|---|---|---|
| Аллиловый спирт | –129 | 97 | ||
| Циклопропанол | 101–102 | |||
| Пропиональдегид | –81 | 48 | Таутомер с пропен-1-олом, который имеет оба СНГ и транс стереоизомерные изомерные формы | |
| Ацетон | 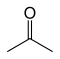 | –94.9 | 56.53 | Таутомера с пропен-2-олом |
| Оксетан | –97 | 48 | ||
| Окись пропилена | –112 | 34 | Имеет два энантиомерные формы | |
| Метилвиниловый эфир | –122 | 6 |
Два структурных изомера - это энол таутомеры карбонильных изомеров (пропиональдегид и ацетон), но они нестабильны.[12]
Смотрите также
Рекомендации
- ^ «Конституционная изомерия». Золотая книга ИЮПАК. ИЮПАК. Получено 19 июля 2018.
- ^ Фредерик А. Беттельхейм, Уильям Х. Браун, Мэри К. Кэмпбелл, Шон О. Фаррелл (2009): Введение в органическую и биохимию. 752 страницы. ISBN 9780495391166
- ^ а б Питер П. Мумба (2018): Полезные принципы химии для студентов, изучающих сельское хозяйство и медсестры, 2-е издание. 281 стр. ISBN 9781618965288
- ^ а б Уильям Ф. Байнум, Э. Джанет Браун, Рой Портер (2014): Словарь истории науки. 530 страниц. ISBN 9781400853410
- ^ Джим Кларк (2000). «Структурная изомерия» в Chemguide, n.l.
- ^ Поппе, Ласло; Надь, Йожеф; Хорнянский, Габор; Борос, Золтан; Михай, Ногради (2016). Стереохимия и стереоселективный синтез: введение. Вайнхайм, Германия: Wiley-VCH. С. 26–27. ISBN 978-3-527-33901-3.
- ^ Д. Бринн Хибберт, A.M. Джеймс (1987): Химический словарь Macmillan. 532 страницы. ISBN 9781349188178
- ^ Зденек Сланина (1986): Современная теория химической изомерии. 254 страницы. ISBN 9789027717078
- ^ Х. Стивен Стокер (2015): Общая, органическая и биологическая химия, 7-е изд. 1232 страницы. ISBN 9781305686182
- ^ Барри Г. Хинвуд (1997): Учебник науки для медицинских работников. 489 страниц. ISBN 9780748733774
- ^ Жан-Лу Фаулон, Андреас Бендер (2010): Справочник по алгоритмам хемоинформатики. 454 страницы. ISBN 9781420082999
- ^ CRC Справочник по химии и физике 65-е изд.
