Аллильная группа - Allyl group
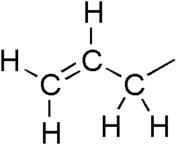
An аллил группа это заместитель со структурной формулой H2С = СН-СН2R, где R - остальная часть молекулы. Он состоит из метиленовый мостик (-CH2-) прикреплен к виниловая группа (-CH = CH2).[1][2] Название происходит от латинского слова для чеснок, Allium sativum. В 1844 г. Теодор Вертхайм выделил аллильное производное из чесночное масло и назвал его «Schwefelallyl».[3][4] Термин аллил применяется ко многим соединениям, связанным с H2С = СН-СН2, некоторые из которых имеют практическое или повседневное значение, например, аллилхлорид.
Номенклатура

Участок, примыкающий к ненасыщенному атому углерода, называется аллильная позиция или же аллильный сайт. Группа, прикрепленная к этому сайту, иногда описывается как аллильный. Таким образом, CH2= CHCH2OH "имеет аллильный гидроксильная группа ". Аллиловый Связи C − H примерно на 15% слабее, чем связи C − H в обычных зр3 углеродные центры и, следовательно, более реактивны. Эта повышенная реактивность имеет множество практических последствий. Промышленное производство акрилонитрил к аммоксидирование из пропен использует легкое окисление аллильных центров C − H:
Ненасыщенные жиры портятся прогоркание включая атаку на аллильные центры C − H.
Бензиловый и аллил связаны с точки зрения структуры, прочности связи и реакционной способности. Другие реакции, которые обычно происходят с аллильными соединениями: аллильные окисления, ее реакции, а Реакция Цудзи-Троста. Бензиловый группы относятся к аллильным группам; оба показывают повышенную реактивность.
Пентадиенил
A CH2 группа, связанная с двумя винильными группами, называется дважды аллильной. В энергия диссоциации связи связей C-H на дважды аллильном центре примерно на 10% меньше, чем энергия диссоциации связи C-H аллильной связи. Ослабленные связи C − H отражают высокую стабильность образующегося пентадиенил радикалы. Соединения, содержащие C = C − CH2−C = C связи, например линолевая кислота производные, склонны к автоокислению, что может привести к полимеризации или образованию полутвердых веществ. Этот образец реактивности является фундаментальным для пленкообразующего поведения "олифы ", которые являются компонентами масляные краски и лаки.
Гомоаллический
Период, термин гомоаллический относится к положению на углеродном скелете рядом с положением аллила. В бут-3-енилхлориде CH2= CHCH2CH2Cl, хлорид является гомоаллильным, потому что он связан с гомоаллильным сайтом.
Склеивание
Аллильная группа широко встречается в органической химии.[1] Аллильный радикалы, анионы, и катионы часто обсуждаются как промежуточные продукты в реакциях. Все они имеют три смежных sp²-гибридных углеродных центра, и все они получают стабильность за счет резонанса.[5] Каждый вид может быть представлен двумя резонансные структуры с зарядом или неспаренным электроном, распределенным в обоих 1,3-положениях.
 Резонансная структура аллильного аниона
Резонансная структура аллильного аниона
С точки зрения Теория МО, то Диаграмма МО имеет три молекулярные орбитали: первая связывающая, вторая несвязывающая, а орбиталь с более высокой энергией - разрыхляющая.[2]
 Диаграмма МО для π-орбиталей на аллильном радикале. Средняя МО помечена Ψ2 одиночно занят в аллильном радикале. В аллильном катионе Ψ2 не занята, а в анионе аллила она занята дважды. Атомы водорода на этом рисунке не показаны.
Диаграмма МО для π-орбиталей на аллильном радикале. Средняя МО помечена Ψ2 одиночно занят в аллильном радикале. В аллильном катионе Ψ2 не занята, а в анионе аллила она занята дважды. Атомы водорода на этом рисунке не показаны.
Аллилирование
Аллилирование - это любая химическая реакция, которая добавляет аллильную группу к субстрат.[1]
Карбонильное аллилирование
Обычно аллилирование относится к добавлению аллильного аниона, эквивалентного органическому электрофил:[6][7] Карбонильное аллилирование это тип органическая реакция в котором активированная аллильная группа добавляется к карбонильная группа производство аллила третичный спирт. Типичное аллилирование альдегида (RCHO) представлено следующим двухэтапным процессом, который начинается с аллилирования с последующим гидролизом промежуточного соединения:
- RCHO + CH2= CHCH2M → CH2= CHCH2RCH (OM)
- CH2= CHCH2RCH (OM) + H2O → CH2= CHCH2RCH (OH) + MOH
Популярным реагентом для асимметричного аллилирования является «реагент Брауна», аллил.диизопинокамфеилборан.[8]
Вступление к аллильный группы в молекулярные структуры создают много возможностей для дальнейшей диверсификации. Распространенным методом введения аллильных фрагментов в органические молекулы является 1,2-аллилирование карбонил группы. Гомоаллиловые спиртовые продукты могут подвергаться различным реакциям, создающим разнообразие, таким как озонолиз, эпоксидирование и метатезис олефинов. Аллилметаллические реагенты, такие как аллилбораны, аллилстаннаны и соединения аллилиндия, обычно используются химиками-органиками для введения аллильных групп.[9]
Аллилстаннаны являются относительно стабильными реагентами в семействе аллилметаллов и используются во множестве сложных органических синтезов. Фактически, добавление аллилстаннана является одним из наиболее распространенных методов получения полипропионатов, полиацетатов и других оксигенированных молекул с непрерывными массивами стереоцентры.[10] Лей и коллеги[11] использовали аллилстаннан для аллилирования альдегида, производного от треозы (см. рисунок), на пути к макролид антаскомицин B, который структурно напоминает FK506 и рапамицин, и является мощным связующим для FKBP12.
Аллилборат также часто используется для добавления 1,2-аллильных групп к альдегидам и кетонам. Благодаря десятилетиям исследований в настоящее время существует широкий спектр борорганический реагенты, доступные химику-синтетику, в том числе органобораны которые предсказуемо дают продукты с высокой диастерео- и энантиоселективностью.[12] Если требуется процедура введения металла и аллилирования в одном сосуде, аллилирование с участием индия является привлекательным вариантом для получения гомоаллильных спиртов непосредственно из аллилгалогенидов и карбонильных соединений. В общем, метод называется Реакция Барбье, и может использовать различные металлы, такие как магний, алюминий, цинк, индий и олово. Реакция часто используется как более мягкая форма Гриньяр реакция присоединения и часто может переносить водные растворители[13]
Сопряженное добавление
Органотанталовые реагенты полезны для сопряженного добавления к Enones.[14] Особый интерес представляет способность некоторых органотанталовых реагентов способствовать конъюгированному аллилированию енонов. Хотя прямое аллилирование карбонильных групп широко распространено в литературе, о конъюгатном аллилировании енонов сообщалось мало.[15] До отчета Шибаты и Бабы существовало только три метода выборочного аллилирования энонов: Хосоми Сакураи реакция (аллилсилан и TiCl4),[16] аллилбариевые реагенты,[17] и реагенты аллилмеди.[18] Трансметаллирование аллилтина, бензилолова, алкинилолова, α-станниловых эфиров и соединений алленилолова с помощью TaCl5 при криогенных температурах эффективно приводили к соответствующим органотанталовым соединениям. Продукты, образованные в результате сопряженного присоединения танталорганических соединений к енонам, показаны ниже.

Аллильные соединения
К аллильной группе могут быть присоединены многие заместители с образованием стабильных соединений. Коммерчески важные аллильные соединения включают:
- Аллиловый спирт (ЧАС2С = СН-СН2ОЙ)
- Аллилхлорид (ЧАС2С = СН-СН2Cl)
- Кротиловый спирт (CH3СН = СН-СН2ОЙ)
- Диметилаллил пирофосфат, центральное место в биосинтезе терпены, предшественник многих натуральных продуктов, в том числе натуральная резина.
- Аллильные комплексы переходных металлов, Такие как димер хлорида аллилпалладия
Смотрите также
- Аллиловый штамм
- Перестановка Кэрролла
- Аллильный палладиевый комплекс
- Реакция Цудзи-Троста
- Пропаргиловый / Гомопропаргиловый
- Бензиловый
- Виниловый
- Ацетиленовая
- Налоксон
- Аллильная перегруппировка
- Diallyllysergamide
- Терпен
Рекомендации
- ^ а б c Джерри Марч, «Продвинутая органическая химия», 4-е изд. Дж. Вили и сыновья, 1992: Нью-Йорк. ISBN 0-471-60180-2.
- ^ а б Органическая химия 4-е изд. Мориссон и Бойд 1988.
- ^ Теодор Вертхайм (1844 г.). "Untersuchung des Knoblauchöls". Annalen der Chemie und Pharmacie. 51 (3): 289–315. Дои:10.1002 / jlac.18440510302.
- ^ Эрик Блок (2010). Чеснок и другие луковые культуры: знания и наука. Королевское химическое общество. ISBN 978-0-85404-190-9.
- ^ Органическая химия Джон Макмерри 2-е изд. 1988 г.
- ^ http://www.chem.umn.edu/groups/harned/classes/8322/lectures/2AllylationReactions.pdf
- ^ С. Э. Дания, Дж. Фу "Каталитическое энантиоселективное добавление аллильных металлоорганических реагентов к альдегидам и кетонам" Chem. Ред., 2003, т. 103, стр. 2763–2794. Дои:10.1021 / cr020050h
- ^ Y. Yamamoto, N. Asao "Селективные реакции с использованием аллильных металлов" Chem. Ред., 1993, т. 93, pp 2207–2293. Дои:10.1021 / cr00022a010
- ^ Юс, М; Gonzalez-Gomez, J.C .; Foubelo, F. Chem. Ред., 2013, 113, 5595–5698
- ^ Keck, G.E .; Dougherty, S.M .; Савин, К. А. J. Am. Chem. Soc. 1995, 117, 6210
- ^ Бриттен, Д. Е. А .; Griffiths-Jones, C.M .; Linder, M. R .; Smith, M.D .; McCusker, C .; Barlow, J. S .; Akiyama, R .; Ясуда, К .; Лей, С. В. Энгью. Chem. Int. Эд. 2005, 44, 2732.
- ^ Юс, М; Gonzalez-Gomez, J.C .; Foubelo, F. Chem. Ред. 2011 г., 111, 7774–7854.
- ^ Shen, Z .; Wang, S .; Chok, Y .; Xu, Y .; Loh, T. Chem. Ред., 2013, 113, 271–401.
- ^ Шибата, Икуя; Кано, Такэёси; Канадзава, Нобуаки; Фукуока, Сёдзи; Баба, Акио (2002-04-15). «Получение органотанталовых реагентов и конъюгатное добавление к энонам». Angewandte Chemie. 114 (8): 1447–1450. Дои:10.1002 / 1521-3773 (20020415) 41: 8 <1389 :: AID-ANIE1389> 3.0.CO; 2-D.
- ^ Ямамото, Ёсинори .; Асао, Наоки. (1993-09-01). «Избирательные реакции с использованием аллильных металлов». Химические обзоры. 93 (6): 2207–2293. Дои:10.1021 / cr00022a010. ISSN 0009-2665.
- ^ Хосоми, Акира; Сакураи, Хидеки (1977-03-01). «Химия кремнийорганических соединений. 99. Сопряженное присоединение аллилсиланов к альфа,бета-еноны. Новый метод стереоселективного введения угловой аллильной группы в конденсированные циклические соединения. альфа,бета-enones ". Журнал Американского химического общества. 99 (5): 1673–1675. Дои:10.1021 / ja00447a080. ISSN 0002-7863.
- ^ Янагисава, Акира; Хабауэ, Шигеки; Ясуэ, Кацутака; Ямамото, Хисаши (1 июля 1994 г.). «Аллилбариевые реагенты: беспрецедентные регио- и стереоселективные реакции аллилирования карбонильных соединений». Журнал Американского химического общества. 116 (14): 6130–6141. Дои:10.1021 / ja00093a010. ISSN 0002-7863.
- ^ Lipshutz, Брюс Х .; Ellsworth, Edmund L .; Димок, Стюарт Х .; Смит, Робин А. Дж. (1990-05-01). «Новая методология конъюгированного добавления аллильных лигандов к & alpha;, & beta; -ненасыщенным кетонам: синтетические и спектроскопические исследования». Журнал Американского химического общества. 112 (11): 4404–4410. Дои:10.1021 / ja00167a043. ISSN 0002-7863.


