Органопалладий - Organopalladium
Органопалладий химия - это отрасль металлоорганическая химия что касается органических палладий соединения и их реакции. Палладий часто используется в качестве катализатора для восстановления алкены и алкины с водород. Этот процесс включает образование палладия на углероде. Ковалентная связь. Палладий также входит в состав углерод-углерод. реакции сочетания, как показано в тандемные реакции.[1]
Хронология химии органопалладия
- 1873 - А. Н. Зайцев сообщает о сокращении бензофенон над палладием с водородом.
- 1894 г. - Филлипс сообщает, что хлорид палладия (II) уменьшает к металлическому палладию при контакте с этилен.[2]
- 1907 - Автоклав технология введена В. Ипатьев позволяет проводить гидрирование под высоким давлением.
- 1956 - В г. Wacker процесс этилен и кислород реагировать на ацетальдегид с катализатором PdCl2/ CuCl2
- 1957 - Малатеста и Анголетта сообщили о тетракис (трифенилфосфин) палладии (0).
- 1972 - Начало Чертовски реакция это реакция сочетания галогенида с олефином. Присутствуют промежуточные соединения Pd (0).
- 1973 - г. Асимметричное аллильное алкилирование Trost это нуклеофильное замещение.
- 1975 - г. Муфта Соногашира представляет собой реакцию сочетания концевых алкинов с арил- или винилгалогенидами.
- 1994 - Pd-катализатор Аминирование Бухвальда-Хартвига для реакций образования связи C-N.

Палладий (II)
Алкеновые комплексы
В отличие от Ni (II), но подобно Pt (II), галогениды Pd (II) образуют множество алкеновых комплексов. Главный пример: дихлор (1,5-циклооктадиен) палладий. В этом комплексе диен легко замещается, что делает его предпочтительным предшественником катализаторов. В промышленно важных Wacker процесс этилен превращается в ацетальдегид посредством нуклеофильной атаки гидроксида на промежуточное соединение Pd (II) -этилен с последующим образованием комплекса винилового спирта. Фуллереновые лиганды также связываются с палладием (II).

Ацетат палладия (II) и родственные соединения являются общими реагентами, поскольку карбоксилаты являются хорошими уходящими группами с основными свойствами. Например, было продемонстрировано, что трифторацетат палладия эффективен в ароматических соединениях. декарбоксилирование:[3]
Аллильные комплексы
Знаковый комплекс в этой серии димер хлорида аллилпалладия (БТР). Аллил соединения с подходящими уходящие группы реагировать с солями палладия (II) с образованием пи-аллильные комплексы имея осязание 3. Эти промежуточные продукты тоже реагируют, например, с нуклеофилами. карбанионы происходит от малонаты [4] или с амины в аллильном аминировании [5] как показано ниже [6]
Промежуточные соединения аллилпалладия также присутствуют в Асимметричное аллильное алкилирование Trost и Перестановка Кэрролла и оксо-вариация в Саэгуса окисление.
Комплексы палладий-углерод с сигма-связью
Различные органические группы могут связываться с палладием и образовывать стабильные сигма-связанные комплексы. Стабильность связей с точки зрения энергии диссоциации связи следует тенденции: Pd-Alkynyl> Pd-Vinyl ≈ Pd-Aryl> Pd-Alkyl, и длина связи металл-углерод изменяется в противоположном направлении: Pd-Alkynyl
Соединения палладия (0)
Zerovalent Соединения Pd (0) включают трис (дибензилиденацетон) дипалладий (0) и тетракис (трифенилфосфин) палладий (0). Эти комплексы реагируют с галокарбон R-X в окислительная добавка к промежуточным соединениям R-Pd-X с ковалентный Связи Pd-C. Эта химия составляет основу большого класса органических реакций, называемых реакции сочетания (видеть реакции сочетания, катализируемые палладием ). Примером может служить Соногашира реакция:
Органопалладий (IV)
Первый органопалладий (IV) соединение было описано в 1986 году. Это комплекс Me3Pd (IV) (I) bpy (bpy = бидентатный 2,2'-бипиридин лиганд)[8] Он был синтезирован окислительным добавлением метилиодид мне2Pd (II) bpy.
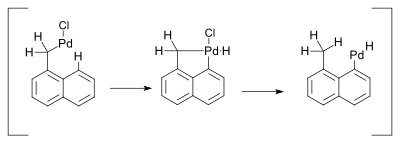
Соединения палладия обязаны своей реакционной способностью легкости взаимного превращения между промежуточными соединениями Pd (0) и палладия (II). Однако нет убедительных доказательств участия превращений Pd (II) в Pd (IV) в металлоорганических реакциях, опосредованных палладием.[9] Одна реакция, вызывающая такой механизм, была описана в 2000 г. и касалась Чертовски реакция. Эта реакция сопровождалась сдвигом 1,5-водорода в присутствии аминов:[10]
Предполагалось, что гидридный сдвиг происходит через Pd (IV) металлоцикл:
В соответствующей работе промежуточным продуктом, связанным с гидридным сдвигом, остается Pd (II):[11]
и в другой работе (новый синтез индолы с двумя миграциями Pd) равновесие постулируются между различными палладациклами:[12][13]
и в некоторых внутримолекулярных связях синтетическая ценность была продемонстрирована независимо от степени окисления:[14]
Рекомендации
- ^ Справочник по химии органопалладия для органического синтеза Эй-Негиси Джон Вайли (2002) ISBN 0-471-31506-0
- ^ Phillips, F.C .; Являюсь. Chem. J. 1894, 16, 255.
- ^ Джошуа С. Дикштейн; Кэрол А. Малруни; Эрин М. О'Брайен; Барбара Дж. Морган и Мариса К. Козловски (2007). «Развитие реакции каталитического ароматического декарбоксилирования». Орг. Lett. 9 (13): 2441–2444. Дои:10.1021 / ol070749f. PMID 17542594.
- ^ Джейн. Бэквалл и Ян О. Вогберг (1993). «Стереоселективные 1,4-функционализации конъюгированных диенов: цис- и транс-1-ацетокси-4- (дикарбометоксиметил) -2-циклогексен». Органический синтез.; Коллективный объем, 8, п. 5
- ^ Игорь Дубовик; Иэн Д. Г. Уотсон и Андрей К. Юдин (2007). "В погоне за протонным виновником от катализируемого палладием аллильного аминирования". Варенье. Chem. Soc. 129 (46): 14172–14173. Дои:10.1021 / ja076659n. PMID 17960935.
- ^ Реагенты: триэтилфосфит лиганд, DBU (как сообщается, поглощает протоны амина, которые в противном случае вызывали бы изомеризацию) в THF
- ^ Анаников В.П. и др., Металлоорганические соединения, 2005, 24, 715. Дои:10.1021 / om0490841
- ^ Питер К. Байерс; Аллан Дж. Кэнти; Брайан В. Скелтон; Аллан Х. Уайт (1986). «Окислительное добавление иодометана к [PdMe2 (bpy)] и рентгеновская структура палладиевого органо (IV) продукта fac- [PdMe3 (bpy) l] (bpy = 2,2-бипиридил)». Chem. Commun. (23): 1722–1724. Дои:10.1039 / C39860001722.
- ^ Антонио Дж. Мота и Ален Дедье (2007). "Внутримолекулярная перегруппировка палладия через пространство в замещенных арильных комплексах: теоретическое исследование процесса миграции арила в алкилпалладий". J. Org. Chem. 72 (25): 9669–9678. Дои:10.1021 / jo701701s. PMID 18001098.
- ^ Ляньшэн Ван; Йи Пан; Синь Цзян; Хунвэнь Ху (2000). «Катализируемая палладием реакция α-хлорметилнафталина с олефинами». Буквы Тетраэдра. 41 (5): 725–727. Дои:10.1016 / S0040-4039 (99) 02154-1.
- ^ Активация C-H и миграция палладия в биарилах в условиях реакции Хека Гюнтер Кариг, Мария-Тереза Мун, Ноппорн Тасана и Тимоти Галлахер Org. Lett., Vol. 4, № 18, 2002 3116 Дои:10.1021 / ol026426v
- ^ Синтез замещенных карбазолов миграцией винила в арилпалладий с участием процессов активации домино C-H Цзянь Чжао и Ричард К. Ларок Орг. Lett., Vol. 7, №4, 701 2005 Дои:10.1021 / ol0474655
- ^ Реагенты: дифенилацетилен, ацетат палладия, бис (дифенилфосфино) метан (dppm) и цезий соль пивалиновая кислота (CsPiv)
- ^ Pd-катализируемый миграция и циклизация алкила в арил: эффективный синтез конденсированных полициклов посредством множественной активации C-H Циньхуа Хуанг, Алессия Фацио, Гуансю Дай, Марино А. Кампо и Ричард К. Ларок ВАРЕНЬЕ. ХИМ. SOC. 2004, 126, 7460-7461 Дои:10.1021 / ja047980y