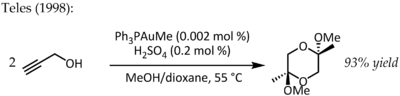Золотоорганическая химия - Organogold chemistry
Золотоорганическая химия это исследование соединений, содержащих золото –углерод облигации. Они изучаются в академических исследованиях, но в остальном не получили широкого распространения. Доминирующий степени окисления для золотоорганических соединений I с координационный номер 2 и а линейная молекулярная геометрия и III с CN = 4 и a квадратная плоская молекулярная геометрия.[1][2][3] Первым обнаруженным золотоорганическим соединением был карбид золота (I) Au2C2, который впервые был изготовлен в 1900 году.[4]
Золото (I)
Комплексы золота (I) двухкоординатные, линейные, диамагнитный, 14 видов электронов.[1][2][3] Обычно они существуют в виде аддуктов LAuR с лигандом L, например трифенилфосфином или изоцианидом. Лиганд предотвращает восстановление Au (I) до металлического Au (0) при димеризации органического остатка. Золото (I) также может существовать как Aurate M [AuR2] ( ел комплекс ), при этом катион обычно снабжен комплексообразующим агентом для улучшения стабильности. AuR2− анион также линейен, как и другие M (d10) такие виды, как Hg (Me)2 и Pd (Me)22+. Известно, что золото образует ацетилиды (способны образовывать полимерные структуры), карбены и карбины[нужна цитата ]. Классический метод получения соединений LAuR - реакция Реактив Гриньяра с галогенидом золота (I). Последующая реакция с литийорганический R-Li образует комплекс ата.
В особой группе соединений арил атом углерода действует как мост между двумя атомами золота. Одно такое соединение, (MesAu)5, образуется в реакции между Au (CO) Cl и мезитил Гриньяр. Углерод может координироваться с золотом до значения 6. Соединения типа C (AuL)4 находятся изолобальный с метаном и типа C (AuL)5+ изолобален с ионом метания. Эти сверхкоординированные кластеры органозолота часто стабилизируются аурофильные взаимодействия между формально закрытыми золотыми центрами.[5]
 Некоторые типичные виды органозолота с различными способами связывания.
Некоторые типичные виды органозолота с различными способами связывания.
Соединения цианида золота (MAu (CN)2) имеют некоторое значение для цианирование золота, процесс извлечения золота из бедной руды. Связь углерода с металлом в цианидах металлов обычно является ионной, но существуют доказательства того, что связь C-Au в ионе цианида золота является ковалентной.[6]
Золото (III)
Комплексы золота (III) четырехкоординатные, квадратно-плоские, диамагнитный, токсичный, 16 видов электронов. Когда формальное координационное число меньше 4, лиганды, такие как хлор, могут восполнить его, образуя мостиковый лиганд. Еще одна стратегия - внутримолекулярное хелатирование. В целом соединения золота (III) токсичны и поэтому менее изучены, чем золото (I). Комплексы моноарилзолота (III) представляют собой один хорошо изученный класс комплексов. Их часто получают путем прямого электрофильного аурирования аренов AuCl.3.[7] Гомолептические тетраалкилауратные (III) комплексы (например, Li [AuMe4]) также хорошо охарактеризованы.[8]
Золотой катализ
Общие Соображения
Катализируемые золотом реакции делятся на две основные категории: гетерогенный катализ включая катализаторы наночастицы золота (например, Au / TiO2) и тиол-монослойные поверхности золота, а также катализаторы на носителе из оксида алюминия, включая Au / CeO на носителе из оксида алюминия.2. Эти катализаторы были исследованы для важных в промышленном отношении процессов, таких как окисление спиртов, окисление монооксида углерода (CO) и различных реакций селективного гидрирования (например, от бутадиена до бутена). Хотя они часто эффективны и демонстрируют полезную или уникальную селективность, существует значительная неопределенность в отношении механизма процессов, катализируемых различными гетерогенными золотыми катализаторами, даже по сравнению с другими гетерогенными катализаторами на основе переходных металлов.
В отличие, гомогенный катализ с золотом использует простые или связанные с лигандом соединения золота (I) или золота (III), которые растворимы в органических растворителях и используются для синтеза тонких химикатов в органической химии.[9][10] Бинарные галогениды золота и простые комплексы, в том числе хлорид золота (I), хлорид золота (III), и хлористоводородная кислота, использовались как комплексы. Эти источники золота, однако, быстро приводят к плохо определенным и легко дезактивируемым (за счет восстановления до Au0) активные катализаторы в растворе. Разработка четко определенных фосфин- или NHC-лигированных комплексов золота (I) была важным достижением и привела к значительному увеличению интереса к синтетическим применениям золотого катализа. Лигированные комплексы золота (I) обычно получают и хранят в виде лабораторно стабильных (но не вступающих в реакцию) хлоридов, LAuCl, например, хлор (трифенилфосфин) золото (I), которые обычно активируются путем отщепления галогенидов солями серебра, такими как AgOTf, AgBF4, или AgSbF6 для получения катионного золота (I).[11][12] Хотя координационно-ненасыщенный комплекс «LAu+"Это умозрительно генерируются из смеси LAuCl / AgX, точный характер катионных частиц золота и роль соли серебра остается несколько спорными.[13][14][15] В параграф-нитробензоат, бистрифлимид и некоторые нитрильные комплексы представляют собой каталитически активные, но не содержащие серебра предварительные катализаторы.
Катионное золото (I) образует π-комплексы с алкен или же алкин облигации, следуя Модель Дьюара – Чатта – Дункансона. Золото, безусловно, не единственный металл, демонстрирующий такой тип связи и реакционную способность, ионы нескольких металлов изолобальный с простым протоном (т.е. пустой s-орбиталью) тоже: например, ртуть (II) и платина (II). Электрофильные ионы и подобные комплексы с сильной склонностью к образованию π-комплексов обычно известны как пи (π) -кислоты (смотрите также: катион-пи взаимодействие ).[16]
Комплексы золота (I) -алкена и -алкина представляют собой электрофильный и восприимчивы к нуклеофильной атаке. В оксимеркурация полученные ртутьорганические соединения образуются стехиометрически и требуют дополнительной стадии для высвобождения продукта. В случае золота протонолиз связи Au-C замыкает каталитический цикл, обеспечивая координацию другого субстрата. Некоторые практические преимущества катализа золота (I) включают: 1) стабильность на воздухе (из-за высокого окислительного потенциала Au (I)), 2) устойчивость к посторонней влаге (из-за его низкой оксофильности) и 3) относительно низкую токсичность по сравнению с другие пи-кислоты (например, Pt (II) и Hg (II)). Химически комплексы Au (I) обычно не подвергаются окислению до более высоких степеней окисления, а Au (I) -алкилы и -винилы не чувствительны к отщеплению β-гидрида.[17]
 Типичный механизм катализируемой золотом (I) гидрофункционализации алкинов и алленов.
Типичный механизм катализируемой золотом (I) гидрофункционализации алкинов и алленов.
Историческое развитие
В 1976 году Томас и его коллеги сообщили о преобразовании фенилацетилен к ацетофенон с помощью тетрахлорозавровая кислота с доходностью 37%.[18] В этой реакции золото (III) использовалось в качестве гомогенного катализатора, заменяющего ртуть в оксимеркурации. В этом же исследовании указан опубликованный выход> 150%, что указывает на катализ, который, возможно, не был признан химиками.
В 1991 году Утимото прореагировал на золото (III) (NaAuCl4) с алкинами и водой.[19] Телес выявил главный недостаток этого метода, поскольку Au (III) быстро восстанавливается до каталитически мертвого металлического золота, и в 1998 году вернулся к теме Au (I) на лигандной основе для того же преобразования:[20]
Эта конкретная реакция продемонстрировала фантастическую каталитическую эффективность и спровоцировала шквал исследований по использованию комплексов фосфинзолота (I) для активации кратных связей C-C в ближайшие годы.[21] Несмотря на меньшую стабильность комплексов золота (III) в каталитических условиях, простой AuCl3 также было обнаружено, что в некоторых случаях он является эффективным катализатором. Например, Хашми сообщил о AuCl3-катализированный алкин / фуран Реакция Дильса – Альдера - тип циклоприсоединения, который обычно не происходит - для синтеза 2,3-дизамещенных фенолы:[22]
Дальнейшие механистические исследования пришли к выводу, что это не согласованная трансформация, а скорее начальное гидроарилирование алкина, за которым следует серия неочевидных внутримолекулярных перегруппировок, завершающихся электроциклизацией и реоматизацией 6π.
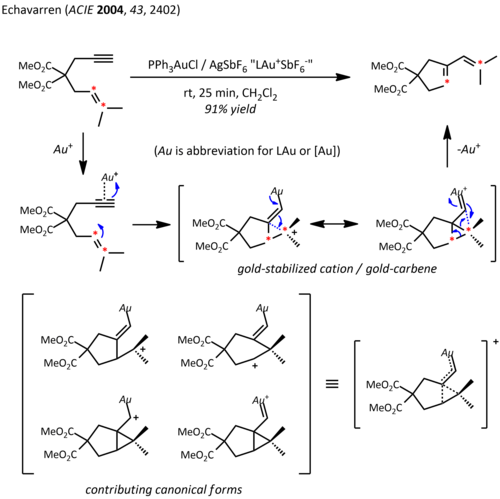
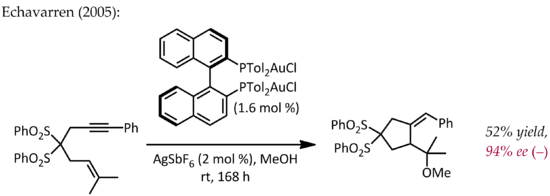
Релятивистские эффекты имеют важное значение в химии золота из-за большого ядерного заряда металла (Z = 79). Как следствие релятивистски разложенного 5d орбитали, фрагмент LAu может стабилизировать соседний карбокатион за счет донорства электронов в пустой п-типа орбитальный. Таким образом, в дополнение к их ожидаемой реакционной способности, подобной карбокатиону, эти катионы также проявляют значительный карбеновый характер, свойство, которое использовалось в каталитических превращениях, таких как циклопропанирование и внедрение C-H.[23] Сложные эфиры пропаргила могут служить предшественниками катионных промежуточных соединений золото-винилкарбен, которые могут взаимодействовать с алкенами согласованным образом с образованием продукта циклопропанирования. Использование хирального лиганда ((р) -DTBM-SEGPHOS ) приводили к уровню энантиоселективности от хорошего до отличного.[24]

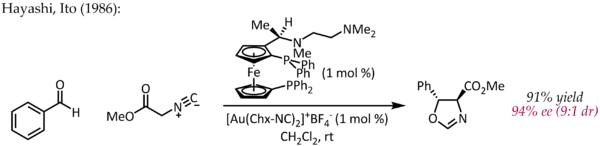
Хотя Эчаваррен впервые сообщил о получении хиральных комплексов бисфосфиндиголда (I) для энантиоселективного золотого катализа, протекающего по типичному механизму пи-активации,[25] Ранний атипичный пример энантиоселективного катализа золотом был описан Хаяши и Ито в 1986 году.[26] В этом процессе бензальдегид и метилизоцианоацетат подвергаются циклизации в присутствии хиральный ферроценилфосфиновый лиганд и комплекс бис (изоцианид) золота (I) с образованием хирального оксазолин. Поскольку оксазолины можно гидролизовать с получением 1,2-аминоспирта, эта реакция представляет собой первый пример каталитической реакции. асимметричный альдольная реакция.
В отличие от других реакций, описанных выше, эта реакция не включает активацию двойной или тройной связи C-C золотом. В простой механистической картине золото (I) одновременно координируется с двумя фосфиновыми лигандами и изоцианатной группой углерода. [27] который затем подвергается атаке карбонильной группы. Дальнейшие исследования способа связывания Au (I) показывают, что эту простую картину, возможно, придется пересмотреть.
Гетерогенный золотой катализ это более старая наука. Золото - привлекательный металл для использования, например, благодаря его устойчивости к окислению и разнообразию морфологии. золотой кластер материалы. Было показано, что золото эффективно при низкотемпературном окислении CO и гидрохлорировании ацетилена до винилхлоридов. Точная природа каталитического центра в этом типе процесса обсуждается.[28] Представление о том, что золото может катализировать реакцию, не означает, что это единственный способ. Однако другие металлы могут выполнять ту же работу с меньшими затратами, особенно в последние годы железо (см. железоорганическая химия ).
Катализируемые золотом реакции
Хотя золото не имеет коммерческого значения, оно катализирует многие органические превращения, обычно образование углерод-углеродной связи из Au (I) и образование связи CX (X = O, N) из состояния Au (III) из-за более жесткой кислотности Льюиса этого иона. . В течение последнего десятилетия несколько исследований продемонстрировали, что золото может эффективно катализировать реакции кросс-сочетания C-C и C-гетероатомов, которые протекают через цикл Au (I) / Au (III).[29] Хун С. Шен суммировал гомогенные реакции с образованием циклических соединений на 4 основные категории:[30]
- гетероатом нуклеофильное присоединение с ненасыщенными связями C-C, особенно с образованием небольших гетероциклов (фураны, пирролы, тиофены)
- Гидроарилирование: в основном Реакция Фриделя-Крафтса с использованием металлоалкиновых комплексов. Например, реакция мезитилен с фенилацетилен:[31]
- Циклизация Энин, в частности циклоизомеризация, одним из ранних примеров является циклоизомеризация 5-экзо-диг 1,6 енина:[32]
- реакции циклоприсоединения с ранним примером циклоприсоединение оксид нитрила с алкином.[33]
Другие реакции - использование золота в Активация связи C – H[34] и альдольные реакции. Золото также катализирует реакции сочетания.[35]
Ограничения
Катализируемая золотом гидрофункционализация алкинов, алленов и аллиловых спиртов[36] легко возникает в сравнительно мягких условиях, неактивированный алкен в большинстве случаев остается плохим субстратом,[37] в значительной степени из-за устойчивости промежуточных комплексов алкилзолота (I) к протодеаурации.[38] Развитие межмолекулярных превращений, катализируемых золотом, также отстает от развития внутримолекулярных.[39]
Рекомендации
- ^ а б Эльшенбройх К. и Зальцер А. (1992) Металлоорганические соединения: краткое введение. Wiley-VCH: Вайнхайм. ISBN 3-527-28165-7
- ^ а б Пэриш, Р. В. (1997). «Химия органозолота: II реакции». Золотой бюллетень. 30 (2): 55–62. Дои:10.1007 / BF03214757.
- ^ а б Пэриш, Р. В. (1998). «Химия золотоорганического происхождения: III приложения». Золотой бюллетень. 31: 14–21. Дои:10.1007 / BF03215470.
- ^ Мэтьюз, Дж. А .; Уоттерс, Л. Л. (2002-05-01). "Карбид золота". Журнал Американского химического общества. 22 (2): 108–111. Дои:10.1021 / ja02040a010.
- ^ Шмидбаур, Хуберт; Шиер, Аннет (2011-12-05). «Аурофильные взаимодействия как предмет текущих исследований: обновление». Обзоры химического общества. 41 (1): 370–412. Дои:10.1039 / C1CS15182G. ISSN 1460-4744. PMID 21863191.
- ^ Wang, X. B .; Wang, Y. L .; Yang, J .; Xing, X. P .; Li, J .; Ван, Л. С. (2009). «Доказательства значительного ковалентного связывания в Au (CN)»2−". Журнал Американского химического общества. 131 (45): 16368–70. Дои:10.1021 / ja908106e. PMID 19860420.
- ^ Kharasch, M. S .; Исбелл, Гораций С. (1931-08-01). «Химия органических соединений золота. III. Прямое введение золота в ароматическое ядро (предварительное сообщение)». Журнал Американского химического общества. 53 (8): 3053–3059. Дои:10.1021 / ja01359a030. ISSN 0002-7863.
- ^ Райс, Гэри У .; Тобиас, Р. Стюарт. (1975-10-01). «Синтез тетраметилаурата (III). Структуры диметилаурата лития и тетраметилаурата лития в растворе». Неорганическая химия. 14 (10): 2402–2407. Дои:10.1021 / ic50152a020. ISSN 0020-1669.
- ^ Золотой катализ для органического синтеза Ф. Дин Тосте (редактор) Тематическая серия в открытом доступе Журнал органической химии Бейльштейна
- ^ Raubenheimer, H.G .; Шмидбаур, Х. (2014). «Поздний старт и поразительный подъем в химии золота». Журнал химического образования. 91 (12): 2024–2036. Bibcode:2014JChEd..91.2024R. Дои:10.1021 / ed400782p.
- ^ Раньери, Беатрис; Эскофет, Имма; Эчаваррен, Антонио М. (24.06.2015). «Анатомия золотых катализаторов: факты и мифы». Орг. Biomol. Chem. 13 (26): 7103–7118. Дои:10.1039 / c5ob00736d. ISSN 1477-0539. ЧВК 4479959. PMID 26055272.
- ^ Ван, И-Мин; Lackner, Aaron D .; Тосте, Ф. Дин (14 ноября 2013 г.). «Разработка катализаторов и лигандов для энантиоселективного золотого катализа». Отчеты о химических исследованиях. 47 (3): 889–901. Дои:10.1021 / ar400188g. ЧВК 3960333. PMID 24228794.
- ^ Жданко Александр; Майер, Мартин Э. (09.09.2015). «Объяснение« серебряных эффектов »в катализируемом золотом (I) гидроалкоксилировании алкинов». Катализ ACS. 5 (10): 5994–6004. Дои:10.1021 / acscatal.5b01493.
- ^ Хомс, Анна; Эскофет, Имма; Эчаваррен, Антонио М. (2013). "Об эффекте серебра и образовании комплексов дигольда с хлоридными мостиковыми связями". Органические буквы. 15 (22): 5782–5785. Дои:10.1021 / ol402825v. ЧВК 3833279. PMID 24195441.
- ^ Ван, Давэй; Цай, Ронг; Шарма, Шрипад; Джирак, Джеймс; Thummanapelli, Sravan K .; Ахмедов, Новруз Г .; Чжан, Хуэй; Лю, Синбо; Петерсен, Джеффри Л. (18 мая 2012 г.). ""Серебряный эффект "в катализе золота (I): упущенный важный фактор". Журнал Американского химического общества. 134 (21): 9012–9019. Дои:10.1021 / ja303862z. PMID 22563621.
- ^ Fürstner, A .; Дэвис, П. В. (2007). «Каталитическая карбофильная активация: катализ π-кислотами платины и золота». Angewandte Chemie International Edition. 46 (19): 3410–3449. Дои:10.1002 / anie.200604335. PMID 17427893.
- ^ Шен, Х.С. (2008). «Последние достижения в синтезе гетероциклов и карбоциклов с помощью гомогенного золотого катализа. Часть 1: реакции присоединения гетероатомов и гидроарилирования алкинов, алленов и алкенов». Тетраэдр. 64 (18): 3885–3903. Дои:10.1016 / j.tet.2008.01.081.
- ^ Norman, R.O.C .; Parr, W. J. E .; Томас, К. Б. (1976). «Реакции алкинов, циклопропанов и производных бензола с золотом (III)». Журнал химического общества, Perkin Transactions 1 (18): 1983. Дои:10.1039 / P19760001983.
- ^ Fukuda, Y .; Утимото, К. (1991). «Эффективное превращение неактивированных алкинов в кетоны или ацетали с катализатором золота (III)». Журнал органической химии. 56 (11): 3729–3731. Дои:10.1021 / jo00011a058.
- ^ Teles, J. H .; Brode, S .; Чабанас, М. (1998). «Катионные комплексы золота (I): высокоэффективные катализаторы для добавления спиртов к алкинам». Angewandte Chemie International Edition. 37 (10): 1415–1418. Дои:10.1002 / (SICI) 1521-3773 (19980605) 37:10 <1415 :: AID-ANIE1415> 3.0.CO; 2-N. PMID 29710887.
- ^ Наджент, В. А. (2012). ""События Черного лебедя "в органическом синтезе". Angewandte Chemie International Edition. 51 (36): 8936–49. Дои:10.1002 / anie.201202348. PMID 22893229.
- ^ Hashmi, A. S. K .; Фрост, Т. М .; Летучие мыши, Дж. У. (2000). «Высокоселективный синтез арена, катализируемый золотом». Журнал Американского химического общества. 122 (46): 11553–11554. Дои:10.1021 / ja005570d.
- ^ Горин, Дэвид Дж .; Тосте, Ф. Дин (2007). «Релятивистские эффекты в гомогенном золотом катализе». Природа. 446 (7134): 395–403. Bibcode:2007Натура.446..395G. Дои:10.1038 / природа05592. PMID 17377576.
- ^ Йоханссон, Магнус Дж .; Горин, Дэвид Дж .; Стабен, Стивен Т .; Тосте, Ф. Дин (30 ноября 2005 г.). «Катализируемое золотом (I) стереоселективное циклопропанирование олефинов». Журнал Американского химического общества. 127 (51): 18002–18003. Дои:10.1021 / ja0552500. PMID 16366541.
- ^ Муньос, М. Пас; Адрио, Хавьер; Карретеро, Хуан Карлос; Эчаваррен, Антонио М. (12 февраля 2005 г.). "Эффекты лиганда в катализируемой золотом и платиной циклизации енинов: хиральные комплексы золота для энантиоселективной алкоксициклизации". Металлоорганические соединения. 24 (6): 1293–1300. Дои:10.1021 / om0491645.
- ^ Ито, Й .; Sawamura, M .; Хаяси, Т. (1986). «Каталитическая асимметричная альдольная реакция: реакция альдегидов с изоцианоацетатом, катализируемая хиральным комплексом ферроценилфосфин-золото (I)». Журнал Американского химического общества. 108 (20): 6405–6406. Дои:10.1021 / ja00280a056.
- ^ Togni, A .; Пастор, С. Д. (1990). «Хиральная кооперативность: природа диастереоселективной и энантиоселективной стадии в катализируемой золотом (I) альдольной реакции с использованием хиральных ферроцениламиновых лигандов». Журнал органической химии. 55 (5): 1649–1664. Дои:10.1021 / jo00292a046.
- ^ Hutchings, G.J .; Brust, M .; Шмидбаур, Х. (2008). «Золото - вводная перспектива». Обзоры химического общества. 37 (9): 1759–65. Дои:10.1039 / b810747p. PMID 18762825.
- ^ Nijamudheen, A .; Датта, Аян (2020). «Катализируемые золотом реакции перекрестной связи: обзор стратегий проектирования, механистических исследований и приложений». Химия: европейский журнал. 26: 1442–1487. Дои:10.1002 / chem.201903377. Cite имеет пустой неизвестный параметр:
|1=(помощь) - ^ Шен, Х.С. (2008). "Последние достижения в синтезе карбоциклов и гетероциклов посредством гомогенного золотого катализа. Часть 2: Циклизации и циклоприсоединения". Тетраэдр. 64 (34): 7847–7870. Дои:10.1016 / j.tet.2008.05.082.
- ^ Reetz, M. T .; Соммер, К. (2003). «Катализируемое золотом гидроарилирование алкинов». Европейский журнал органической химии. 2003 (18): 3485–3496. Дои:10.1002 / ejoc.200300260.
- ^ Nieto-Oberhuber, C .; Muñoz, M. P .; Buñuel, E .; Nevado, C .; Cárdenas, D. J .; Эчаваррен, А. М. (2004). «Катионные комплексы золота (I): высокоалкинофильные катализаторы экзоандендоциклизации энинов». Angewandte Chemie International Edition. 43 (18): 2402–2406. Дои:10.1002 / anie.200353207. PMID 15114573.
- ^ Gasparrini, F .; Giovannoli, M .; Misiti, D .; Natile, G .; Palmieri, G .; Мареска, Л. (1993). «Катализируемый золотом (III) однореакторный синтез изоксазолов из концевых алкинов и азотной кислоты». Журнал Американского химического общества. 115 (10): 4401–4402. Дои:10.1021 / ja00063a084.
- ^ Hoffmann-Röder, A .; Краузе, Н. (2005). «Золотые ворота к катализу». Органическая и биомолекулярная химия. 3 (3): 387–91. Дои:10.1039 / b416516k. PMID 15678171.
- ^ Wegner, H.A .; Аузиас, М. (2011). "Золото для реакций сочетания C-C: катализатор швейцарского армейского ножа?" Angewandte Chemie International Edition. 50 (36): 8236–47. Дои:10.1002 / anie.201101603. PMID 21818831.
- ^ Бандини, Марко (01.02.2011). «Аллиловые спирты: устойчивые источники для каталитических энантиоселективных реакций алкилирования». Angewandte Chemie International Edition. 50 (5): 994–995. Дои:10.1002 / anie.201006522. ISSN 1521-3773. PMID 21268189.
- ^ Чжан, Чжибин; Ли, Сон Ду; Виденхофер, Росс А. (22 апреля 2009 г.). «Межмолекулярное гидроаминирование этилена и 1-алкенов циклическими мочевинами, катализируемое ахиральными и хиральными комплексами золота (I)». Журнал Американского химического общества. 131 (15): 5372–5373. Дои:10.1021 / ja9001162. ISSN 0002-7863. ЧВК 2891684. PMID 19326908.
- ^ LaLonde, Rebecca L .; Младший, Уильям Э. Брензович; Бенитес, Диего; Ткачук, Екатерина; Келли, Котаро; III, Уильям А. Годдард; Тосте, Ф. Дин (2010). «Комплексы алкилзолота путем внутримолекулярной аминоаурации неактивированных алкенов». Химическая наука. 1 (2): 226. Дои:10.1039 / C0SC00255K. ЧВК 3866133. PMID 24358445.
- ^ Мураторе, Майкл Э .; Хомс, Анна; Обрадорс, Карла; Эчаваррен, Антонио М. (01.11.2014). "Решение проблемы межмолекулярных золотых (I) -катализируемых циклоприсоединений алкинов и алленов". Химия: азиатский журнал. 9 (11): 3066–3082. Дои:10.1002 / asia.201402395. ISSN 1861-471X. ЧВК 4676923. PMID 25048645.