Гетерогенный золотой катализ - Heterogeneous gold catalysis

Гетерогенный золотой катализ относится к катализ химических реакций золота, обычно нанесенных на подложки из оксида металла. Несмотря на хорошо известную инертность массивного золота, уменьшение диаметра поддерживаемых кластеров золота до c. 2-5 нм обеспечивают высокую каталитическую активность по отношению к низким температурам монооксид углерода (CO) окисление. Также наблюдается несколько других промышленно значимых реакций, таких как H2 активация, сдвиг водяного газа, и гидрирование.[1][2][3]
Было высказано предположение, что высокая активность кластеров золота на подложке является результатом сочетания структурных изменений, квантово-размерных эффектов и эффектов поддержки, которые предпочтительно настраивают электронная структура золота, так что обеспечивается оптимальное связывание адсорбатов во время каталитического цикла.[2][3][4] Селективность и активность наночастиц золота можно точно настроить, варьируя выбор материала носителя, например, титания (TiO2), гематит (α-Fe2О3), оксид кобальта (II / III) (Со3О4) и оксид никеля (II) (NiO), служащий наиболее эффективными вспомогательными материалами для облегчения катализа горения CO.[1] Помимо обеспечения оптимального диспергирования нанокластеров, материалы носителя были предложены для ускорения катализа за счет изменения размера, формы, деформации и зарядового состояния кластера.[3][5][6] Было показано, что точный контроль формы осажденных кластеров золота важен для оптимизации каталитической активности, поскольку полусферические наночастицы толщиной в несколько атомных слоев обычно демонстрируют наиболее желательные каталитические свойства благодаря максимальному количеству высокоэнергетических краевых и угловых центров.[1][4][7]
Предлагаемые приложения
В прошлом гетерогенные золотые катализаторы находили коммерческое применение для промышленного производства поливинил хлорид (ПВХ), метилметакрилат, и каталитические преобразователи.[8] Традиционно при производстве ПВХ используются ртутные катализаторы, что вызывает серьезные экологические проблемы. На Китай приходится 50% мировых выбросов ртути, а 60% выбросов ртути в Китае вызвано производством ПВХ. Хотя золотые катализаторы немного дороги, общая стоимость производства составляет всего ~ 1%. Таким образом, катализ зеленым золотом считается ценным. Колебания цен на золото позже привели к прекращению операций, связанных с его использованием в каталитических нейтрализаторах. Совсем недавно было много разработок в области золотого катализа для синтеза органических молекул, включая реакции гомосочетания или кросс-сочетания, образующие связь C-C, и было высказано предположение, что некоторые из этих катализаторов могут найти применение в различных областях.[9]
Окисление CO
Золото может быть очень активным катализатором окисления монооксид углерода (CO), т.е. реакция CO с молекулярный кислород производить углекислый газ (CO2). Поддерживаемое золото кластеры, тонкие пленки и наночастицы на один-два порядка активнее, чем атомно-дисперсное золото катионы или неподдерживаемый металлический золото.[2]
Катионы золота могут быть распределены атомарно на подложках из основных оксидов металлов, таких как MgO и Ла2О3. Моновалентный идентифицированы трехвалентные катионы золота, причем последние более активны, но менее стабильны, чем первые. В частота оборота (TOF) окисления CO на этих катионных золотых катализаторах составляет порядка 0,01 с.−1, демонстрируя очень высокие энергия активации 138 кДж / моль.[2]
Нанокластеры золота на носителе диаметром <2 нм активны по отношению к окислению CO с числом оборотов (TOF) порядка 0,1 с.−1. Было замечено, что кластеры от 8 до 100 атомов являются каталитически активными. Причина в том, что, с одной стороны, восемь атомов - это минимум, необходимый для образования стабильной дискретной структура энергетических зон, а с другой стороны, расщепление d-зоны уменьшается в кластерах с числом атомов более 100, напоминая объемную электронную структуру. Носитель оказывает существенное влияние на электронную структуру кластеров золота. Носители из гидроксидов металлов, такие как Будь (ОН)2, Mg (OH)2, и Ла (ОН)3, с кластерами золота диаметром <1,5 нм являются высокоактивными катализаторами окисления CO при 200 K (-73 ° C). С помощью таких методов, как HR-TEM и EXAFS, было доказано, что активность этих катализаторов обусловлена исключительно кластерами с 13 атомами, расположенными в структуре икосаэдра. Кроме того, для активности катализаторов содержание металла должно превышать 10 мас.%.[2]
Наночастицы золота размером от 2 до 5 нм катализируют окисление CO с TOF около 1 с.−1 при температуре ниже 273 К (0 ° С). Каталитическая активность наночастиц достигается в отсутствие влаги, когда носитель полупроводниковый или же сводимый, например TiO2, MnO2, Fe2О3, ZnO, ZrO2, или же Исполнительный директор2. Однако, когда опора является изолирующей или невосстанавливаемой, например Al2О3 и SiO2, для работы при комнатной температуре требуется уровень влажности> 5000 ppm. В случае порошковых катализаторов, полученных мокрым способом, поверхность OH− группы на носителе обеспечивают достаточную поддержку в качестве сокатализаторов, так что дополнительная влажность не требуется. При температуре выше 333 К (60 ° C) вода не требуется.[2]
Очевидное энергия активации окисления CO на нанесенных катализаторах из золотого порошка, приготовленных мокрыми методами, составляет 2-3 кДж / моль выше 333 K (60 ° C) и 26-34 кДж / моль ниже 333 K. Эти энергии низки по сравнению со значениями, показанными другими катализаторы из благородных металлов (80-120 кДж / моль). Изменение энергии активации при 333 K можно объяснить изменением механизма реакции. Это объяснение было подтверждено экспериментально. При 400 К (127 ° C) скорость реакции на атом Au на поверхности не зависит от диаметра частицы, но скорость реакции на атом Au по периметру прямо пропорциональна диаметру частицы. Это говорит о том, что выше 333 К механизм имеет место на золотых поверхностях. Напротив, при 300 К (27 ° C) скорость реакции, приходящаяся на поверхностный атом Au, обратно пропорциональна диаметру частицы, в то время как скорость реакции на границе раздела периметра не зависит от размера частицы. Следовательно, окисление СО происходит по периметру при комнатной температуре. Дальнейшая информация о механизме реакции была обнаружена путем изучения зависимости скорость реакции на парциальные давления реактивных частиц. Как при 300 К, так и при 400 К наблюдается первый заказ зависимость скорости от парциального давления CO до 4 Торр (533 Па), выше которого реакция нулевого порядка. Что касается O2, реакция нулевой порядок выше 10 Торр (54,7 кПа) как при 300, так и при 400 К. Порядок по O2 при более низких парциальных давлениях составляет 1 при 300 К и 0,5 при 400 К. Сдвиг в сторону нулевого порядка указывает на то, что активные центры катализатора насыщены рассматриваемыми частицами. Следовательно, a Langmuir-Hinshelwood Был предложен механизм, согласно которому СО, адсорбированный на поверхности золота, реагирует с О, адсорбированным на краевых участках наночастиц золота.[2]
Необходимость использования оксидных носителей и, в частности, восстанавливаемых носителей, обусловлена их способностью активировать дикислород. Наночастицы золота, нанесенные на инертные материалы, такие как углерод или полимеры, оказались неактивными в окислении CO. Вышеупомянутая зависимость некоторых катализаторов от воды или влаги также связана с активацией кислорода. Способность некоторых восстанавливаемых оксидов, таких как MnO2, Co3О4, и NiO для активации кислорода в сухих условиях (<0,1 ppm H2O) можно объяснить образованием кислородных дефектов во время предварительной обработки.[2]
Смена водяного газа
Смена водяного газа это самый распространенный промышленный процесс производства дигидроген, H2. Он включает реакцию окиси углерода и воды (синтез-газ ) с образованием водорода и диоксида углерода в качестве побочных продуктов. Во многих схемах каталитических реакций одна из элементарные реакции окисление CO с адсорбированный формы кислорода. Золотые катализаторы были предложены в качестве альтернативы сдвигу водяного газа при низких температурах, а именно. <523 К (250 ° С). Эта технология необходима для развития твердооксидные топливные элементы. Было обнаружено, что гематит является подходящим носителем катализатора для этой цели. Кроме того, биметаллический Au-RU / Fe2О3 Катализатор доказал свою высокую активность и стабильность при низкотемпературной конверсии водяного газа. Титания и церия также использовались в качестве носителей для эффективных катализаторов. К сожалению, Au /Исполнительный директор2 склонен к дезактивации из-за поверхностного карбонат или же форматировать разновидность.[11]
Хотя золотые катализаторы активны при комнатной температуре по отношению к окислению CO, большое количество воды, участвующей в сдвиге водяного газа, требует более высоких температур. При таких температурах золото полностью восстанавливается до металлической формы. Однако активность, например, Au / CeO2 был усилен CN− обработка, при которой металлическое золото выщелачивается, оставляя высокоактивные катионы. В соответствии с DFT Согласно расчетам, присутствие таких катионов Au на катализаторе допускается пустыми, локализованными несвязывающими f-состояниями в CeO2. С другой стороны, КОРЕНЬ исследования Au / CeO2 выявили наночастицы диаметром 3 нм. Было высказано предположение, что сдвиг водяного газа происходит на границе раздела наночастиц Au и восстановленного CeO.2 поддерживать.[11]
Эпоксидирования
Хотя эпоксидирование этилен обычно достигается в промышленности с селективностью до 90% на Ag катализаторы, большинство катализаторов содержат <10% избирательность для эпоксидирования пропилена. Использование золотого катализатора на силикате титана-1 (TS-1) молекулярная решетка, дает 350 г / ч на грамм золота были получены при 473 К (200 ° C). Реакция протекала в газовой фазе. Кроме того, используя мезопористый титаносиликатные опоры (Ti-MCM -41 и Ti-MCM -48), золотые катализаторы обеспечивали селективность> 90% при ~ 7% пропилена преобразование, 40% H2 КПД и 433 К (160 ° С). Активные частицы в этих катализаторах были идентифицированы как полусферические нанокристаллы золота диаметром менее 2 нм, находящиеся в тесном контакте с носителем.[11]
Эпоксидирование алкенов было продемонстрировано в отсутствие H2 восстановитель в жидкой фазе. Например, используя 1% Au /графит, ~ 80% селективности цис-циклооктен в оксид циклооктена (аналог оксид циклогексена ) были получены при конверсии 7-8%, температуре 353 K (80 ° C) и давлении 3 МПа.2 в отсутствие водорода или растворителя.[11] Другие жидкофазные селективные окисления были достигнуты с насыщенными углеводородами. Например, циклогексан был преобразован в циклогексанон и циклогексанол с комбинированной селективностью ~ 100% по золотым катализаторам. Селективность продукта можно регулировать в жидкофазных реакциях присутствием или отсутствием растворителя и природой последнего, а именно. воды, полярный, или же неполярный. В случае золотых катализаторов носитель катализатора меньше влияет на реакции в жидкой фазе, чем на реакции в газовой фазе.[12]
Селективное гидрирование
Типичные катализаторы гидрирования основаны на металлах из 8, 9, и 10 группы, такие как Ni, RU, Pd, и Pt. Для сравнения, золото имеет низкую каталитическую активность при гидрировании.[13] Эта низкая активность вызвана трудностью дигидроген активация на золото. В то время как водород диссоциирует на Pd и Pt без энергетический барьер, диссоциация на Au (111 ) имеет энергетический барьер ~ 1,3 эВ, в соответствии с DFT расчеты. Эти расчеты согласуются с экспериментальными исследованиями, в которых диссоциация водорода на золоте не наблюдалась (111 ) или же (110 ) террасы, ни на (331 ) шаги. На этих поверхностях не наблюдалось диссоциации ни при комнатной температуре, ни при 473 К (200 ° C). Однако для наночастиц Au скорость активации водорода увеличивается.[2] Несмотря на свою низкую активность, наноразмерное золото, иммобилизованное на различных носителях, оказалось хорошим избирательность в реакциях гидрирования.[13]

Одно из первых исследований (1966 г.) гидрирования нанесенного высокодисперсного золота было выполнено с использованием 1-бутен и циклогексен в газовой фазе при 383 К (110 ° С). В скорость реакции оказался первый заказ с учетом давления алкена и второго порядка относительно хемосорбированный водород. В более поздних работах было показано, что катализируемое золотом гидрирование может быть очень чувствительным к загрузке Au (следовательно, к размеру частиц) и к природе носителя. Например, 1-пентен гидрирование оптимально происходило на 0,04 мас.% Au /SiO2, но не на Au /γ-Al2О3.[11] Напротив, гидрирование 1,3-бутадиен к 1-бутен было показано, что он относительно нечувствителен к размеру частиц Au в исследовании с серией Au / Al2О3 катализаторы приготовлены разными способами. Для всех протестированных катализаторов конверсия составила ~ 100%, а селективность - <60%.[13] Что касается механизмов реакции, при изучении пропилен гидрирование на Au / SiO2, скорость реакции были определены с использованием D2 и H2. Потому что реакция с дейтерий был существенно медленнее, предполагалось, что этап определения ставки при гидрировании алкена происходит разрыв связи H-H. Наконец, этилен гидрирование изучено на Au /MgO при атмосферном давлении и 353 К (80 ° C) с EXAFS, КСАНЕС и ИК спектроскопия, предполагая, что активные частицы могут быть Au+3 и промежуточный продукт реакции, разновидность этилзолота.[11]
Золотые катализаторы особенно селективный при гидрировании α, β-ненасыщенных альдегидов, т.е. альдегиды содержащий C = C двойная связь на углероде, прилегающем к карбонил. Золотые катализаторы способны гидрировать только карбонильную группу, так что альдегид превращается в соответствующий алкоголь, оставляя нетронутой двойную связь C = C. При гидрировании кротоновый альдегид к кротиловый спирт, Селективность 80% достигается при конверсии 5-10% и 523 К (250 ° C) по Au /ZrO2 и Au /ZnO. Селективность возрастала с увеличением размера частиц Au в диапазоне от ~ 2 до ~ 5 нм. Другие примеры этой реакции включают: акролеин, цитраль, бензал ацетон, и пент-3-ан-2-он. Активность и селективность золотых катализаторов этой реакции связана с морфологией наночастиц, на которую, в свою очередь, влияет носитель. Например, круглые частицы имеют тенденцию образовываться на TiO2, пока ZnO способствует частицам с четкими гранями, как это наблюдается ТЕМ. Поскольку круглая морфология обеспечивает более высокое относительное количество низко-согласованный участки поверхности металла, более высокая активность наблюдается с Au / TiO2 по сравнению с Au / ZnO. Наконец, биметаллический Au-В Катализатор / ZnO улучшает селективность гидрирования карбонила в акролеине. Это наблюдалось в HRTEM изображения, которые индий тонкие пленки украсить некоторые грани золотой наночастицы. Эффект продвижения на селективность может быть результатом того факта, что только сайты Au, которые продвигают побочные реакции украшены В.[11]
Стратегия, которая во многих реакциях позволила улучшить каталитическую активность золота без снижения его селективности, заключается в синтезе биметаллических Pd -Au или Pt -Au катализаторы. Для гидрирования 1,3-бутадиен к бутены, модельные поверхности Au (111 ), Pd-Au (111 ), Pd-Au (110 ) и Pd (111 ) изучались с LEED, AES, и LEIS. На Pd достигнута селективность ~ 100%.70Au30(111 ), и было высказано предположение, что Au может способствовать десорбции продукта во время реакции. Второй пример - гидрирование п-хлорнитробензол к п-хлоранилин, в котором селективность страдает от типичных катализаторов гидрирования из-за параллельно гидродехлорирование до анилин. Однако Pd-Au / Al2О3 (Au / Pd ≥20) было доказано в три раза более активным, чем чистый катализатор Au, при этом он был ~ 100% селективен к п-хлоранилин. При механистическом исследовании гидрирования нитробензолов с помощью Pt-Au / TiO2, диссоциация H2 был идентифицирован как регулирование скорости, следовательно, включение Pt, эффективного металла для гидрогенизации, значительно улучшило каталитическую активность. Дигидроген диссоциировал на Pt, и нитроароматическое соединение было активировано на Au-TiO2 интерфейс. Наконец, гидрирование стало возможным благодаря распространение активированных поверхностных частиц H от Pt к поверхности Au.[13][14]
Теоретические основы
Известно, что объемное металлическое золото инертно, проявляя поверхностную реакционную способность при комнатной температуре только по отношению к нескольким веществам, таким как муравьиная кислота и серосодержащие соединения, например ЧАС2S и тиолы.[1] В рамках гетерогенного катализа реагенты адсорбировать на поверхность катализатора, образуя активированные промежуточные соединения. Однако, если адсорбция слабая, как в случае массивного золота, не происходит достаточного возмущения электронной структуры реагента и затрудняется катализ (Принцип сабатье ). Когда золото наносят в виде наноразмерных кластеров размером менее 5 нм на подложки из оксидов металлов, наблюдается заметно усиленное взаимодействие с адсорбатами, что приводит к неожиданной каталитической активности. Очевидно, что наноразмерное масштабирование и диспергирование золота на подложках из оксидов металлов делают золото менее благородным за счет настройки его электронной структуры, но точные механизмы, лежащие в основе этого явления, пока не определены и поэтому широко изучены.[3][12][15]
Общеизвестно, что уменьшение размера металлических частиц в некотором измерении до нанометрового масштаба приведет к образованию кластеров со значительно более дискретной структурой. электронная зонная структура по сравнению с сыпучим материалом.[7] Это пример квантово-размерного эффекта, который ранее коррелировал с повышенной реакционной способностью, позволяющей наночастицам более прочно связывать молекулы газовой фазы. В случае TiO2наночастицы золота на подложке, Valden и другие.[2] заметил открытие запрещенная зона приблизительно 0,2-0,6 эВ в электронной структуре золота по мере того, как толщина осажденных частиц уменьшалась ниже трех атомных слоев. Было также показано, что двухслойные толстые кластеры золота на подложке являются исключительно активными для горения CO, на основании чего был сделан вывод, что квантово-размерные эффекты, вызывающие переход металл-изолятор, играют ключевую роль в улучшении каталитических свойств золота. Однако, как сообщалось, дальнейшее уменьшение размера до одного атомного слоя и диаметра менее 3 нм снова снижает активность. Позже это было объяснено дестабилизацией кластеров, состоящих из очень небольшого количества атомов, что привело к слишком сильному связыванию адсорбатов и, таким образом, к отравлению катализатора.[3][6]
Свойства металлической d-полосы являются центральными для описания происхождения каталитической активности, основанной на электронных эффектах.[16] Согласно модели гетерогенного катализа с d-полосой, связи субстрат-адсорбат образуются, когда дискретные уровни энергии молекулы адсорбата взаимодействуют с d-полосой металла, образуя связывающие и разрыхляющие орбитали. Прочность образованной связи зависит от положения центра d-полосы, так что d-полоса ближе к Уровень Ферми () приведет к более сильному взаимодействию. Центр объемного золота в d-полосе расположен намного ниже , что качественно объясняет наблюдаемое слабое связывание адсорбатов, поскольку как связывающие, так и разрыхляющие орбитали, образованные при адсорбции, будут заняты, что приведет к отсутствию чистого связывания.[16] Однако по мере того, как размер кластеров золота уменьшается ниже 5 нм, было показано, что центр d-зоны золота смещается в область энергий, близких к уровню Ферми, так что сформированная разрыхляющая орбиталь будет сдвинута до энергии выше , следовательно, уменьшая его наполнение.[17][18] Помимо смещения центра d-полосы кластеров золота, размерная зависимость ширины d-полосы, а также спин-орбитальное расщепление был изучен с точки зрения каталитической активности.[19] По мере того, как размер кластеров золота уменьшается ниже 150 атомов (диаметр примерно 2,5 нм), оба значения быстро падают. Это может быть связано с сужением d-зоны из-за уменьшения числа гибридизующихся валентных состояний малых кластеров, а также с увеличением отношения высокоэнергетических краевых атомов с низкой координацией к общему числу атомов Au. Эффект уменьшенного спин-орбитальное расщепление, а также более узкое распределение состояний d-зоны на каталитические свойства кластеров золота нельзя понять с помощью простых качественных аргументов, как в случае модели центра d-зоны. Тем не менее, наблюдаемые тенденции являются дополнительным доказательством того, что при наномасштабировании происходит значительное возмущение электронной структуры Au, которое, вероятно, играет ключевую роль в усилении каталитических свойств наночастиц золота.
Центральный структурный аргумент, объясняющий высокую активность кластеров золота, нанесенных на оксид металла, основан на концепции периферийных сайтов, образующихся на стыке между кластером золота и подложкой.[1][2] В случае окисления CO было высказано предположение, что CO адсорбируется на краях и углах кластеров золота, в то время как активация кислорода происходит на периферийных участках. Высокую активность краевых и угловых узлов в отношении адсорбции можно понять, рассматривая высокую координационную ненасыщенность этих атомов по сравнению с атомами террасы. Низкая степень координации увеличивает поверхностная энергия угловых и краевых участков, что делает их более активными в отношении связывания адсорбатов. Это дополнительно связано с локальным сдвигом центра d-зоны ненасыщенных атомов Au в сторону энергий, близких к уровню Ферми, что в соответствии с моделью d-зоны приводит к усилению взаимодействия субстрат-адсорбат и снижению адсорбции-диссоциации. энергетические барьеры.[16][19] Лопес и другие.[17] рассчитали энергию адсорбции CO и O2 на Au (111 ) террасы, на которой атомы Au имеют координационное число 9, а также на Au10 кластер, где наиболее реактивные центры имеют координацию 4. Они отметили, что прочность связи в целом увеличивается на целых 1 эВ, что указывает на значительную активацию в направлении окисления CO, если предположить, что активационные барьеры поверхностных реакций линейно масштабируются с увеличением энергии адсорбции (Принцип Бренстеда-Эванса-Поланьи ). Наблюдение, что полусферические двухслойные кластеры золота с диаметром в несколько нанометров наиболее активны для окисления CO, хорошо согласуется с предположением, что краевые и угловые атомы служат активными центрами, поскольку для кластеров такой формы и размера соотношение краевых атомов к общему количеству атомов действительно максимально.[7]
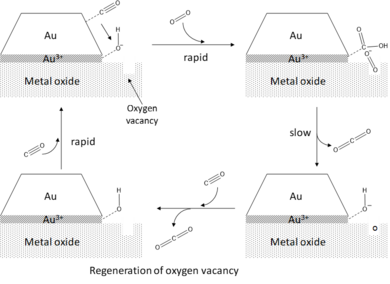
Преимущественная активация O2 на участках периметра является примером поддерживающего эффекта, который способствует каталитической активности наночастиц золота. Помимо обеспечения надлежащего диспергирования осажденных частиц и, следовательно, высокого отношения поверхности к объему, подложка из оксида металла также непосредственно нарушает электронную структуру осажденных кластеров золота посредством различных механизмов, включая создание деформации и перенос заряда. Для золота, депонированного на магнезия (MgO), перенос заряда от однозарядного кислорода свободные места (F-центры) на поверхности MgO к кластеру Au.[6] Этот перенос заряда вызывает локальное возмущение в электронной структуре кластеров золота на узлах периметра, позволяя формировать резонансные состояния как разрыхляющие орбиталь кислорода взаимодействует с металлической d-полосой. Поскольку разрыхляющая орбиталь занята, связь O-O значительно ослабляется и растягивается, т.е. активируется. Активация O2 по периметру наблюдается также для бездефектных поверхностей и нейтральных кластеров золота, но в значительно меньшей степени. Эффект повышения активности переноса заряда от подложки к золоту также был описан Ченом и Гудманом.[5] в случае золотого бислоя на ультратонком TiO2 на Пн (112 ). В дополнение к переносу заряда между подложкой и наночастицами золота, материал носителя, как было обнаружено, увеличивает каталитическую активность золота, вызывая деформацию как следствие несоответствия решеток.[7] Наведенные деформации особенно влияют на атомы Au вблизи границы раздела подложка-кластер, что приводит к смещению локального центра d-зоны в сторону энергий, близких к уровню Ферми. Это подтверждает гипотезу периферии и создание каталитически активных бифункциональных сайтов на интерфейсе кластера-опора.[3] Кроме того, взаимодействие подложки и кластера напрямую влияет на размер и форму нанесенных наночастиц золота. В случае слабого взаимодействия образуются менее активные 3D-кластеры, тогда как при более сильном взаимодействии образуются более активные 2D-многослойные структуры. Это иллюстрирует возможность точной настройки каталитической активности кластеров золота путем изменения материала подложки, а также металла, на котором она была выращена.[6][18]
Наконец, было обнаружено, что каталитическая активность нанесенных кластеров золота по отношению к окислению CO дополнительно усиливается присутствием воды.[2] Ссылаясь на гипотезу периферии, вода способствует активации O2 путем соадсорбции на участках периметра, где он реагирует с O2 образовывать адсорбированный гидроксил (OH *) и гидропероксо (OOH *). Реакция этих промежуточных продуктов с адсорбированным CO происходит очень быстро и приводит к эффективному образованию CO.2 с сопутствующим восстановлением молекулы воды.[6]
Смотрите также
Рекомендации
- ^ а б c d е Харута, Масатаке (1997). «Зависимость от размера и опоры в катализе золота». Катализ сегодня. 36 (1): 153–166. Дои:10.1016 / s0920-5861 (96) 00208-8.
- ^ а б c d е ж грамм час я j k л Харута, Масатаке (04.10.2011). «Лекция в память о Спайерсе: Роль границ раздела периметра в катализе наночастицами золота». Фарадеевские дискуссии. 152: 11–32, обсуждение 99–120. Bibcode:2011FaDi..152 ... 11H. Дои:10.1039 / c1fd00107h. ISSN 1364-5498. PMID 22455036.
- ^ а б c d е ж ван Сантен, Рутгер Энтони; Neurock, Мэтью (2006). Молекулярно-гетерогенный катализ. Концептуальный и вычислительный подход. Вайнхайм, Германия: Wiley-VCH. С. 53–60. ISBN 978-3-527-29662-0.
- ^ а б Valden, M .; Lai, X .; Гудман, Д. У. (11 сентября 1998 г.). «Начало каталитической активности кластеров золота на Титании с появлением неметаллических свойств». Наука. 281 (5383): 1647–1650. Bibcode:1998Sci ... 281.1647V. Дои:10.1126 / science.281.5383.1647. ISSN 0036-8075. PMID 9733505.
- ^ а б Chen, M. S .; Гудман, Д. В. (2004-10-08). «Структура каталитически активного золота на Титании». Наука. 306 (5694): 252–255. Bibcode:2004Наука ... 306..252C. Дои:10.1126 / science.1102420. ISSN 0036-8075. PMID 15331772.
- ^ а б c d е Ландман, Узи; Юн, Боквон; Чжан, Чун; Хейз, Ули; Аренц, Матиас (01.06.2007). «Факторы нанокатализа золота: окисление CO в режиме немасштабируемого размера». Темы в катализе. 44 (1–2): 145–158. CiteSeerX 10.1.1.459.9120. Дои:10.1007 / s11244-007-0288-6. ISSN 1022-5528.
- ^ а б c d Маврикакис, М .; Stoltze, P .; Нёрсков, Дж. К. (2000-02-01). «Сделать золото менее благородным». Письма о катализе. 64 (2–4): 101–106. Дои:10.1023 / А: 1019028229377. ISSN 1011-372X.
- ^ Цириминна, Розария; Фаллетта, Эрмелинда; Делла Пина, Кристина; Телес, Хоаким Энрике; Пальяро, Марио (2016). «Промышленное применение золотого катализа». Angewandte Chemie International Edition. 55 (46): 1433–7851. Дои:10.1002 / anie.201604656.
- ^ Nijamudheen, A .; Датта, Аян (2020). «Катализируемые золотом реакции перекрестной связи: обзор стратегий проектирования, механистических исследований и приложений». Химия: европейский журнал. 26: 1442–1487. Дои:10.1002 / chem.201903377. Cite имеет пустой неизвестный параметр:
|1=(помощь) - ^ Харута, Масатаке (2011). «Лекция в память о Спайерсе: Роль границ раздела периметра в катализе наночастицами золота». Фарадеевские дискуссии. 152: 11–32, обсуждение 99–120. Bibcode:2011FaDi..152 ... 11H. Дои:10.1039 / c1fd00107h. ISSN 1359-6640. PMID 22455036.
- ^ а б c d е ж грамм Хашми, А. Стивен К .; Хатчингс, Грэм Дж. (04 декабря 2006 г.). «Золотой катализ». Angewandte Chemie International Edition. 45 (47): 7896–7936. Дои:10.1002 / anie.200602454. ISSN 1521-3773. PMID 17131371.
- ^ а б Харута, Масатаке (октябрь 2005 г.). "Золотая лихорадка". Природа. 437 (7062): 1098–1099. Дои:10.1038 / 4371098a. ISSN 1476-4687. PMID 16237427.
- ^ а б c d Чжан, Ян; Цуй, Синьцзян; Ши, Фэн; Дэн Юцюань (11 апреля 2012 г.). «Нано-золотой катализ в тонком химическом синтезе». Химические обзоры. 112 (4): 2467–2505. Дои:10.1021 / cr200260m. ISSN 0009-2665. PMID 22112240.
- ^ а б Серна, Педро; Консепсьон, Патрисия; Корма, Авелино (01.07.2009). «Разработка высокоактивных и хемоселективных биметаллических катализаторов гидрирования золота и платины с помощью кинетических и изотопных исследований». Журнал катализа. 265 (1): 19–25. Дои:10.1016 / j.jcat.2009.04.004. ISSN 0021-9517.
- ^ Тернер, Марк; Головко, Владимир Б .; Vaughan, Owain P.H .; Абдулкин, Павел; Беренгер-Мерсия, Ангел; Тихов, Минчо С .; Джонсон, Брайан Ф. Г .; Ламберт, Ричард М. (август 2008 г.). «Селективное окисление кислородом с помощью катализаторов наночастиц золота, полученных из кластеров из 55 атомов». Природа. 454 (7207): 981–983. Bibcode:2008Натура.454..981Т. Дои:10.1038 / природа07194. ISSN 1476-4687. PMID 18719586.
- ^ а б c Молоток, В .; Норсков, Дж. К. (июль 1995 г.). «Почему золото - благороднейший из всех металлов». Природа. 376 (6537): 238–240. Bibcode:1995Натура 376..238H. Дои:10.1038 / 376238a0. ISSN 1476-4687.
- ^ а б Лопес, Н. (2004). «О происхождении каталитической активности наночастиц золота при низкотемпературном окислении СО». Журнал катализа. 223 (1): 232–235. Дои:10.1016 / j.jcat.2004.01.001.
- ^ а б Jiang, T .; Моубрей, Д. Дж .; Добрин, С .; Falsig, H .; Hvolbk, B .; Bligaard, T .; Нёрсков, Дж. К. (18.06.2009). «Тенденции в скорости окисления CO для металлических наночастиц и плотноупакованных, ступенчатых и изогнутых поверхностей». Журнал физической химии C. 113 (24): 10548–10553. Дои:10.1021 / jp811185g. ISSN 1932-7447.
- ^ а б Висиковский, Антон; Мацумото, Хисаси; Мицухара, Кей; Накада, Тоситака; Акита, Томоки; Кидо, Ёсиаки (2011). «Электронные свойства d-полосы нанокластеров золота, выращенных на аморфном углероде». Физический обзор B. 83 (16): 165428. Bibcode:2011ПхРвБ..83п5428В. Дои:10.1103 / Physrevb.83.165428.



