Катион – пи взаимодействие - Cation–pi interaction
Катион – π взаимодействие это нековалентный молекулярное взаимодействие между лицом богатого электронами π система (например. бензол, этилен, ацетилен ) и соседний катион (например, Ли+, Na+). Это взаимодействие является примером нековалентной связи между монополем (катионом) и квадруполь (система π). Энергии связи значительны, при этом значения фазы раствора попадают в тот же порядок величины, что и водородные связи и соляные мосты. Подобно этим другим нековалентным связям, взаимодействия катион – π играют важную роль в природе, особенно в структура белка, молекулярное распознавание и ферментативный катализ. Эффект также наблюдался и использовался в синтетических системах.[1][2]

Происхождение эффекта
Бензол, модельная π-система не имеет постоянного дипольный момент, поскольку вклады слабополярных связей углерод – водород сокращаются за счет молекулярная симметрия. Однако богатая электронами π-система выше и ниже бензольного кольца несет частичный отрицательный заряд. Уравновешивающий положительный заряд связан с плоскостью атомов бензола, в результате чего электрический квадруполь (пара диполей, выровненных как параллелограмм, так что суммарный молекулярный дипольный момент отсутствует). Отрицательно заряженная область квадруполя может тогда благоприятно взаимодействовать с положительно заряженными частицами; особенно сильный эффект наблюдается с катионами высокой плотность заряда.[2]
Природа взаимодействия катион – π
Наиболее изученные взаимодействия катион – π включают связывание между ароматный π-систему и щелочной металл или же азотистый катион. Оптимальная геометрия взаимодействия размещает катион в ван-дер-ваальсовом контакте с ароматическим кольцом, центрированным на вершине π-грани вдоль 6-кратной оси.[3] Исследования показали, что электростатика доминирует во взаимодействиях в простых системах, а относительные энергии связи хорошо коррелируют с электростатическая потенциальная энергия.[4][5]
Электростатическая модель, разработанная Догерти и коллеги описывают тенденции в энергии связи, основанные на различиях в электростатическом притяжении. Было обнаружено, что энергии взаимодействия пар катион – π хорошо коррелируют с электростатическим потенциалом над π-гранью аренов: для одиннадцати Na+-ароматических аддуктов, изменение энергии связи между различными аддуктами может быть полностью объяснено электростатическими различиями. Практически это позволяет качественно прогнозировать тенденции на основе визуальных представлений карты электростатического потенциала для серии арен. Электростатическое притяжение - не единственный компонент связи катион – π. Например, 1,3,5-трифторбензол взаимодействует с катионами, несмотря на пренебрежимо малый квадрупольный момент. Несмотря на то, что присутствуют неэлектростатические силы, эти компоненты остаются похожими в широком спектре аренов, что делает электростатическую модель полезным инструментом для прогнозирования относительных энергий связи. Другие «эффекты», способствующие связыванию, изучены недостаточно. Поляризация, донор-акцептор[постоянная мертвая ссылка ] и передача заряда вовлечены взаимодействия; однако энергетические тенденции плохо соотносятся со способностью аренов и катионов использовать эти эффекты. Например, если индуцированный диполь был контролирующим эффектом, алифатический такие соединения, как циклогексан должны быть хорошие π-партнеры по катиону (но это не так).[4]
Катион-π-взаимодействие нековалентно и поэтому принципиально отличается от связывания между переходные металлы и π-системы. Переходные металлы обладают способностью делить электронную плотность с π-системами через d-орбитали, создавая облигации, которые ковалентный по характеру и не может быть смоделирована как взаимодействие катион – π.
Факторы, влияющие на прочность связи катион – π
Несколько критериев влияют на прочность связи: природа катиона, сольватация эффекты, природа π-системы и геометрия взаимодействия.
Природа катиона
Из электростатика (Закон Кулона ), более мелкие и более положительно заряженные катионы приводят к большему электростатическому притяжению. Поскольку взаимодействия катион – π предсказываются электростатикой, отсюда следует, что катионы с большей плотностью заряда сильнее взаимодействуют с π-системами.
В следующей таблице показан ряд Свободная энергия Гиббса связывания бензола с несколькими катионами в газовой фазе.[2][6] Для однозарядной частицы энергия газофазного взаимодействия коррелирует с величиной ионный радиус, (несферические ионные радиусы являются приблизительными).[7][8]
M+ Ли+ Na+ K+ NH4+ Руб.+ NMe4+ –ΔG [ккал / моль] 38 27 19 19 16 9 [Å] 0.76 1.02 1.38 1.43 1.52 2.45
Эта тенденция поддерживает идею о том, что кулоновские силы играют центральную роль в силе взаимодействия, поскольку для других типов связи можно ожидать, что более крупные и более поляризуемые ионы будут иметь более высокие энергии связи.
Эффекты сольватации
Природа растворитель также определяет абсолютную и относительную прочность соединения. Большинство данных о взаимодействии катион – π получено в газовая фаза, так как притяжение в этом случае наиболее ярко выражено. Любая промежуточная молекула растворителя ослабит эффект, потому что энергия, полученная за счет взаимодействия катион-π, частично компенсируется потерей энергии сольватации.
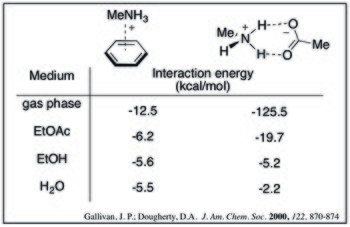
Для данного аддукта катион – π энергия взаимодействия уменьшается с увеличением полярность растворителя. Это можно увидеть из следующих расчетных энергий взаимодействия метиламмония и бензола в различных растворителях.[9]

Кроме того, компромисс между сольватацией и эффектом катион-π приводит к изменению порядка силы взаимодействия для ряда катионов. В то время как в газовой фазе наиболее плотно заряженные катионы имеют самое сильное взаимодействие катион – π, эти ионы также имеют высокий штраф за десольватацию. Это демонстрируется относительной силой связи катион – π в воде для щелочных металлов:[10]
Природа π-системы
Квадрупольный момент
Сравнение квадрупольного момента различных аренов является полезным качественным инструментом для прогнозирования тенденций в связывании катион-π, поскольку оно примерно коррелирует с силой взаимодействия. Арены с большими квадрупольными моментами обычно лучше связывают катионы.
Однако квадрупольный ион модельная система не может использоваться для количественного моделирования катион-π-взаимодействий. Такие модели предполагают точечные сборы, и поэтому не действительны при коротком расстоянии катион – π связь. Чтобы использовать электростатику для прогнозирования энергий, необходимо рассматривать всю поверхность электростатического потенциала, а не только квадрупольный момент как точечный заряд.[2]
Заместители в ароматическом кольце

Электронные свойства заместители также влияют на силу влечения.[11] Электронно-выводные группы (Например, циано −CN) ослабляют взаимодействие, а электронодонорные заместители (например, амино -NH2) усиливают связь катион – π. Эта взаимосвязь количественно проиллюстрирована на марже для нескольких заместителей.
Электронные тренды энергии связи катион – π не совсем аналогичны тенденциям реакционной способности арила. В самом деле, эффект участия заместителя в резонансе не вносит существенного вклада в связывание катион-π, несмотря на то, что он очень важен во многих химических реакциях с аренами. Это было показано наблюдением, что сила взаимодействия катион – π для различных замещенных аренов коррелирует с величиной σмета Параметр Хаммета. Этот параметр предназначен для иллюстрации индуктивные эффекты из функциональные группы на арильном кольце.[4]
Происхождение эффектов заместителя во взаимодействиях катион – π часто объясняется поляризацией из-за отдачи или удаления электронов в или из π-системы.[12] Это объяснение имеет интуитивный смысл, но последующие исследования показали, что оно ошибочно. Недавние вычислительные работы Уиллера и Хоука убедительно показывают, что этот эффект в первую очередь обусловлен прямым взаимодействием в пространстве между катионом и диполем-заместителем. В этом исследовании расчеты, моделирующие незамещенный бензол плюс взаимодействие с молекулой «H-X», расположенной там, где должен быть заместитель (с поправкой на лишние атомы водорода), составили почти всю тенденцию связывания катион-π. Для очень сильных доноров или акцепторов пи эта модель не могла полностью учесть все взаимодействие; в этих случаях поляризация может быть более значительным фактором.[5]
Связывание с гетероароматическими системами
Гетероциклы часто активируются в направлении связывания катион-π, когда неподеленная пара на гетероатоме включена в ароматическую систему (например, индол, пиррол ). И наоборот, когда неподеленная пара не способствует ароматичности (например, пиридин ), электроотрицательность гетероатома побеждает и ослабляет связывающую способность катион-π.
Поскольку несколько классически «богатых электронами» гетероциклов являются плохими донорами, когда дело доходит до связывания катион-π, нельзя предсказать тенденции катион-π на основе тенденций реакционной способности гетероцикла. К счастью, вышеупомянутые тонкости проявляются в электростатических потенциальных поверхностях соответствующих гетероциклов.[2]

взаимодействие катион-гетероцикл не всегда является взаимодействием катион-π; в некоторых случаях более выгодно, чтобы ион был связан непосредственно с неподеленной парой. Например, считается, что это имеет место в случае пиридин-Na+ комплексы.
Геометрия
катион-π-взаимодействия имеют приблизительную зависимость от расстояния 1 / rп где n <2. Взаимодействие менее чувствительно к расстоянию, чем простое ион-квадрупольное взаимодействие, которое имеет 1 / r3 зависимость.[13]
Исследование, проведенное Шериллом и соавторами, дополнительно исследовало геометрию взаимодействия, подтвердив, что взаимодействия катион – π наиболее сильны, когда катион расположен перпендикулярно плоскости атомов (θ = 0 градусов на изображении ниже). Отклонения от этой геометрии все еще демонстрируют значительное взаимодействие, которое ослабевает, когда угол θ приближается к 90 градусам. Для внеосевых взаимодействий предпочтительный ϕ помещает катион между двумя атомами H. Расстояние между равновесными связями также увеличивается с увеличением внеосевого угла. Энергии, при которых катион компланарен углеродному кольцу, равны седловые точки на поверхность потенциальной энергии, что согласуется с идеей о том, что взаимодействие между катионом и положительной областью квадруполя не является идеальным.[14]

Относительная сила взаимодействия
В водный среды, взаимодействие катион-π сравнимо (и потенциально сильнее) с карбоксилатом аммония соляные мосты. Расчетные значения, приведенные ниже, показывают, что с увеличением полярности растворителя сила комплекса катион-π уменьшается менее резко. Эта тенденция может быть объяснена эффектами десольватации: образование солевого мостика имеет высокий штраф десольватации для обоих заряженных частиц, тогда как комплекс катион-π будет платить только значительный штраф за катион.[9]
В природе
Строительные блоки природы содержат в большом количестве ароматические составляющие. Недавно стало ясно, что многие структурные особенности, которые когда-то считались чисто гидрофобный в природе фактически вступают в взаимодействия катион – π. В аминокислота боковые цепи фенилаланин, триптофан, тирозин, гистидин, способны связываться с катионными частицами, такими как заряженные боковые цепи аминокислот, ионы металлов, низкомолекулярные нейротрансмиттеры и фармацевтические агенты. Фактически, макромолекулярный сайты связывания, которые, как предполагалось, включают анионные группы (на основе сродства к катионам), во многих случаях, как было обнаружено, состоят из ароматических остатков. Катион-π-взаимодействия могут настраивать pKa азотистых боковых цепей, увеличивающих количество протонированной формы; это имеет значение для белок структура и функции.[15] Хотя в этом контексте менее изучены, Основания ДНК также могут участвовать в катион-π-взаимодействиях.[16][17]
Роль в структуре белка
Ранние свидетельства того, что взаимодействия катион – π играют роль в структура белка было наблюдение, что в кристаллографических данных ароматические боковые цепи появляются в тесном контакте с азотсодержащими боковыми цепями (которые могут существовать в виде протонированных катионных частиц) с непропорциональной частотой.
В исследовании, опубликованном в 1986 г. Берли и Петско, изучался разнообразный набор белков и было обнаружено, что ~ 50% ароматических остатков Phe, Tyr и Trp находятся в пределах 6 Å от аминогрупп. Кроме того, примерно 25% азотсодержащих боковых цепей Lys, Asn, Gln и His находились в ван-дер-ваальсовом контакте с ароматическими соединениями, а 50% Arg контактировали с множеством ароматических остатков (в среднем 2).[18]
Исследования более крупных наборов данных выявили аналогичные тенденции, в том числе несколько впечатляющих наборов чередующихся стопок катионных и ароматических боковых цепей. В некоторых случаях атомы водорода N-H были выровнены по ароматическим остаткам, а в других катионный фрагмент был расположен выше π-системы. Особенно сильная тенденция была обнаружена для тесных контактов между Arg и Trp. В частности, гуанидиниевый фрагмент Arg имеет высокую склонность к наложению на ароматические остатки, а также к образованию водородных связей с соседними атомами кислорода.[19][20][21]
Молекулярное распознавание и передача сигналов

Пример взаимодействия катион – π в молекулярном распознавании представлен в никотиновый рецептор ацетилхолина (nAChR), который связывает его эндогенные лиганд, ацетилхолин (положительно заряженная молекула) через взаимодействие катион – π с четвертичным аммонием. Нейрорецептор nAChR - хорошо изученный лиганд-управляемый ионный канал который открывается при связывании ацетилхолина. Рецепторы ацетилхолина являются терапевтическими мишенями для множества неврологических расстройств, в том числе болезнь Паркинсона, Болезнь Альцгеймера, шизофрения, депрессия и аутизм. Исследования Dougherty и соавторов подтвердили, что взаимодействия катион-π важны для связывания и активации nAChR путем внесения специфических структурных изменений в ключевой остаток триптофана и корреляции результатов активности со способностью связывания катион-π.[22]
NAChR особенно важен для связывания никотин в мозгу и играет ключевую роль в никотиновая зависимость. Никотин имеет фармакофор, аналогичный ацетилхолину, особенно когда он протонирован. Убедительные доказательства подтверждают, что взаимодействия катион-π играют центральную роль в способности никотина избирательно активировать рецепторы мозга, не влияя на мышечную активность.[23][24]

Еще один пример можно увидеть на заводе УФ-В чувствительный белок UVR8. Несколько остатков триптофана взаимодействуют посредством катион-π-взаимодействий с остатками аргинина, которые, в свою очередь, образуют солевые мостики с кислотными остатками на второй копии белка. Было предложено[25] что поглощение фотона остатками триптофана нарушает это взаимодействие и приводит к диссоциации белкового димера.
Связывание катион-π также считается важным в распознавание клеточной поверхности[2][26]
Ферментный катализ
Катион-π-взаимодействия могут катализировать химические реакции, стабилизируя накопление положительного заряда в переходные состояния. Такой эффект наблюдается в ферментативных системах. Например, ацетилхолинэстераза содержит важные ароматические группы, которые связывают четвертичный аммоний в его активном центре.[2]
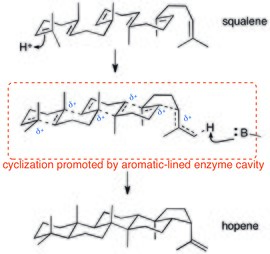
Полициклизация ферменты также полагаются на взаимодействия катион – π. Поскольку протонно-триггерная полицилизация сквален протекают через (потенциально согласованный) катионный каскад, взаимодействия катион-π идеальны для стабилизации этого диспергированного положительного заряда. Кристаллическая структура сквален-гопенциклазы показывает, что активный центр выстлан ароматическими остатками.[27]
В синтетических системах
Твердотельные конструкции
Катион-π-взаимодействия наблюдались и в кристаллах синтетических молекул. Например, Аоки и его коллеги сравнили твердые структуры холинового эфира индол-3-уксусной кислоты и незаряженного аналога. В заряженных частицах наблюдается внутримолекулярное взаимодействие катион-π с индолом, а также взаимодействие с индольным фрагментом соседней молекулы в решетке. В кристалле изостерического нейтрального соединения такого же сворачивания не наблюдается и взаимодействия между ними отсутствуют. терт-бутильная группа и соседние индолы.[28]

Супрамолекулярные рецепторы
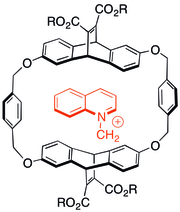
Некоторые из первых исследований взаимодействия катион-π включали изучение взаимодействия заряженных азотистых молекул в циклофан химия между хозяином и гостем. Было обнаружено, что даже когда анионные солюбилизирующие группы были добавлены к ароматическим капсулам хозяина, катионные гости во многих случаях предпочитали связываться с π-системой. Тип хозяина, показанный справа, также был способен катализировать реакции N-алкилирования с образованием катионных продуктов.[29]
Совсем недавно связывание катион-π-центрированного субстрата и катализ был вовлечен в супрамолекулярный кластерные каталитические системы металл-лиганд, разработанные Раймонд и Бергман.[30]
Использование взаимодействий π-π, CH-π и π-катионов в супрамолекулярной сборке
π-системы являются важными строительными блоками супрамолекулярной сборки из-за их универсальности. нековалентные взаимодействия с различными функциональными группами. В частности, взаимодействия π-π, CH-π и π-катионов широко используются в супрамолекулярной сборке и распознавании.

π-π взаимодействие относится к прямым взаимодействиям между двумя & pi-системами; а взаимодействие катион – π возникает в результате электростатического взаимодействия катиона с гранью π-системы. В отличие от этих двух взаимодействий, взаимодействие CH-π возникает в основном из-за переноса заряда между орбиталью C-H и π-системой.
Ярким примером применения π-π взаимодействий в супрамолекулярной сборке является синтез катенана. Основная задача синтеза катенана - это контролируемая блокировка молекул. Стоддарт и его коллеги разработали серию систем, использующих сильные π-π-взаимодействия между богатыми электронами бензол производные и бедные электронами пиридиний кольца.[31] [2] Катанен был синтезирован взаимодействием бис (пиридиния) (A), биспарафенилена-34-краун-10 (B) и 1,4-бис (бромметил) бензола C (рис. 2). Π-π-взаимодействие между A и B направляет образование взаимосвязанного промежуточного соединения-матрицы, которое затем подвергается циклизации путем реакции замещения соединением C с образованием продукта [2] катенана.

Органический синтез и катализ
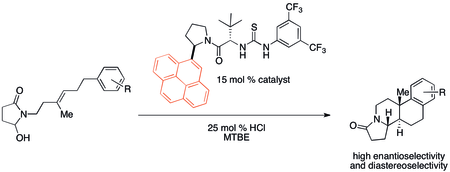
Катион-π-взаимодействия, вероятно, были важными, хотя и незамеченными, во множестве органических реакций исторически. Однако в последнее время внимание привлекли потенциальные применения в конструкции катализаторов. В частности, нековалентные органокатализаторы Было обнаружено, что иногда проявляются тенденции реакционной способности и селективности, которые коррелируют со свойствами связывания катион-π. Полициклизация, разработанная Якобсен и коллеги демонстрируют особенно сильный эффект катион-π при использовании катализатора, показанного ниже.[32]
Анион – π взаимодействие

Во многих отношениях, анион –Π-взаимодействие противоположно катион-π-взаимодействию, хотя лежащие в основе принципы идентичны. На сегодняшний день известно значительно меньше примеров. Чтобы привлечь отрицательный заряд, необходимо обратить распределение заряда π-системы. Это достигается размещением нескольких сильных электроноакцепторные заместители по системе π (е. грамм. гексафторбензол ).[33] Эффект анион – π успешно используется в химических сенсорах для определенных анионов.[34]
Смотрите также
Рекомендации
- ^ Эрик В. Анслин; Деннис А. Догерти (2004). Современная физико-органическая химия. Книги университетских наук. ISBN 978-1-891389-31-3.
- ^ а б c d е ж грамм Догерти, Д. А .; Дж. К. Ма (1997). «Катион – π-взаимодействие». Химические обзоры. 97 (5): 1303–1324. Дои:10.1021 / cr9603744. PMID 11851453.
- ^ Цузуки, Сейджи; Ёсида, Масару; Учимару, Тадафуми; Миками, Масухиро (2001). «Происхождение взаимодействия катион / π: значимость индукции в комплексах Li + и Na +». Журнал физической химии A. 105 (4): 769–773. Bibcode:2001JPCA..105..769T. Дои:10.1021 / jp003287v.
- ^ а б c d С. Мекоцци; А. П. Вест; Д. А. Догерти (1996). «Катион-π-взаимодействия в простых ароматических соединениях: электростатика обеспечивает инструмент для прогнозирования». JACS. 118 (9): 2307–2308. Дои:10.1021 / ja9539608.
- ^ а б С. Э. Уиллер; К. Н. Хоук (2009). «Эффекты заместителей в катион / π-взаимодействиях и электростатические потенциалы над центром замещенных бензолов в первую очередь связаны с эффектами заместителей через пространство». Варенье. Chem. Soc. 131 (9): 3126–7. Дои:10.1021 / ja809097r. ЧВК 2787874. PMID 19219986.
- ^ Дж. К. Амиканджело; П. Б. Арментраут (2000). «Абсолютные энергии связи комплексов катионов щелочных металлов с бензолом, определенные с помощью экспериментов по пороговой диссоциации, вызванной столкновением, и теории ab Initio». J. Phys. Chem. А. 104 (48): 11420–11432. Bibcode:2000JPCA..10411420A. Дои:10.1021 / jp002652f.
- ^ Робинсон Р.А., Стокс Р.Х. Растворы электролитов. Великобритания: Публикации Баттерворта, Питман, 1959.
- ^ Глины и глинистые минералы, Том 45, № 6, 859-866, 1997.
- ^ а б Галливан, Джастин П .; Догерти, Деннис А. (2000). «Вычислительное исследование катион-π-взаимодействий и солевых мостиков в водной среде: значение для белковой инженерии» (PDF). Журнал Американского химического общества. 122 (5): 870–874. Дои:10.1021 / ja991755c.
- ^ Kumpf, R .; Догерти, Д. (1993). «Механизм ионной селективности в калиевых каналах: вычислительные исследования катион-пи взаимодействий». Наука. 261 (5129): 1708–10. Bibcode:1993Научный ... 261.1708K. Дои:10.1126 / science.8378771. PMID 8378771.
- ^ Раджу, Раджеш К .; Блум, Джейкоб В.Г .; Ан, Йи; Уиллер, Стивен Э. (2011). «Влияние заместителей на нековалентные взаимодействия с ароматическими кольцами: выводы из вычислительной химии». ХимФисХим. 12 (17): 3116–30. Дои:10.1002 / cphc.201100542. PMID 21928437.
- ^ Хантер, К. А .; Low, C. M. R .; Rotger, C .; Vinter, J. G .; Зонта, К. (2002). «Особая характеристика супрамолекулярной химии и самосборки: влияние заместителей на катион-pi взаимодействия: количественное исследование». Труды Национальной академии наук. 99 (8): 4873–4876. Bibcode:2002PNAS ... 99.4873H. Дои:10.1073 / pnas.072647899. ЧВК 122686. PMID 11959939.
- ^ Догерти, Деннис А. (1996). «катион-пи-взаимодействия в химии и биологии: новый взгляд на бензол, Phe, Tyr и Trp». Наука. 271 (5246): 163–168. Bibcode:1996Научный ... 271..163D. Дои:10.1126 / science.271.5246.163. PMID 8539615.
- ^ Маршалл, Майкл С .; Стил, Райан П .; Thanthiriwatte, Kanchana S .; Шерилл, К. Дэвид (2009). «Кривые потенциальной энергии для взаимодействий катион-π: внеосевые конфигурации также привлекательны». Журнал физической химии A. 113 (48): 13628–32. Bibcode:2009JPCA..11313628M. Дои:10.1021 / jp906086x. PMID 19886621.
- ^ Лунд-Кац, S; Филлипс, МС; Мишра, ВК; Сегрест, JP; Анантарамайя, GM (1995). «Микроокружение основных аминокислот в амфипатических альфа-спиралях, связанных с фосфолипидом: исследования 13С ЯМР с использованием селективно меченых пептидов». Биохимия. 34 (28): 9219–9226. Дои:10.1021 / bi00028a035. PMID 7619823.
- ^ М. М. Громиха; К. Сантош; С. Ахмад (2004). «Структурный анализ катион-π-взаимодействий в ДНК-связывающих белках». Int. J. Biol. Макромол. 34 (3): 203–11. Дои:10.1016 / j.ijbiomac.2004.04.003. PMID 15225993.
- ^ Дж. П. Галливан; Д. А. Догерти (1999). «Катион – π-взаимодействия в структурной биологии». PNAS. 96 (17): 9459–9464. Bibcode:1999PNAS ... 96.9459G. Дои:10.1073 / пнас.96.17.9459. ЧВК 22230. PMID 10449714.
- ^ Берли, СК; Пецко, Г.А. (1986). «Аминоароматические взаимодействия в белках». FEBS Lett. 203 (2): 139–143. Дои:10.1016 / 0014-5793 (86) 80730-Х. PMID 3089835.
- ^ Brocchieri, L; Карлин, S (1994). «Геометрия межплоскостных контактов остатков в белковых структурах». Proc. Natl. Акад. Sci. Соединенные Штаты Америки. 91 (20): 9297–9301. Bibcode:1994PNAS ... 91.9297B. Дои:10.1073 / пнас.91.20.9297. ЧВК 44799. PMID 7937759.
- ^ Карлин, S; Цукер, М; Brocchieri, L (1994). «Измерение ассоциаций остатков в белковых структурах. Возможные последствия для сворачивания белков». J. Mol. Биол. 239 (2): 227–248. Дои:10.1006 / jmbi.1994.1365. PMID 8196056.
- ^ Нанди, CL; Сингх, Дж; Торнтон, Дж. М. (1993).«Атомное окружение боковых цепей аргинина в белках». Protein Eng. 6 (3): 247–259. Дои:10.1093 / белок / 6.3.247. PMID 8506259.
- ^ Чжун, Вт; Gallivan, JP; Zhang, Y; Ли, Л; Лестер, штат Джорджия; Догерти, Д.А. (1998). «От квантовой механики ab initio к молекулярной нейробиологии: сайт связывания катион-π в никотиновом рецепторе». Proc. Natl. Акад. Sci. Соединенные Штаты Америки. 95 (21): 12088–12093. Bibcode:1998PNAS ... 9512088Z. Дои:10.1073 / pnas.95.21.12088. ЧВК 22789. PMID 9770444.
- ^ Д. Л. Бин; Г. С. Брандт; В. Чжун; Н. М. Захариас; Х. А. Лестер; Д. А. Догерти (2002). «Катион-π-взаимодействия в распознавании лигандов серотонинергическими (5-HT3А) и никотиновые рецепторы ацетилхолина: аномальные связывающие свойства никотина ». Биохимия. 41 (32): 10262–9. Дои:10.1021 / bi020266d. PMID 12162741.
- ^ Сю, Синань; Puskar, Nyssa L .; Shanata, Jai A. P .; Лестер, Генри А .; Догерти, Деннис А. (2009). «Связывание никотина с рецепторами мозга требует сильного взаимодействия катион-π». Природа. 458 (7237): 534–7. Bibcode:2009Натура.458..534X. Дои:10.1038 / природа07768. ЧВК 2755585. PMID 19252481.
- ^ Ди Ву, Вт .; Ху, Q .; Ян, З .; Chen, W .; Ян, Ц .; Хуанг, X .; Zhang, J .; Ян, П .; Deng, H .; Wang, J .; Дэн, X .; Ши, Ю. (2012). «Структурные основы восприятия ультрафиолета В с помощью UVR8». Природа. 484 (7393): 214–219. Bibcode:2012Натура.484..214D. Дои:10.1038 / природа10931. PMID 22388820.
- ^ Waksman, G; Коминос, Д; Робертсон, Южная Каролина; Брюки, N; Балтимор, Д; Бирге, РБ; Cowburn, D; Ханафуса, H; и другие. (1992). «Кристаллическая структура домена распознавания фосфотирозина SH2 v-src в комплексе с тирозин-фосфорилированными пептидами». Природа. 358 (6388): 646–653. Bibcode:1992 Натур.358..646Вт. Дои:10.1038 / 358646a0. PMID 1379696.
- ^ Wendt, K. U .; Poralla, K; Шульц, GE (1997). «Структура и функция скваленциклазы». Наука. 277 (5333): 1811–5. Дои:10.1126 / science.277.5333.1811. PMID 9295270.
- ^ Аоки, К; К. Муяяма; Х. Нишияма (1995). «Катион-α взаимодействие между триметиламмониевым фрагментом и ароматическим кольцом в холиновом эфире индол-3-уксусной кислоты, модельное соединение для молекулярного распознавания между ацетилхолином и его эстеразой: рентгеновское исследование». Журнал химического общества, химические коммуникации (21): 2221–2222. Дои:10.1039 / c39950002221.
- ^ Маккарди, Элисон; Хименес, Лесли; Stauffer, David A .; Догерти, Деннис А. (1992). «Биомиметический катализ реакций SN2 через катион-.pi. Взаимодействия. Роль поляризуемости в катализе». Журнал Американского химического общества. 114 (26): 10314–10321. Дои:10.1021 / ja00052a031.
- ^ Фидлер (2005). «Селективное молекулярное распознавание, активация связи C-H и катализ в наноразмерных реакционных сосудах». Отчеты о химических исследованиях. 38 (4): 351–360. CiteSeerX 10.1.1.455.402. Дои:10.1021 / ar040152p. PMID 15835881.
- ^ Эштон, П. Р., Гуднау, Т. Т., Кайфер, А. Э., Реддингтон, М. В., Славин, А. М. З., Спенсер, Н., Стоддарт, Дж. Ф., Висент, Ч. and Williams, D. J. Angew. Chem. Int. Эд. 1989, 28, 1396–1399.
- ^ Ноулз, Роберт Р .; Линь, Песня; Якобсен, Эрик Н. (2010). «Энантиоселективная катионная полициклизация, катализируемая тиомочевиной». Журнал Американского химического общества. 132 (14): 5030–2. Дои:10.1021 / Ja101256v. ЧВК 2989498. PMID 20369901.
- ^ Д. Киньонеро; К. Гарау; К. Ротгер; А. Фронтера; П. Баллестер; А. Коста; П. М. Дея (2002). «Анион-π-взаимодействия: существуют ли они?». Энгью. Chem. Int. Эд. 41 (18): 3389–3392. Дои:10.1002 / 1521-3773 (20020916) 41:18 <3389 :: AID-ANIE3389> 3.0.CO; 2-S.
- ^ П. де Хуг; П. Гамез; И. Мутикайнен; У. Турпейнен; Дж. Ридейк (2004). «Рецептор ароматического аниона: взаимодействия аниона-π действительно существуют». Энгью. Chem. 116 (43): 5939–5941. Дои:10.1002 / ange.200460486.
Источники
- J. C. Ma; Д. А. Догерти (1997). «Катион – π-взаимодействие». Chem. Rev. 97 (5): 1303–1324. Дои:10.1021 / cr9603744. PMID 11851453..
- Догерти, Д. А .; Штауфер, Д. А. (декабрь 1990 г.). «Связывание ацетилхолина синтетическим рецептором: последствия для биологического распознавания». Наука. 250 (4987): 1558–1560. Bibcode:1990Sci ... 250.1558D. Дои:10.1126 / science.2274786. ISSN 0036-8075. PMID 2274786.



