Водородная связь с низким барьером - Low-barrier hydrogen bond
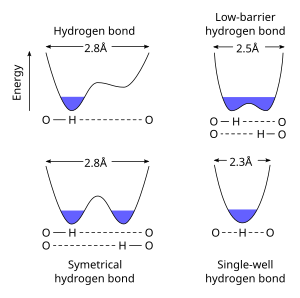
А Водородная связь с низким барьером (LBHB) - особый тип водородная связь. LBHB могут возникать, когда pKa из двух гетероатомы близки друг к другу, что позволяет более равномерно распределять водород между ними. Это разделение водорода вызывает образование особенно коротких прочных водородных связей.[1]
Описание
Стандартные водородные связи длиннее (например, 2,8 Å для O ··· O h-связи), а ион водорода явно принадлежит к одному из гетероатомы. Когда pKa гетероатомов близко согласованы, LBHB становится возможным на более коротком расстоянии (~ 2,55 Å). При дальнейшем уменьшении расстояния (<2,29 Å) связь характеризуется как одноямная или коротко-прочная водородная связь.[3]
Белки
Водородные связи с низким барьером возникают в исключающих воду средах белков.[4] Множественные остатки действуют вместе в системе реле заряда, чтобы контролировать значения pKa задействованных остатков. LBHB также встречаются на поверхности белков, но они нестабильны из-за их близости к основной воде и противоречивых требований сильных солевых мостиков в межбелковых интерфейсах.[4]
Ферментный катализ
Было предложено, чтобы водородные связи с низким барьером имели отношение к ферментативный катализ в двух типах обстоятельств.[5] Во-первых, водородная связь с низким барьером в цепи реле заряда в активном центре может активировать каталитический остаток (например, между кислотой и основанием в пределах каталитическая триада ). Во-вторых, образование LBHB может образоваться во время катализа для стабилизации переходного состояния (например, с переходным состоянием субстрата в оксианионная дыра ). Оба эти механизма спорны, и теоретические и экспериментальные данные о том, имеют ли они место, расходятся.[6][7] С 2000-х годов все пришли к единому мнению, что LBHB не используются ферментами для катализа.[7][8] Однако в 2012 году было предложено, чтобы водородная связь с низким барьером была вовлечена в дискриминацию фосфат-арсенат для белка, транспортирующего фосфат.[9] Это открытие может указывать на возможность того, что водородные связи с низким барьером играют каталитическую роль в выборе размера ионов в некоторых очень редких случаях.
использованная литература
- ^ Gilli, G .; Гилли, П. (26 сентября 2000 г.). «К единой теории водородной связи». Журнал молекулярной структуры. 552 (1–3): 1–15. Bibcode:2000JMoSt.552 .... 1G. Дои:10.1016 / S0022-2860 (00) 00454-3.
- ^ День, Виктор В .; Хоссейн, штат Мэриленд Аламгир; Кан, Сон Ок; Пауэлл, Дуглас; Лашингтон, Джеральд; Боуман-Джеймс, Кристин (2007). «Окруженный протон». Варенье. Chem. Soc. 129 (28): 8692–3. Дои:10.1021 / ja0724745.
- ^ Шиотт Б., Иверсен Б.Б., Мадсен Г.К., Ларсен Ф.К., Брюс Т.С. (октябрь 1998 г.). «Об электронной природе низкобарьерных водородных связей в ферментативных реакциях». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 95 (22): 12799–802. Bibcode:1998PNAS ... 9512799S. Дои:10.1073 / пнас.95.22.12799. ЧВК 23598. PMID 9788994.
- ^ а б Ишикита, Хироши; Сайто, Кейсуке (06.02.2014). «Реакции переноса протона и сети водородных связей в белковой среде». Журнал интерфейса Королевского общества. 11 (91): 20130518. Дои:10.1098 / rsif.2013.0518. ISSN 1742-5689. ЧВК 3869154. PMID 24284891.
- ^ Cleland, W. W .; Frey, P.A .; Герлт, Дж. А. (2 октября 1998 г.). «Низкобарьерная водородная связь в ферментативном катализе». Журнал биологической химии. 273 (40): 25529–25532. Дои:10.1074 / jbc.273.40.25529. PMID 9748211.
- ^ Эш, Э. Л. (7 ноября 1997 г.). "Низкобарьерная водородная связь в каталитической триаде сериновых протеаз? Теория против эксперимента". Наука. 278 (5340): 1128–1132. Bibcode:1997 Наука ... 278.1128А. Дои:10.1126 / science.278.5340.1128. PMID 9353195.
- ^ а б Schutz, Claudia N .; Варшел, Арье (1 апреля 2004 г.). «Пересмотр предложения о низкобарьерной водородной связи (LBHB): случай пары Asp ··· His в сериновых протеазах». Белки: структура, функции и биоинформатика. 55 (3): 711–723. Дои:10.1002 / prot.20096. PMID 15103633.
- ^ Варшел, Арье; Шарма, Панказ К .; Като, Мицунори; Сян, Юнь; Лю, Ханьбинь; Олссон, Матс Х. М. (август 2006 г.). «Электростатическая основа ферментативного катализа». Химические обзоры. 106 (8): 3210–3235. Дои:10.1021 / cr0503106. PMID 16895325.
- ^ Элиас, Микаэль; Веллнер, Алон; Гольдин-Азулай, Корина; Шабриер, Эрик; Vorholt, Julia A .; Эрб, Тобиас Дж .; Тауфик, Дэн С. (01.11.2012). «Молекулярные основы дискриминации фосфатов в богатых арсенатом средах». Природа. 491 (7422): 134–137. Bibcode:2012Натура.491..134E. Дои:10.1038 / природа11517. ISSN 0028-0836. PMID 23034649.
