Галогенная связь - Halogen bond - Wikipedia
А галогенная связь происходит, когда есть свидетельства чистого привлекательного взаимодействия между электрофильный регион, связанный с галоген атом в молекулярном объекте и нуклеофильный область в другом или том же молекулярном объекте.[1]
Склеивание
Сравнение водородной и галогенной связи:
- Водородная связь
- Галогенное соединение
В обоих случаях A (акцептор связи водород / галоген) представляет собой атом, группу или молекулу, которая отдает электроны бедным электронами частицам H-D или X-D (донорам водородной или галогеновой связи соответственно). H - атом водорода, участвующий в образовании водородных связей, а X - атом галогена, участвующий в образовании галогенных связей. Обратите внимание, что донор галогенной связи принимает электроны, а акцептор галогенной связи отдает электроны.
Можно легко провести параллельную взаимосвязь между галогенной связкой и водородная связь (HB). В обоих типах склеивания донор электронов /акцептор электронов отношения существуют. Разница между ними заключается в том, какие виды могут действовать как донор электронов / акцептор электронов. В водородной связи атом водорода действует как акцептор электронов и образует нековалентное взаимодействие, принимая электронная плотность от сайта, богатого электронами (донор электронов). При связывании галогена акцептором электронов является атом галогена. Одновременно нормальная ковалентная связь между H или X и D ослабевает, поэтому электронная плотность на H или X, по-видимому, уменьшается. Перенос электронной плотности приводит к проникновению ван дер Ваальс тома.[2]

Галогены, участвующие в связывании галогенов, включают: йод (Я), бром (Br), хлор (Cl), а иногда фтор (F). Все четыре галогена способны действовать как доноры XB (что доказано теоретическими и экспериментальными данными) и следуют общей тенденции: F
Дигалогены (I2, Br2и т. д.), как правило, образуют прочные галогенные связи. Сила и эффективность хлора и фтора в образовании ХВ зависят от природы донора ХВ. Если галоген связан с электроотрицательный (электроноакцепторный) фрагмент, с большей вероятностью образует более сильные галогенные связи.[4]
Например, йодоперфторалканы хорошо подходят для ХВ. кристалл инженерия. Кроме того, именно поэтому F2 может выступать в качестве сильного донора XB, но фторуглероды являются слабыми донорами XB, потому что алкил группа, связанная с фтором, не является электроотрицательной. В дополнение База Льюиса (Акцептор ХВ) также имеет тенденцию быть электроотрицательным, а анионы являются лучшими акцепторами ХВ, чем нейтральные молекулы.
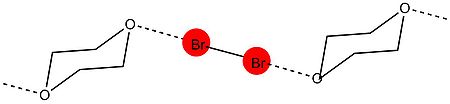
Галогенные связи - это сильные, специфические и направленные взаимодействия, которые приводят к возникновению четко определенных структур. Прочность галогенной связи находится в диапазоне 5–180 кДж / моль. Сила XB позволяет ему конкурировать с HB, которые немного слабее по силе. Галогенные связи имеют тенденцию образовываться под углами 180 °, что было показано на Odd Hassel Исследования брома и 1,4-диоксана в 1954 году. Другой фактор, способствующий прочности связи галогенов, происходит из-за небольшого расстояния между галогеном (кислота Льюиса, донор XB) и основанием Льюиса (акцептор XB). Привлекательный характер галогенных связей приводит к тому, что расстояние между донором и акцептором меньше суммы ван-дер-ваальсовых радиусов. Взаимодействие ХВ усиливается по мере уменьшения расстояния между галогеном и основанием Льюиса.
История
В 1814 году Жан-Жак Колен описал образование жидкости с металлическим блеском, когда он смешал сухой газообразный аммиак и сухой йод. Точный состав полученного I2··· NH3 Комплекс был основан пятьдесят лет спустя Фредериком Гатри.[5] В своем эксперименте он добавил:2 до водного аммиака. Истинная природа молекулярного взаимодействия, возможно, впервые была понята только полвека назад после новаторских открытий Роберта Малликена о взаимодействиях с переносом заряда и их подробного описания Оддом Хасселем.
В 1950-х годах Роберт С. Малликен разработал детальную теорию электронодонорно-акцепторных комплексов, классифицируя их как внешние или внутренние комплексы.[6][7][8] Внешние комплексы были такими, в которых межмолекулярное взаимодействие между донором и акцептором электронов было слабым и имел очень небольшой перенос заряда. Внутренние комплексы имеют обширное перераспределение заряда. Теория Малликена использовалась для описания механизма, с помощью которого происходит образование XB.
Примерно в тот же период времени, когда Малликен разработал свою теорию, кристаллографические исследования, проведенные Хасселем, стали появляться и стали поворотным моментом в понимании образования ХВ и его характеристик.
Первое исследование рентгеновской кристаллографии группой Хасселя было проведено в 1954 году. В ходе эксперимента его группе удалось показать структуру 1,4-диоксаната брома, используя дифракция рентгеновских лучей техники.[9] Эксперимент показал, что между атомами кислорода диоксана и атомами брома присутствует короткое межмолекулярное взаимодействие. Расстояние O-Br в кристалле составляет 2,71 Å, что указывает на сильное взаимодействие между атомами брома и кислорода. Кроме того, это расстояние меньше суммы ван-дер-ваальсовых радиусов кислорода и брома (3,35 Å). Угол между связью O-Br и Br-Br составляет около 180 °. Это было первое свидетельство типичных характеристик, обнаруживаемых при образовании галогенных связей, и привело Хасселя к выводу, что атомы галогена непосредственно связаны с донором электронной пары с направлением связи, которое совпадает с осями орбиталей неподеленных пар в доноре электронной пары. молекула.[10]
В 1969 году Хассель был удостоен Нобелевской премии по химии за выдающееся открытие того, что галогены могут действовать как электрофильные акцепторы электронов и самособираться в высокоорганизованные кристаллические комплексы с переносом заряда в присутствии доноров электронов.[11] Ранний обзор донора-акцептора электронов был сделан Бентом в 1968 году.[12] Термин «галогенная связь» не применялся до 1978 года Дюма и его коллегами, которые исследовали комплексы CCl.4, CBr4, SiCl4, а SiBr4 с тетрагидрофуран, тетрагидропиран, пиридин, анизол, и ди-н-бутиловый эфир в органических растворителях.[13]
Однако только в середине 1990-х годов природа и применение галогенной связи начали интенсивно изучаться. Систематическая и обширная работа Легона и его коллег, изучавших широкий спектр аддуктов с галогеновыми связями, образующихся в газовой фазе, с помощью микроволновой спектроскопии, привлекла внимание к сходству между галогенными связями и более известными взаимодействиями водородных связей.[14] Вычислительные расчеты Политцера и Мюррея были особенно важны, поскольку они показали, что высокая направленность связи галогена является результатом анизотропного распределения электронной плотности вокруг ядра галогена.[15] и проложили путь к определению «σ-дыры».[16]
В настоящее время XB используется для целого ряда функциональных приложений, например, для инженерии кристаллов, супрамолекулярной химии, полимеров, жидких кристаллов, проводящих материалов и медицинской химии.[17][18]
Приложения
Эта секция написано как личное размышление, личное эссе или аргументированное эссе который излагает личные чувства редактора Википедии или представляет оригинальный аргумент по теме. (август 2013) (Узнайте, как и когда удалить этот шаблон сообщения) |
Кристалл инженерия
Кристалл инженерия - это развивающаяся область исследований, объединяющая химию твердого тела и супрамолекулярную химию.[20] Эта уникальная область является междисциплинарной и объединяет традиционные дисциплины, такие как кристаллография, органическая химия, и неорганическая химия. В 1971 году Шмидт впервые основал эту область, опубликовав публикацию о фотодимеризации в твердом состоянии.[21] Более недавнее определение определяет инженерию кристаллов как использование межмолекулярных взаимодействий для кристаллизации и для разработки новых веществ с различными желаемыми физико-химическими свойствами. До открытия галогенной связи подход к инженерии кристаллов предполагал использование водородная связь, координационная химия и межионных взаимодействий для разработки жидкокристаллических и твердокристаллических материалов. Кроме того, галогеновая связь используется для организации катион-радикальных солей, изготовления молекулярных проводников и создания жидкокристаллических конструкций. С момента открытия связи галогенов существуют новые молекулярные сборки.[22] Из-за уникальной химической природы галогеновых связей это межмолекулярное взаимодействие служит дополнительным инструментом для развития инженерии кристаллов.[23]
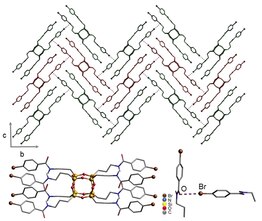
Первое упоминание об использовании галогеновой связи при образовании жидких кристаллов было сделано Х. Лок Нгуеном.[24] Для образования жидких кристаллов были использованы алкоксистилбазолы и пентафториодбензол. Предыдущие исследования Метранголо и Реснати продемонстрировали полезность пентафториодбензола для твердотельных структур.[2] Различные алкоксистильбазолы были использованы для нелинейной оптики и металломезогенов.[25] Используя другое открытие Реснати (например, сильное образование комплексов N-I), группа разработала галогенсвязанные комплексы с йодпентафторбензолом и 4-алкоксистильбазолами. Рентгеновская кристаллография показала, что расстояние N-I составляет 2,811 (4) Å, а угол соединения составляет 168,4 °. Аналогичные расстояния N-I были измерены в твердых порошках.[26] Обнаруженное расстояние N-I короче суммы радиусов Ван-дер-Ваальса для азота и йода (3,53 Å). Монокристаллическая структура молекул указывает на отсутствие квадрупольных взаимодействий. Комплексы на рисунке 4 оказались жидкокристаллическими.
Чтобы проверить представление о влиянии поляризуемости на прочность галогенной связи, в качестве основания Льюиса использовали бромпентафторбензол. Следовательно, не было получено подтверждения образования комплекса галогенной связи. Это открытие обеспечивает дополнительную поддержку зависимости галогенной связи от атомной поляризуемости. Используя аналогичные донорно-акцепторные каркасы, авторы продемонстрировали, что прочность галогенных связей в жидкокристаллическом состоянии сопоставима с водородными связями мезогенов.
Получение поли (дийоддиацетилена)

Приложения, использующие свойства сопряженных полимеров, появились в результате работы, проделанной Heeger, McDiaramid и Сиракава с открытием, что полиацетилен представляет собой проводящий, хотя и сложный в обработке материал. С тех пор была проведена работа по имитации основной цепи этого сопряженного полимера (например, поли (п-фениленвинилена)). Конъюгированные полимеры имеют множество практических применений и используются в таких устройствах, как фотоэлектрические элементы, органические светодиоды, полевые транзисторы, и химические датчики. Goroff et al. получали упорядоченный поли (дийоддиацетилен) (PIDA) посредством предварительного расположения мономера (2) с галогенной связью каркаса.[27] PIDA является отличным предшественником других сопряженных полимеров, так как йод легко трансформируется. Например, возможно расщепление C − I электрохимическое восстановление.[28]
Кристаллические структуры мономера (2) представляют собой неупорядоченные материалы различного состава и связности. Хосты (3–7) были исследованы на предмет их молекулярной упаковки, в первую очередь путем изучения сокристаллы мономера (2) и соответствующего хозяина. И (3), и (4) предварительно организованный мономер (2), но стерическое скопление йода препятствовало успешной топологической полимеризации мономера. Хосты (5–7) используют водородные связи и галогеновые связи для удержания мономера (2) на оптимальном расстоянии друг от друга для облегчения полимеризации.
Фактически, когда использовался хост 7, полимеризация происходит самопроизвольно при выделении сокристаллов. Кристаллические структуры показать полимер нити все параллельны сети водородных связей, и хост нитрилы каждый галоген связан с атомами йода. Половина атомов йода в (1) в кристалле находится в тесном контакте с оксаламидными атомами кислорода. Атомы кислорода хозяина 7 действуют как акцепторы водородных и галогеновых связей.


Пористые структуры

Пористые структуры имеют множество применений. Многие химики и материаловеды работают над улучшением металлоорганические каркасы (MOF) для хранения водорода для использования в автомобилях. Эти высокоорганизованные кристаллические комплексы включения имеют потенциальное применение в катализ и устройства молекулярного разделения. Молекулярная организация часто контролируется через межмолекулярные силы Такие как водородная связь. Однако, используя водородная связь часто ограничивает диапазон доступных размеров пор из-за плотной упаковки.
Пигге и др. Использовали галогеновые связывающие взаимодействия между амины, азот гетероциклы, карбонил группы и другие органические галогениды, чтобы построить их пористые структуры. Это важно, потому что органические кристаллические сети, опосредованные галогенными связями, взаимодействие значительно слабее, чем водородная связь, встречаются редко.[29]
Кристаллические структуры 1 и 2 [ниже] были получены в различных растворители, Такие как дихлорметан, пиридин, и бензол. Авторы отмечают, что пористые комплексы включения, по-видимому, частично опосредованы беспрецедентными I-π-взаимодействиями и галогенной связью между йодом и карбонил группы. В Кристальная структура [показано ниже] собираются вместе в треугольный массив, а молекулы 2 приблизительно симметричны. Кроме того, все наборы взаимодействий связи галогена не идентичны, и все межмолекулярные взаимодействия между галогеном и акцептором связи галогена немного превышают сумму взаимодействий Радиус Ван-дер-Ваальса, что означает немного более слабую связь галогена, что приводит к большей гибкости структуры. Двухмерные слои укладываются параллельно друг другу, образуя каналы, заполненные растворителем.
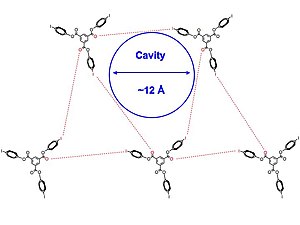
Взаимодействия с растворителями также отмечаются при образовании гексагональных структур, особенно в пиридин и хлороформ. Первоначально кристаллы, образующие эти растворы, образуют каналированные структуры. Со временем новые игольчатые структуры, не содержащие сольватов, уплотняются вместе, и эти иглы фактически являются термодинамически предпочтительным кристаллом. Авторы надеются использовать эту информацию, чтобы лучше понять дополнительный характер водородные связи и галогенные связи для создания предсказывающих структур малых молекул.
Галогенные связи в биологических макромолекулах
Некоторое время игнорировалось значение связывания галогена с биологической структурой макромолекул. На основе монокристаллических структур в банк данных белков (PDB) (версия от июля 2004 г.), исследование Auffinger и других структур монокристаллов с разрешением 3 Å или лучше, введенных в PDB, показало, что более 100 галогенных связей были обнаружены в шести структурах нуклеиновых кислот на основе галогенированных кислот и шестидесяти шести белках. -субстратные комплексы для галоген-кислородных взаимодействий. Хотя и не так часто, как взаимодействия галоген-кислород, контакты галоген-азот и галоген-сера также были идентифицированы.[30] Эти научные открытия обеспечивают уникальную основу для выяснения роли галогенных связей в биологических системах.
На биомолекулярном уровне связывание галогенов важно для специфичности субстрата, связывания и молекулярного сворачивания.[31] В случае взаимодействий белок-лиганд наиболее распространенные связи с переносом заряда с поляризуемыми галогенами включают карбонилы основной цепи и / или гидроксильные и карбоксилатные группы аминокислотных остатков. Обычно в ДНК и комплексы белок-лиганд, расстояние связи между донорными атомами основания Льюиса (например, O, S, N) и кислотой Льюиса (галоген) короче, чем сумма их ван-дер-ваальсовых радиусов. В зависимости от структурной и химической среды взаимодействия галогенных связей могут быть слабыми или сильными. В случае некоторых комплексов белок-лиганд галогеновые связи энергетически и геометрически сравнимы с таковой водородной связи, если донорно-акцепторная направленность остается постоянной. Было показано, что это межмолекулярное взаимодействие является стабилизирующим и определяющим конформацию в структурах белок-лиганд и ДНК.
Для молекулярного распознавания и связывания может иметь значение связывание галогена. Примером этого утверждения при разработке лекарств является специфичность субстрата для связывания IDD 594 с человеческим организмом. альдозоредуктаза.[32] Э. Ховард сообщил о наилучшем разрешении для этого мономерного фермента. Эта биологическая макромолекула состоит из 316 остатков и восстанавливает альдозы, кортикостероиды и альдегиды. Считается, что D-сорбит, продукт ферментативного превращения D-глюкозы, вносит свой вклад в последующие эффекты патологии диабета.[33] Следовательно, ингибирование этого фермента имеет терапевтическое значение.
Ингибиторы на основе альдегидов и карбоксилатов эффективны, но токсичны, поскольку нарушена функциональная активность альдегидредуктазы. Карбоксилат и альдегид Было показано, что ингибиторы образуют водородную связь с Trp 111, Tyr 48 и His 110. «Карман специфичности», созданный в результате связывания ингибитора, состоит из Leu 300, Ala 299, Phe 122, Thr 113 и Trp 111. Чтобы ингибиторы были эффективными, ключевые остатки взаимодействия были идентифицированы как Thr 113 и Trp 111. IDD 594 был разработан таким образом, чтобы галоген обеспечивал селективность и был активным. При связывании это соединение вызывает конформационное изменение, которое вызывает образование галогеновой связи между кислородом Thr и бромом ингибитора. Расстояние связи составляет 2,973 (4) Å. Именно эта галогеновая связь O-Br способствует большей активности этого ингибитора альдозоредуктазы человека, а не альдегидредуктаза.

Рекомендации
- ^ Desijaru, G.R .; Ho, P. S .; Kloo, L .; Legon, A.C .; Marquardt, R .; Metrangolo, P .; Политцер, П .; Resnati, G .; Риссанен, К. (2013). «Определение галогенной связи (Рекомендации IUPAC 2013 г.)». Pure Appl. Chem. 85 (8): 1711–1713. Дои:10.1351 / pac-rec-12-05-10.
- ^ а б Metrangolo, P .; Реснати, Г. (2001), "Галогенные связи: парадигма супрамолекулярной химии", Chem. Евро. Дж., 7 (12): 2511–2519, Дои:10.1002 / 1521-3765 (20010618) 7:12 <2511 :: AID-CHEM25110> 3.0.CO; 2-T, PMID 11465442
- ^ Политцер, П .; и другие. (2007), "Обзор галогенного связывания", J. Mol. Модель, 13 (2): 305–311, Дои:10.1007 / s00894-006-0154-7, PMID 17013631
- ^ Metrangolo, P .; Neukirch, H; Пилати, Т; Реснати, Г. (2005), «Процессы распознавания на основе галогенных связей: мир, параллельный водородной связи.†", Соотв. Chem. Res., 38 (5): 386–395, Дои:10.1021 / ar0400995, PMID 15895976
- ^ Гатри, Ф. (1863), "Xxviii. - О йодиде йодаммония", J. Chem. Soc., 16: 239–244, Дои:10.1039 / js8631600239
- ^ Малликен, Р. (1950), "Структуры комплексов, образованных молекулами галогена с ароматическими и кислородсодержащими растворителями1", Варенье. Chem. Soc., 72 (1): 600, Дои:10.1021 / ja01157a151
- ^ Малликен, Р. (1952), «Молекулярные соединения и их спектры. II», Варенье. Chem. Soc., 74 (3): 811–824, Дои:10.1021 / ja01123a067
- ^ Малликен, Р. (1952), "Молекулярные соединения и их спектры. III. Взаимодействие доноров и акцепторов электронов", J. Phys. Chem., 56 (7): 801–822, Дои:10.1021 / j150499a001
- ^ Hassel, O .; Hvoslef, J .; Виховде, Э. Хадлер; Соренсен, Нильс Андреас (1954), «Структура 1,4-диоксаната брома» (PDF), Acta Chem. Сканд., 8: 873, Дои:10.3891 / acta.chem.scand.08-0873
- ^ Хассель, О. (1970), "Структурные аспекты межатомной связи с переносом заряда", Наука, 170 (3957): 497–502, Bibcode:1970Sci ... 170..497H, Дои:10.1126 / science.170.3957.497, PMID 17799698
- ^ Хассель, О. (1972). «Структурные аспекты межатомной связи с переносом заряда». В нобелевских лекциях по химии 1963-1970 гг.: 314–329.
- ^ Бент, Х.А. (1968). «Структурная химия донорно-акцепторных взаимодействий». Chem. Rev. 68 (5): 587–648. Дои:10.1021 / cr60255a003.
- ^ Dumas, J.-M .; Peurichard, H .; Гомель, М. (1978). «CX4 ... Базовые взаимодействия как модели слабых взаимодействий с переносом заряда: сравнение с сильными взаимодействиями с переносом заряда и водородными связями». J. Chem. Рез. (S). 2: 54–57.
- ^ Легон, А. С. (1999). "Пререактивные комплексы дигалогенов XY с основаниями Льюиса B в газовой фазе: систематический случай для галогенового аналога B ··· XY водородной связи B ··· HX". Энгью. Chem. Int. Эд. 38 (18): 2686–2714. Дои:10.1002 / (sici) 1521-3773 (19990917) 38:18 <2686 :: aid-anie2686> 3.0.co; 2-6.
- ^ Политцер, П .; Мюррей, Дж. С .; Кларк, Т. (2010). «Галогенная связь: направленное нековалентное взаимодействие с направленным электростатическим зарядом». Phys. Chem. Chem. Phys. 101: 16789–16794.
- ^ Clark, T .; Hennemann, M .; Murray, J. hS .; Политцер, П. (2007). «Галогенная связь: σ-отверстие». J. Mol. Модель. 13 (2): 291–296. Дои:10.1007 / s00894-006-0130-2. PMID 16927107.
- ^ Gilday, L.C .; Робинсон, С. У .; Barendt, T. A .; Langton, M. J .; Mullaney, B.R .; Бир, П. Д. (2015). «Галогенная связь в супрамолекулярной химии». Chem. Rev. 115 (15): 7118–7195. Дои:10.1021 / cr500674c. PMID 26165273.
- ^ Cavallo, G .; Metrangolo, P .; Milani, R .; Пилати, Т .; Priimagi, A .; Resnati, G .; Терранео, Г. (2016). "Галогенная связь". Chem. Rev. 116 (4): 2478–2601. Дои:10.1021 / acs.chemrev.5b00484. ЧВК 4768247. PMID 26812185.
- ^ Джанета, Матеуш; Шаферт, Славомир (01.10.2017). «Синтез, характеристика и термические свойства амидо-ПОСС типа Т8 с п-галогенфенильной концевой группой». Журнал металлоорганической химии. 847: 173–183. Дои:10.1016 / j.jorganchem.2017.05.044. ISSN 0022-328X.
- ^ Брага, Д .; Desiraju, Gautam R .; Миллер, Джоэл С .; Орпен, А. Гай; Прайс, Сара (Салли) Л .; и другие. (2002), «Инновации в кристаллостроении», CrystEngComm, 4 (83): 500–509, Дои:10.1039 / b207466b
- ^ Шмидт, G.M.J. (1971), «Фотодимеризация в твердом состоянии», Pure Appl. Chem., 27 (4): 647–678, Дои:10.1351 / pac197127040647
- ^ Metrangolo, P .; Реснати, Джузеппе; Пилати, Туллио; Лиантонио, Розальба; Мейер, Франк; и другие. (2007), «Разработка функциональных материалов с помощью галогенных соединений», J. Polym. Sci., Часть A: Polym. Chem., 45 (1): 1–14, Bibcode:2007JPoSA..45 .... 1M, Дои:10.1002 / pola.21725
- ^ Метранголо, Пьеранджело; Реснати, Джузеппе; Пилати, Туллио; Терранео, Джанкарло; Биелла, Серена (2009), «Анионная координация и анионно-шаблонная сборка под контролем галогенных связей», CrystEngComm, 11 (7): 1187–1196, Дои:10.1039 / B821300C
- ^ Нгуен, Лок; Al, H. et ;. Херстхаус, МБ; Legon, AC; Брюс, Д.В. (2004), "Галогенные связи: новое взаимодействие для образования жидких кристаллов", Варенье. Chem. Soc., 126 (1): 16–17, Дои:10.1021 / ja036994l, PMID 14709037
- ^ Брюс, Д.В. (2001), "Химия материалов алкоксистилбазолов и их металлических комплексов", Adv. Неорг. Chem., Успехи неорганической химии, 52: 151–204, Дои:10.1016 / S0898-8838 (05) 52003-8, ISBN 9780120236527
- ^ Weingarth, M .; Raouafi, N .; Jouvelet, B .; Дума, Л .; Bodenhausen, G .; Boujlel, K .; Scöllhorn, B .; Текли, П. (2008), «Выявление молекулярной самосборки и геометрии нековалентной галогенной связи с помощью твердотельной ЯМР-спектроскопии», Chem. Commun. (45), стр. 5981–5983, Дои:10.1039 / b813237b, PMID 19030559
- ^ Sun, A .; Lauher, J.W .; Горофф, Н. (2006), «Получение поли (дийоддиацетилена), упорядоченного сопряженного полимера углерода и йода», Наука, 312 (5776): 1030–1034, Bibcode:2006Научный ... 312.1030С, Дои:10.1126 / science.1124621, PMID 16709780
- ^ Sun, A .; Lauher, J.W .; Горофф, Н. (2008), «Получение поли (дийоддиацетилена), упорядоченного сопряженного полимера углерода и йода», Наука, 312 (5776): 1030–1034, Bibcode:2006Научный ... 312.1030С, Дои:10.1126 / science.1124621, PMID 16709780
- ^ Pigge, F .; Вангала, В .; Kapadia, P .; Swenson, D .; Rath, N .; Chem, Comm (2008), «Гексагональные кристаллические комплексы включения 4-йодфенокситримезоата», Химические коммуникации, 38 (39): 4726–4728, Дои:10.1039 / b809592b, PMID 18830473
- ^ Auffinger, P .; Hays, FA; Westhof, E; Хо, PS; и другие. (2004), «Галогенные связи в биологических молекулах», Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ., 101 (48): 16789–16794, Bibcode:2004PNAS..10116789A, Дои:10.1073 / pnas.0407607101, ЧВК 529416, PMID 15557000
- ^ Steinrauf, L.K .; Гамильтон, JA; Брейден, Британская Колумбия; Мюррелл-младший; Бенсон, Мэриленд; и другие. (1993), "Рентгеновская кристаллическая структура варианта Ala-109 -> Thr транстиретина человека, который вызывает эутиреоидную гипертироксинемию", J. Biol. Chem., 268 (4): 2425–2430, PMID 8428916
- ^ Howard, E.I .; и другие. (2004), "Дизайн лекарств сверхвысокого разрешения I: Детали взаимодействий в комплексе человеческого альдозоредуктазы-ингибитор при 0,66 Å", Белки: структура, функции и биоинформатика, 55 (4): 792–804, Дои:10.1002 / prot.20015, PMID 15146478
- ^ Ябэ-нишимура, С. (1998), «Альдозоредуктаза при токсичности глюкозы: потенциальная цель для предотвращения диабетических осложнений», Pharmacol Rev, 50 (1): 21–33, PMID 9549756
- ^ Howard, E.I .; Санишвили, Р; Кахау, RE; Митчлер, А; Chevrier, B; Barth, P; Ламур, V; Ван Зандт, М; и другие. (2004), "Дизайн лекарств сверхвысокого разрешения I: Детали взаимодействий в комплексе человеческого альдозоредуктазы-ингибитор при 0,66 Å", Белки: структура, функции и биоинформатика, 55 (4): 792–804, Дои:10.1002 / prot.20015, PMID 15146478


