Циклофан - Cyclophane

А циклофан это углеводород состоящий из ароматный единица (обычно бензол кольцо) и алифатическая цепь что образует мост между двумя несмежными положениями ароматического кольца. Более сложные производные с множеством ароматических звеньев и мостиков, образующих похожий на сумку структуры также известны. Циклофаны хорошо изучены в органическая химия потому что они принимают необычные химические конформации из-за накопления напряжение.
![Схема 2. [6] парациклофаны.](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d9/-6-cyclophanes.png/300px--6-cyclophanes.png)
Основные типы циклофана: [n] метациклофаны (я) в схема 1, [n] парациклофаны (II) и [n.n '] циклофаны (III). Приставки мета и параграф соответствуют обычным паттерны замещения аренов и n относится к числу атомов углерода, составляющих мостик.
Структура
Парациклофаны принимают форма лодки обычно наблюдается в циклогексаны но все еще в состоянии сохранить ароматичность. Чем меньше значение n, тем больше отклонение от ароматической планарности. В [6] парациклофан, который является одним из самых маленьких, но стабильных циклофанов. Рентгеновская кристаллография показывает, что ароматический мостиковый атом углерода составляет с плоскостью угол 20,5 °. В бензил угли отклоняются еще на 20,2 °. Чередование длин углеродно-углеродных связей увеличилось с 0 на бензол до 39 вечера.[1][2]
В органических реакциях [6] циклофан имеет тенденцию реагировать как производное диена, а не как арен. С бром дает 1,4-сложение и с хлор формы продукта с 1,2-сложением.
Тем не менее протонный ЯМР Спектр показывает ароматические протоны и их обычные неэкранированные положения около 7,2 м.д., а центральные метиленовые протоны в алифатическом мостике даже сильно экранированы до положения около -0,5 м.д., то есть даже экранированы по сравнению с внутренним эталоном. тетраметилсилан. С уважением к диамагнитный кольцевой ток По критерию ароматичности этот циклофан по-прежнему ароматичен.

Одна конкретная область исследований циклофанов включает в себя изучение того, насколько близко атомы могут находиться над центром ароматического ядра.[3] В так называемом ин-циклофаны с частью молекулы, вынужденной указывать вРасстояние между водородом и ареном, определенное экспериментально, составляет всего 168пикометры (вечера).
Несвязывающее расстояние между азотом и ареном 244 пм зарегистрировано для пиридинофана, а в необычной суперфан два бензольных кольца разделяет всего 262 мкм. Другими представителями этой группы являются ин-метилциклофаны,[4] ин-кетоциклофаны[5] и в,в-Бис (гидросилан).[6]
Синтетические методы
[6] парациклофан может быть синтезирован[7][8] в лаборатории Реакция Бэмфорда-Стивенса с спиро кетон 1 в схема 3 перестановка в пиролиз реакция через карбен средний 4. Циклофан может быть фотохимически преобразован в Бензол Дьюара 6 и обратно, приложив тепло. Отдельный путь к форме Дьюара - катионный перхлорат серебра индуцированный реакция перегруппировки бициклопропенильного соединения 7.
![Схема 3. [6] синтез парациклофана.](http://upload.wikimedia.org/wikipedia/commons/thumb/3/31/-6-cyclophaneSynthesis.png/500px--6-cyclophaneSynthesis.png)
Метапарациклофаны составляют еще один класс циклофанов, таких как [14] [14] метапарациклофан[9] в схема 4[10] показывающий на месте Реакция Рамберга-Беклунда преобразование сульфон 3 к алкен 4.
![Схема 4. [14] [14] метапарациклофан](http://upload.wikimedia.org/wikipedia/commons/thumb/9/93/Metaparacyclophane.png/600px-Metaparacyclophane.png)
Встречающиеся в природе циклофаны
Несмотря на перенапряжение, мотив циклофана существует в природе. Одним из примеров метациклофана является кавикулярин.
Гауамин А представляет собой парациклофан, обнаруженный в некоторых видах оболочка. Из-за его потенциального применения в качестве противоопухолевого средства препарат, средство, медикамент это также доступно из полный синтез через алкин - пирон Реакция Дильса-Альдера на решающем этапе с удалением углекислого газа (схема 5).[11]
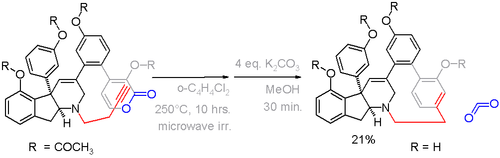
В этом соединении отклонение от планарности составляет 13 ° для бензольного кольца и 17 ° для атомов углерода-плацдарма.[12] Альтернативная стратегия образования циклофана в схема 6[13] был разработан на основе ароматизация кольца хорошо после формирования моста.

Два дополнительных типа циклофанов были обнаружены в природе, когда они были выделены из двух видов цианобактерии из семьи Ностокаки.[14] Эти два класса циклофанов являются [7,7] парациклофанами и были названы в честь видов, из которых они были извлечены: цилиндроциклофаны из Cylindrospermum lichenforme и ностоциклофаны из Носток линкиа.
[n.n] Парациклофаны
Хорошо эксплуатируемый член семейства [n.n] парациклофанов - это [2.2] парациклофан.[15][16] Один из способов его приготовления - Устранение 1,6-Хофмана:[17]

[2.2] парациклофан-1,9-диен применялся в ROMP к поли (п-фенилен винилен) с чередованием цис-алкен и транс-алкен облигации с использованием Катализатор второго поколения Граббса:[18]

Движущей силой раскрытия кольца и полимеризации является снятие напряжения. Считается, что реакция живая полимеризация из-за отсутствия конкурирующих реакций.
Поскольку два бензольных кольца находятся в непосредственной близости, этот тип циклофана также служит морской свинкой для фотохимический димеризация реакции, как показано на этом примере:[19]

Сформированный продукт имеет октаэдран скелет. Когда амин группа заменяется на метиленовая группа реакции не происходит: димеризация требует перекрытие сквозных облигаций между ароматическими пи-электроны и сигма электроны в связи C-N в реагентах LUMO.
Циклопарафенилены
[n] Циклопарафенилены ([n] CPP) состоят из циклических полностью пара-связанных фенильных групп.[20] Этот составной класс представляет некоторый интерес как потенциальный строительный блок для нанотрубки. Сообщалось о членах 18, 12, 10, 9, 8, 7, 6 и 5 фенилены. Эти молекулы уникальны тем, что не содержат алифатических линкерных групп, которые создают нагрузку на ароматическое звено. Вместо этого вся молекула представляет собой напряженную ароматическую единицу.
Фанес
Обобщение циклофанов привело к концепции Фанес в номенклатуре ИЮПАК.
Систематическое название номенклатуры фанов, например, [14] метациклофан представляет собой 1 (1,3) -бензолациклопентадекафан;
и [2,2 '] парациклофан (или [2,2] парациклофан) представляет собой 1,4 (1,4) -дибензолациклогексафан.
Рекомендации
- ^ Тобе, Йошито; Уэда, Кеничи; Канеда, Терухиса; Какиучи, Киёми; Одаира, Ёсинобу; Кай, Ясуши; Касаи, Нобутами (1987). «Синтез и молекулярная структура (Z) - [6] парациклоф-3-енов». Журнал Американского химического общества. 109 (4): 1136–1144. Дои:10.1021 / ja00238a024.
- ^ Голод, Юрген; Вольф, Кристиан; Тохтерманн, Вернер; Петерс, Ева-Мария; Петерс, Карл; фон Шнеринг, Ханс Георг (1986). "Synthese mittlerer und großer Ringe, XVI. Bootförmige Arene - Synthese, Struktur und Eigenschaften von [7] Paracyclophanen und [7] (1,4) Naphthalinophanen". Chemische Berichte. 119 (9): 2698–2722. Дои:10.1002 / cber.19861190904.
- ^ Паскаль, Роберт А. (2004). ""Molecular Iron Maidens ": ультракороткие несвязанные контакты в циклофанах и других скученных молекулах". Европейский журнал органической химии. 2004 (18): 3763–3771. Дои:10.1002 / ejoc.200400183.
- ^ Песня, Цюлин; Хо, Дуглас М .; Паскаль, Роберт А. (2005). "Стерически конгестин-метилциклофаны". Журнал Американского химического общества. 127 (32): 11246–11247. Дои:10.1021 / ja0529384. PMID 16089445.
- ^ Цинь, Цянь; Маг, Джоэл Т .; Паскаль, Роберт А. (2010). «Анин-Кетоциклофан». Органические буквы. 12 (5): 928–930. Дои:10.1021 / ol9028572. PMID 20112943.
- ^ Цзун, Цзе; Маг, Джоэл Т .; Паскаль, Роберт А. (2013). «Исключительная стерическая застой в in, in-бис (гидросилан)». Журнал Американского химического общества. 135 (36): 13235–13237. Дои:10.1021 / ja407398w. PMID 23971948.
- ^ Kane, Vinayak V .; Вольф, Энтони Д .; Джонс, Мейтленд (1974). «[6] Парациклофан». Журнал Американского химического общества. 96 (8): 2643–2644. Дои:10.1021 / ja00815a070.
- ^ Kammula, Seetha L .; Iroff, Linda D .; Джонс, Мейтленд; Van Straten, J. W .; De Wolf, W. H .; Бикельгаупт, Ф. (1977). «Взаимное превращение [6] парациклофана и 1,4-гексаметилена (бензол Дьюара)». Журнал Американского химического общества. 99 (17): 5815. Дои:10.1021 / ja00459a055.
- ^ Вэй, Чуньмэй; Мо, Кай-Фор; Чан, Цзы-Лок (2003). «[14] [14] Метапарациклофан: первый пример [m] [n] метапарациклофана». Журнал органической химии. 68 (7): 2948–2951. Дои:10.1021 / jo0267044. PMID 12662074.
- ^ Схема 4. Схема реакции: с пара-кольцом на месте, замыкание мета-части кольца с помощью нуклеофильное смещение из дибромид к дисульфид. потом окисление сульфида в сульфон к пероксид водорода сопровождаемый на месте Реакция Рамберга-Беклунда с донором галогенида дибромдифторметаном и основанием гидроксид калия. Заключительный этап гидрирование ПФ алкен водородом и палладий на углероде
- ^ Baran, Phil S .; Бернс, Ноа З. (2006). «Полный синтез (±) -гауамина А». Журнал Американского химического общества. 128 (12): 3908–3909. Дои:10.1021 / ja0602997. PMID 16551088. Авторы отмечают биосинтетическое происхождение как загадочный
- ^ Випф, Питер; Фурегати, Маркус (2006). «Синтез 3-аза- [7] -парациклофанового ядра гауамина А и В». Органические буквы. 8 (9): 1901–1904. Дои:10.1021 / ol060455e. PMID 16623580.
- ^ Схема 6. Схема реакции: стадия I реакция элиминации метанола с трифторэтанол и диизопропиламин, шаг II метилирование с диметилсульфат. Ns = Нозилат
- ^ Мур, Брэдли С .; Чен, Цзянь Лу; Паттерсон, Грегори М. Л .; Мур, Ричард Э .; Бринен, Линда С .; Като, Йоко; Кларди, Джон (1990). «[7.7] Парациклофаны из сине-зеленых водорослей». Варенье. Chem. Soc. 112 (10): 4061–4063. Дои:10.1021 / ja00166a066.
- ^ Хасан, Захид; Спулинг, Эдуард; Knoll, Daniel M .; Лаханн, Йорг; Bräse, Стефан (2018). «Планарные хиральные [2.2] парациклофаны: от синтетического любопытства до приложений в асимметричном синтезе и материалах». Обзоры химического общества. 47 (18): 6947–6963. Дои:10.1039 / C7CS00803A. PMID 30065985.
- ^ Хасан, Захид; Спулинг, Эдуард; Knoll, Daniel M .; Bräse, Стефан (2019). «Региоселективная функционализация [2.2] парациклофанов: недавний синтетический прогресс и перспективы». Angewandte Chemie International Edition. 0 (Я). Дои:10.1002 / anie.201904863. ISSN 1521-3773. PMID 31283092.
- ^ Органический синтез, Сб. Vol. 5, стр.883 (1973); Vol. 42, стр.83 (1962) Связь В архиве 2012-10-23 в Wayback Machine.
- ^ Ю, Чин-Ян; Тернер, Майкл Л. (2006). «Растворимый поли (п-фениленвинилен) s через метатезисную полимеризацию с раскрытием кольца». Angewandte Chemie International Edition. 45 (46): 7797–7800. Дои:10.1002 / anie.200602863. PMID 17061303.
- ^ Окамото, Хидеки; Сатаке, Кёсукэ; Исида, Хироюки; Кимура, Масару (2006). "Фотореакция производного 2,11-диаза [3.3] парациклофана: образование октаэдрана путем фотохимической димеризации бензола". Журнал Американского химического общества. 128 (51): 16508–16509. Дои:10.1021 / ja067350r. PMID 17177393.
- ^ Херст, Элизабет С .; Джасти, Рамеш (2012). «Гибочный бензол: синтез [n] циклопарафениленов». Журнал органической химии. 77 (23): 10473–10478. Дои:10.1021 / jo302186h. PMID 23126565.
