Муфта Соногашира - Sonogashira coupling
| Муфта Соногашира | |
|---|---|
| Названный в честь | Кенкичи Соногашира |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | соногашира-сцепление |
| RSC ID онтологии | RXNO: 0000137 |
| Примеры и связанные реакции | |
| Подобные реакции | Муфта Соногашира без содержания меди |
В Соногашира реакция это реакция кросс-сочетания используется в органический синтез формировать углерод-углеродные связи. В нем работает палладий катализатор а также медь сокатализатор для образования углерод-углеродной связи между концевыми алкин и арил или винилгалогенид.[1]
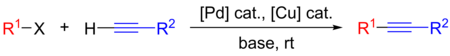 |
| Реакция Соногашира |
|---|
- р1: арил
- р2: арил или винил
- X: I, Br, Cl или OTf
Реакция кросс-сочетания Соногашира используется в самых разных областях из-за ее полезности для образования углерод-углеродных связей. Реакцию можно проводить в мягких условиях, таких как комнатная температура, в водной среде, и с мягким основанием, что позволило использовать реакцию кросс-сочетания Соногаширы в синтезе сложных молекул. Его приложения включают фармацевтические препараты, натуральные продукты, органические материалы и наноматериалы.[1] Конкретные примеры включают его использование в синтезе тазаротен,[2] что является лечением от псориаз и акне, и при приготовлении SIB-1508Y, также известного как Altinicline,[3] а никотиновый рецептор агонист.
История
Реакция алкинилирования арилгалогенидов с использованием ароматических ацетиленов была описана в 1975 году в трех независимых статьях Кассара.[4], Дик и Черт возьми[5] а также Соногашира, Тохда и Хагихара.[6] Во всех реакциях используют палладиевые катализаторы, чтобы получить одни и те же продукты реакции. Однако протоколы Кассара и Хека выполняются исключительно с использованием палладия и требуют жестких условий реакции (т.е. высоких температур реакции). Использование медь-сокатализатора в дополнение к комплексам палладия в методике Соногаширы позволило проводить реакции в мягких условиях реакции с отличными выходами. За этим последовало быстрое развитие систем Pd / Cu, которые сделали возможным множество синтетических применений, в то время как условия Кассара-Хека были оставлены, возможно, несправедливо, но почти забыты.[7] Замечательная полезность реакции может быть подтверждена количеством исследований, которые все еще проводятся по пониманию и оптимизации ее синтетических возможностей, а также по использованию процедур для получения различных соединений, имеющих синтетическое, медицинское или материальное / промышленное значение.[7] Среди реакций кросс-сочетания по количеству публикаций следует сразу после реакции Сузуки и Хека.[8] а поиск по термину "Sonogashira" в Scifinder дает более 1500 ссылок на журнальные публикации в период с 2007 по 2010 год.[7]
Реакция Соногашира стала настолько известной, что часто все реакции, в которых используется современный металлоорганический катализатор для соединения алкиновых мотивов, называют некоторыми вариант «реакции Соногашира», несмотря на то, что эти реакции не проводят в условиях истинной реакции Соногашира.[7]
Механизм
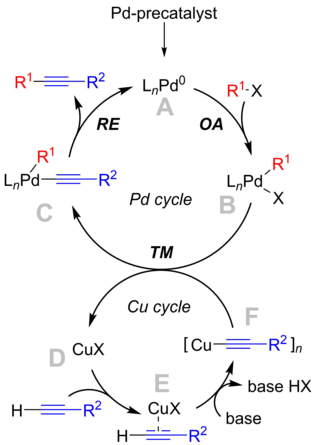
В механизм реакции не совсем понятно, но механизм учебника вращается вокруг цикла палладия, который согласуется с "классическим" перекрестная связь механизм и медный цикл, который менее известен.[9]
Палладиевый цикл
- Предварительный катализатор палладия активируется в условиях реакции с образованием реакционноспособного Pd0 соединение, А. Точная идентичность каталитических частиц сильно зависит от условий реакции. С простыми фосфинами, такими как PPh3 (n = 2), а в случае объемных фосфинов (т. е. P (о-Тол)3) было показано, что образуются монолигированные виды (n = 1).[10] Кроме того, некоторые результаты указывают на образование анионных частиц палладия, [L2Pd0Cl]− , которые могут быть настоящими катализаторами в присутствии анионов и галогенидов.[11]
- Активный Pd0 катализатор участвует в окислительная добавка шагать с арил или винилгалогенид субстрат для производства PdII виды B. Как и в предыдущем обсуждении, его структура зависит от используемых лигандов. Этот шаг считается ограничивающий шаг реакции.
- Сложный B реагирует с ацетилидом меди, сложным F, в трансметалляция шаг, дающий комплекс C и регенерацию медного катализатора.
- Структура комплекса C зависит от свойств лигандов. Для легкого восстановительное устранение для возникновения мотивы субстрата должны находиться в непосредственной близости, то есть в цис-ориентации, чтобы можно было транс-цис-изомеризация участвует. В восстановительное устранение продукт толан удаляется из комплекса, и активные каталитические частицы Pd регенерируются.
Медный цикл
- Медный цикл не совсем хорошо описан. Предполагается, что присутствие основания приводит к образованию π-алкинового комплекса E. Это увеличивает кислотность концевого протона и приводит к образованию ацетилида меди, комплекса F, при депротонировании.
- Ацетилид F затем участвует в реакция трансметаллирования с промежуточным палладием B.
Механизм варианта Соногаширы без меди
Хотя использование солей меди в «классической» реакции Соногашира благоприятно для эффективности реакции, оно сопровождается рядом недостатков, таких как применение экологически вредных реагентов, образование нежелательных гомосочетаний алкинов (Боковые продукты для глазера ), а также необходимость строгого исключения кислорода из реакционной смеси. Таким образом, с целью исключения меди из реакции было предпринято много усилий для разработки реакции Соногашира без Cu. Наряду с разработкой новых условий реакции многие экспериментальные и вычислительные исследования были сосредоточены на выяснении механизма реакции.[12] До недавнего времени точный механизм, с помощью которого происходит реакция без Cu, обсуждался, а критические механистические вопросы оставались без ответа.[7] Это было доказано в 2018 году Кошмрлем и др. что реакция идет по двум связанным между собой Pd0/ PdII каталитические циклы.[13]
![Механизм реакции Соногашира без Cu. [13]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/90/Cu-free-mechanism.png/642px-Cu-free-mechanism.png) |
| Механизм реакции Соногашира без Cu.[13] |
|---|
- Подобно оригинальному механизму, Pd0 цикл начинается с окислительного добавления арилгалогенид или трифлат к Pd0 катализатор, образующий комплекс B и активация арилгалогенидного субстрата для реакции.
- Ацетилен активируется во втором, PdII опосредованный цикл. Было доказано, что фенилацетилен образует моноацетилидный комплекс Pd. D а также бисацетилидный комплекс Pd F в мягких условиях реакции.
- Оба активированных вида, а именно комплексы B и F, участвуют в трансметалляция ступенька, образующая комплекс C и регенерирующий D.
- Полученные продукты восстановительное устранение, дизамещенный алкиновый продукт, а также регенерированный Pd0 каталитические частицы, завершают Pd0 каталитический цикл.
Было продемонстрировано, что амины конкурируют с фосфинами и могут также участвовать в качестве лигандов L в описанных реакционных формах. В зависимости от степени конкуренции между амином и фосфинами ожидается динамическое и сложное взаимодействие при использовании различных координационных оснований.[14][15][13]
Условия реакции
Реакция Соногашира обычно протекает в мягких условиях.[16] Перекрестное связывание проводят при комнатной температуре с основанием, обычно амином, таким как диэтиламин,[6] который также действует как растворитель. Реакционная среда должна быть основной, чтобы нейтрализовать галогенид водорода, образующийся как побочный продукт этой реакции сочетания, поэтому алкиламин такие соединения, как триэтиламин и диэтиламин иногда используются как растворители, но также можно использовать ДМФ или эфир в качестве растворителя. Иногда используются другие основания, такие как карбонат калия или карбонат цезия. Кроме того, для реакций сочетания Соногашира формально необходимы деаэрированные условия, поскольку комплексы палладия (0) нестабильны на воздухе, а кислород способствует образованию гомопаренных ацетиленов. В последнее время разработка стабильных на воздухе палладиевых катализаторов позволяет проводить эту реакцию в окружающей атмосфере. Кроме того, RM Al-Zoubi и его сотрудники успешно разработали метод с высокой региоселективностью для производных 1,2,3-тригалогенаренов в хорошем состоянии. до высоких урожаев в условиях окружающей среды[17].
Катализаторы
Обычно для этой реакции необходимы два катализатора: нулевой валент комплекс палладия и галогенид меди (I). Общие примеры палладиевых катализаторов включают катализаторы, содержащие фосфиновые лиганды такие как [Pd (PPh3)4]. Другой широко используемый источник палладия - это [Pd (PPh3)2Cl2], но комплексы, содержащие бидентатные фосфиновые лиганды, например [Pd (dppe ) Cl2], [Pd (dppp ) Cl2], и [Pd (dppf) Cl2] также использовались.[9] Недостатком таких катализаторов является необходимость высоких содержаний палладия (до 5 мол.%), А также большего количества сокатализатора меди.[9] PdII комплексы на самом деле предварительные катализаторы так как они должны быть восстановлены до Pd (0), прежде чем можно будет начать катализ. PdII комплексы обычно обладают большей стабильностью, чем Pd0 комплексы и могут храниться в обычных лабораторных условиях в течение нескольких месяцев.[18] PdII катализаторы восстанавливаются до Pd0 в реакционной смеси амин, а фосфин лиганд или другой реагент в смеси, позволяющий протекать реакции.[19] Например, окисление трифенилфосфин к оксид трифенилфосфина может привести к образованию Pd0 на месте когда [Pd (PPh3)2Cl2] используется.
Соли меди (I), такие как CuI, реагируют с концевым алкином и образуют ацетилид меди (I), который действует как активированный компонент для реакций сочетания. Cu (I) является сокатализатором реакции и используется для увеличения скорости реакции.[7]
Арилгалогениды и псевдогалогениды
Выбор субстрата арилгалогенида или псевдогалогенида (пр.2-углерод) является одним из факторов, которые в основном влияют на реакционную способность каталитической системы Соногашира. Реакционная способность галогенидов выше по отношению к йоду, а винилгалогениды более реакционноспособны, чем аналогичные арилгалогениды.
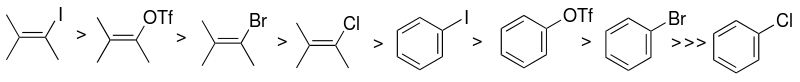
Вместо арилгалогенидов можно также использовать арилтрифлаты.
Предшественники арендиазония
Соли арендиазония были описаны как альтернатива арилгалогенидам для реакции сочетания Соногашира. Хлорид золота (I) использовался в качестве сокатализатора в сочетании с хлоридом палладия (II) при взаимодействии солей арендиазония с концевыми алкинами, в процессе, проводимом в присутствии хлорида бис-2,6-диизопропилфенил дигидроимидазолия (IPr NHC). (5 мол.%) До на месте образуют комплекс NHC-палладий и 2,6-ди-трет-бутил-4-метилпиридин (DBMP) в качестве основания в ацетонитриле в качестве растворителя при комнатной температуре.[20] Это сочетание можно проводить, исходя из анилинов, путем образования соли диазония с последующим на местеСочетание Соногашира, где анилины превращаются в диазониевую соль, а затем превращаются в алкин путем сочетания с фенилацетиленом.
Алкины
Для получения желаемых дизамещенных продуктов с удовлетворительными выходами можно использовать различные ароматические алкины. Алифатические алкины обычно менее реактивны.
Базы
Из-за решающей роли основания для протекания реакции необходимо добавлять определенные амины в избытке или в качестве растворителя. Было обнаружено, что вторичные амины, такие как пиперидин, морфолин или диизопропиламин, в частности, могут эффективно и обратимо реагировать с транс-RPdX (PPh3)2 комплексов путем замены одного PPh3 лиганд. Константа равновесия этой реакции зависит от R, X, фактора основности и стерических затруднений амина.[21] Результатом является конкуренция между амином и алкиновой группой за этот обмен лиганда, поэтому амин обычно добавляют в избытке, чтобы способствовать предпочтительному замещению.
Варианты реакции
Муфта Соногашира без содержания меди
В то время как сокатализатор меди добавляют в реакцию для увеличения реакционной способности, присутствие меди может привести к образованию димеров алкинов. Это приводит к тому, что известно как Муфта Glaser реакция, которая представляет собой нежелательное образование продуктов гомосочетания производных ацетилена при окисление. В результате при проведении реакции Соногаширы с сокатализатором меди необходимо проводить реакцию в инертный атмосфера, чтобы избежать нежелательной димеризации. Варианты реакции Соногашира без содержания меди были разработаны, чтобы избежать образования продуктов гомосцепления.[18][22] Существуют и другие случаи, когда следует избегать использования меди, например, реакции сочетания с участием субстратов, которые могут быть медными лигандами, например, свободное основание. порфирины.[9]
Обратная муфта Соногашира
В обратная муфта Соногашира реагенты представляют собой арильное или винильное соединение и алкинилгалогенид.[23]
Варианты катализатора
Сокатализ серебра
В некоторых случаях стехиометрические количества оксид серебра может использоваться вместо CuI для муфт Sonogashira без содержания меди.[9]
Никелевые катализаторы
Недавно было разработано катализируемое никелем сочетание Соногашира, которое позволяет связывать неактивированные алкилгалогениды с ацетиленом без использования палладия, хотя медный сокатализатор все еще необходим.[24] Также сообщалось, что золото можно использовать в качестве гетерогенного катализатора, что было продемонстрировано при связывании фенилацетилен и йодобензол с Au / CeO2 катализатор.[25][26] В этом случае катализ происходит неоднородно на наночастицах Au,[26][27] с Au (0) в качестве активного сайта.[28] Было обнаружено, что селективность к желаемому продукту кросс-сочетания повышается за счет таких носителей, как CeO2 и Ла2О3.[28] Кроме того, муфты Соногашира, катализируемые железом, были исследованы как относительно дешевые и нетоксичные альтернативы палладию. Здесь FeCl3 предлагается действовать как катализатор переходного металла, а Cs2CO3 в качестве основы, таким образом теоретически действуя по механизму без палладия и меди.[29]
- в 135 ° С, 72 ч[29]
Несмотря на то, что механизм, не содержащий меди, оказался жизнеспособным, попытки включить различные переходные металлы, упомянутые выше, в качестве менее дорогостоящих альтернатив палладиевым катализаторам, показали плохую историю успеха из-за загрязнения реагентов следовыми количествами палладия, что позволяет предположить что эти теоретические пути крайне маловероятны, если вообще возможны.[30]
Исследования показали, что органические и неорганические исходные материалы также могут содержать достаточно (ppb уровень) палладий для муфты.[31]
Сокатализ золота и палладия
Сообщалось об высокоэффективной комбинированной методике сочетания золота и палладия для сочетания Соногаширы широкого спектра электронно и структурно различных арил- и гетероарилгалогенидов.[32]Ортогональная реакционная способность двух металлов демонстрирует высокую селективность и экстремальную устойчивость к функциональным группам в соединении Соногашира. Краткое механистическое исследование показывает, что промежуточное соединение золото-ацетилид вступает в каталитический цикл палладия на стадии трансметаллирования.
Дендримерные комплексы палладия
Проблемы, связанные с извлечением часто дорогостоящего катализатора после образования продукта, представляют собой серьезный недостаток для крупномасштабных применений гомогенного катализа.[9] Структуры, известные как металлодендримеры, сочетают в себе преимущества гомогенных и гетерогенных катализаторов, поскольку они растворимы и хорошо определены на молекулярном уровне, и, тем не менее, они могут быть восстановлены осаждением, ультрафильтрацией или ультрацентрифугированием.[33] Можно найти некоторые недавние примеры использования дендритных палладиевых комплексных катализаторов для реакции Соногашира, не содержащей меди. Таким образом, несколько поколений полиаминодендритных катализаторов бидентатного фосфинпалладия (II), солюбилизированных в триэтиламине, использовали для сочетания арилиодидов и бромидов при 25-120 ° C и арилхлоридов, но с очень низкими выходами.[34]Дендримерные катализаторы обычно могут быть извлечены простым осаждением и фильтрацией и повторно использованы до пяти раз, при этом наблюдается снижение активности, вызванное разложением дендримеров, а не выщелачиванием палладия. Эти дендримерные катализаторы показали отрицательный дендритный эффект; то есть эффективность катализатора снижается по мере увеличения образования дендримеров. Перерабатываемый полимерный фосфиновый лиганд, показанный ниже, получен при метатезисной полимеризации с раскрытием цикла производного норборнена и был использован в катализируемой медью реакции Соногашира метилпиодбензоата и фенилацетилена с использованием Pd (dba).2• CHCl3 в качестве источника палладия.[35] Несмотря на извлечение фильтрацией, каталитическая активность полимера снижалась примерно на 4-8% в каждом эксперименте по рециркуляции.
Лиганды азота
Пиридины и пиримидины показали хорошие комплексообразующие свойства палладия и были использованы для образования катализаторов, подходящих для сочетаний Соногашира. Дипиримидил-палладиевый комплекс, показанный ниже, был использован в реакции связывания йода, брома и хлорбензола с фенилацетиленом без содержания меди с использованием N-бутиламина в качестве основания в растворителе ТГФ при 65 ° C. Кроме того, все структурные особенности этого комплекса были охарактеризованы обширным рентгеновским анализом, подтверждающим наблюдаемую реакционную способность.[36]
Совсем недавно был получен дипиридилпалладиевый комплекс, который использовали в реакции сочетания Соногашира арилиодидов и бромидов без содержания меди в N-метилпирролидиноне (NMP) с использованием ацетата тетра-н-бутиламмония (TBAA) в качестве основания при комнатной температуре. Этот комплекс также использовался для связывания арилиодидов и бромидов в кипящей воде в качестве растворителя и в присутствии воздуха с использованием пирролидина в качестве основания и TBAB в качестве добавки,[37] хотя его эффективность была выше в N-метилпирролидиноне (NMP) в качестве растворителя.
N-гетероциклический карбен (NHC) комплексы палладия
N-гетероциклические карбены (NHC) стали одними из наиболее важных лигандов в катализе переходных металлов. Успех нормальных NHC во многом объясняется их превосходной способностью к донорству σ по сравнению с фосфинами, которая даже больше у ненормальных аналогов NHC. Применяемые в качестве лигандов в комплексах палладия, NHC вносят большой вклад в стабилизацию и активацию предкатализаторов и поэтому нашли применение во многих областях металлоорганического гомогенного катализа, включая соединения Соногашира.[9][38][39]
 |  |
| Пример комплекса производного палладия (II) с нормальным лигандом NHC.[40] | Эффективный яКатализатор PEPPSI для реакции Соногашира без Cu в воде.[38] |
Интересные примеры аномальных NHC основаны на мезоионной структуре 1,2,3-триазол-5-илидена. Эффективный катионный палладиевый катализатор ПЕППСИ тип, т.е. яПЕППСИ (явнутренний пиридинеулучшенный прекатализатор пвозмещение sтабилизация и янитиация), как было продемонстрировано, эффективно катализирует реакцию Соногашира без меди в воде как единственном растворителе в аэробных условиях в отсутствие меди, аминов, фосфинов и других добавок.[38]
Приложения в синтезе
Муфты Соногашира используются в широком спектре синтетических реакций, в первую очередь благодаря их успеху в проведении следующих сложных преобразований:
Реакции алкинилирования
Сочетание концевого алкина и ароматического кольца является ключевой реакцией, когда речь идет о применении реакции Соногашира с добавлением меди или без нее. Список случаев, когда применялась типичная реакция Соногашира с использованием арилгалогенидов, велик, и выбор иллюстративных примеров затруднен. Недавнее использование этой методологии показано ниже для сочетания йодированного фенилаланина с концевым алкином, полученным из d-биотин с использованием на месте генерировал частицы Pd (0) в качестве катализатора, что позволило получить производное фенилаланина с алкильной связью для биоаналитических применений.[41] Существуют также примеры связывания обоих партнеров с аллильными смолами, при этом катализатор Pd (0) влияет на расщепление субстратов и последующее связывание по Соногаши в растворе.[42]

Натуральные продукты
Многие метаболиты, встречающиеся в природе, содержат алкиновые или ениновые фрагменты, и поэтому реакция Соногашира часто находила применение при их синтезе.[43] Некоторые из самых последних и многообещающих применений этой методологии сочетания к полному синтезу природных продуктов использовали исключительно типичную реакцию сокатализируемой медью.
Пример сочетания арилиодида с арилацетиленом можно увидеть в реакции йодированного спирта и трис (изопропил) силилацетилена, которая дала алкин, промежуточное соединение в общем синтезе бензинденоазепинового алкалоида булгарамина.
Есть и другие недавние примеры использования арилиодидов для получения промежуточных продуктов в типичных условиях Соногашира, которые после циклизации дают натуральные продукты, такие как бензилизохинолин. [44] или индольные алкалоиды[45] Примером может служить синтез бензилизохинолин алкалоиды (+)-(S)-лауданозин и (-)-(S) -ксилопинин. Синтез этих природных продуктов включал использование перекрестного связывания Соногаширы для построения углеродного скелета каждой молекулы.[46]

Enynes и enediynes
Фрагмент 1,3-енина является важной структурной единицей для биологически активных и природных соединений.[нужна цитата ] Его можно получить из виниловых систем и концевых ацетиленов с помощью стереоспецифической процедуры сохранения конфигурации, такой как реакция Соногашира. Винилиодиды являются наиболее реакционноспособными винилгалогенидами по отношению к Pd.0 окислительное добавление, и поэтому их использование наиболее часто используется для реакций кросс-сочетания Соногашира из-за обычно используемых более мягких условий. Вот некоторые примеры:
- Thongsornkleeb C .; Данхайзер Р. Л. (2005). «Сочетание 2-йод-проп-2-енола с широким спектром ацетиленов, таких как TMSA, с образованием енинилового спирта, который может быть окислен до соответствующих R-алкинилированных акролеинов». Журнал органической химии. 70: 2364. Дои:10.1021 / jo047869a. ЧВК 2897060. PMID 15760233.
- Получение алк-2-инилбута-1,3-диенов перекрестным сочетанием дииодида и фенилацетилена, как показано ниже.[47]

Фармацевтические препараты
Универсальность реакции Соногаширы делает ее широко используемой реакцией в синтезе различных соединений. Одним из таких фармацевтических применений является синтез SIB-1508Y, более известного как Altinicline. Altinicline - это никотиновый рецептор ацетилхолина агонист, который показал потенциал в лечении болезни Паркинсона, болезни Альцгеймера, синдрома Туретта, шизофрении и синдрома дефицита внимания с гиперактивностью (СДВГ).[3][48] По состоянию на 2008 год Алтиниклин прошел II фазу клинических испытаний.[49][50]

Реакция кросс-сочетания Соногашира может быть использована в синтезе производных имидазопиридина.[51]

Связанные реакции
использованная литература
- ^ а б Соногашира, К. (2002), "Разработка Pd-Cu катализируемого кросс-сочетания концевых ацетиленов с sp2-галогениды углерода », J. Organomet. Chem., 653 (1–2): 46–49, Дои:10.1016 / s0022-328x (02) 01158-0
- ^ King, A.O .; Ясуда, Н. (2005), "Практический и эффективный процесс получения тазаротена", Верхний. Органомет. Chem., 9 (5): 646–650, Дои:10.1021 / op050080x
- ^ а б c King, A.O .; Ясуда, Н. (2004), "Катализируемые палладием реакции перекрестного связывания в синтезе металлоорганических соединений фармацевтических препаратов в технологической химии", Верхний. Органомет. Chem., Разделы металлоорганической химии, 6: 205–245, Дои:10.1007 / b94551, ISBN 978-3-540-01603-8
- ^ Кассар, Л. (1975), «Синтез арил- и винилзамещенных производных ацетилена с использованием комплексов никеля и палладия», J. Organomet. Chem., 93 (2): 253–257, Дои:10.1016 / S0022-328X (00) 94048-8
- ^ Dieck, H.A .; Хек, Р.Ф. (1975), "Катализируемый палладием синтез арильных, гетероциклических и виниловых производных ацетилена", J. Organomet. Chem., 93 (2): 259–263, Дои:10.1016 / S0022-328X (00) 94049-X
- ^ а б Sonogashira, K .; Tohda, Y .; Хагихара, Н. (1975), "Удобный синтез ацетиленов: каталитические замещения ацетиленового водорода бромалкенами, йодаренами и бромпиридинами", Tetrahedron Lett., 16 (50): 4467–4470, Дои:10.1016 / с0040-4039 (00) 91094-3
- ^ а б c d е ж г Chinchilla, R .; Нахера, К. (2011), «Последние достижения в реакциях Соногаширы», Chem. Soc. Ред., 40 (10): 5084–5121, Дои:10.1039 / c1cs15071e, PMID 21655588
- ^ Seechurn, C. C. C .; Китчинг, М. О .; Colacot, T.J .; Сницкус, В. (2012), «Катализированная палладием перекрестная связь: исторический контекстуальный взгляд на Нобелевскую премию 2010 года», Энгью. Chem. Int. Эд., 51 (21): 5062–5085, Дои:10.1002 / anie.201107017, PMID 22573393
- ^ а б c d е ж г час Chinchilla, R .; Нахера, К. (2007), «Реакция Соногашира: быстро развивающаяся методология в синтетической органической химии», Chem. Ред., 107 (3): 874–922, Дои:10.1021 / cr050992x, PMID 17305399
- ^ Stambuli, J. P .; Buhl, M .; Хартвиг, Дж. Ф. (2002), «Синтез, характеристика и реакционная способность мономерных, галогенидных комплексов арилпалладия с затрудненным фосфином в качестве единственного дательного лиганда», Варенье. Chem. Soc., 124 (32): 9346–9347, Дои:10.1021 / ja0264394, PMID 12167009
- ^ Amatore, C .; Ютанд, А. (2000), "Анионные промежуточные соединения Pd (0) и Pd (II) в катализируемых палладием реакциях Гека и перекрестной связи", Соотв. Chem. Res., 33 (5): 314–321, CiteSeerX 10.1.1.612.7347, Дои:10.1021 / ar980063a
- ^ Сохейли, А .; Albaneze-Walker, J .; Murry, J. A .; Dormer, P. G .; Хьюз, Д. Л. (2003), "Эффективный и общий протокол для связывания Соногаширы арилбромидов без содержания меди при комнатной температуре", Орг. Lett., 5 (22): 4191–4194, Дои:10.1021 / ol035632f
- ^ а б c d Газвода, Мартин; Вирант, Миха; Пинтер, Балаш; Кошмрль, Янез (16 ноября 2018 г.). «Механизм реакции Соногашира без меди действует через превращение палладия в палладий». Nature Communications. 9 (1). Дои:10.1038 / s41467-018-07081-5. ЧВК 6240041. PMID 30446654.
- ^ Tougerti, A .; Negri, S .; Джутанд, А. (2007), "Механизм реакций Сонагашира, катализируемых палладием, не содержащих медь: множественная роль аминов", Chem. Евро. Дж., 13 (2): 666–676, Дои:10.1002 / chem.200600574, PMID 16991183
- ^ Пленио, Х. (2008), «Катализаторы для взаимодействия Соногашира - Без Короны снова станет королем», Энгью. Chem. Int. Эд., 47 (37): 6954–6956, Дои:10.1002 / anie.200802270, PMID 18683173
- ^ Конен, А.Л; Данхайзер, Р. Л.; Дания S. E .; Лю X. (2007), "Синтез концевых 1,3-дийнов посредством связывания Соногашира винилиденхлорида с последующим отщеплением. Получение 1,3-декадиина", Органический синтез, 84: 77–87, Дои:10.15227 / orgsyn.084.0077, ЧВК 2901882, PMID 20628544
- ^ Аль-Зуби, Раед (16 апреля 2020 г.). «Катализируемые палладием высокорегиоселективные реакции моно- и двойного кросс-сочетания Соногашира 5-замещенного-1,2,3-трийодбензола в условиях окружающей среды †». RSC Advances. 10 (28): 16376. Дои:10.1039 / d0ra01569e. Получено 21 июля 2020.
- ^ а б Bohm, V.P.W .; Херрманн, В. А. (2000), "Процедура без содержания меди для катализируемой палладием реакции Соногашира арилбромидов с концевыми алкинами при комнатной температуре", Европейский журнал органической химии, 200 (22): 3679–3681, Дои:10.1002 / 1099-0690 (200011) 2000: 22 <3679 :: aid-ejoc3679> 3.0.co; 2-x
- ^ Инь, Л .; Либшер, Дж. (2006), "Реакции углерод-углеродного взаимодействия, катализируемые гетерогенными палладиевыми катализаторами", Chem. Ред., 107 (1): 133–173, Дои:10.1021 / cr0505674, PMID 17212474
- ^ Панда Б., Саркар Т. К. (2010). «Золото и палладий в сочетании для кросс-сочетания солей арендиазония по типу Соногашира». Chem. Сообщество. 46: 3131–3133. Дои:10,1039 / c001277g.
- ^ Jutand, A .; Négri, S .; Принципо; А. (2005), «Образование комплексов ArPdXL (амин) путем замены одного фосфанового лиганда амином в комплексах транс-ArPdX (PPh3) 2», Европейский журнал неорганической химии, 2005 (4): 631–635, Дои:10.1002 / ejic.200400413
- ^ Mery, D .; Heuze, K .; Astruc, D. (2003), "Очень эффективный палладиевый катализатор, не содержащий меди, для реакции Соногашира с арилгалогенидами", Chem. Commun., 15 (15): 1934–1935, Дои:10.1039 / B305391C
- ^ Дудник, А .; Геворгян, В. (2010). «Формальная обратная реакция Соногаширы: прямое алкинилирование аренов и гетероциклов с помощью алкинилгалогенидов». Angewandte Chemie International Edition на английском языке. 49 (12): 2096–2098. Дои:10.1002 / anie.200906755. ЧВК 3132814. PMID 20191647.
- ^ Вечоркин, О .; Бармаз, Д .; Пруст, В .; Ху, X. (2009), "Соногаширское связывание неактивированных алкилгалогенидов, катализируемое никелем: ортогональная функционализация алкилйодидов, бромидов и хлоридов", Варенье. Chem. Soc., 131 (34): 12078–12079, Дои:10.1021 / ja906040t, PMID 19670863
- ^ Gonzalez-Arallano, C .; Абад, А .; Corma, A .; Garcia, H .; Иглесиас, М .; Санчес, Ф. (2007), "Катализ золотом (I) и золотом (III): параллелизм между гомо- и гетерогенными катализаторами для реакций перекрестного связывания Соногашира без меди", Энгью. Chem. Int. Эд., 46 (9): 1536–1538, Дои:10.1002 / anie.200604746, PMID 17226890
- ^ а б Corma, A .; Juarez, R .; Боронат, М .; Санчес, Ф .; Иглесиас, М .; Гарсиа, Х. (2011), «Золото катализирует реакцию сочетания Соногашира, не требуя примесей палладия», Chem. Commun., 47 (5): 1446–1448, Дои:10.1039 / C0CC04564K, PMID 21183985
- ^ Kyriakou, G .; Beaumont, S.K .; Хамфри, С. М .; Антонетти, С .; Ламберт, Р. М. (2010), "Сцепление Соногашира, катализируемое наночастицами золота: доминирует гомогенный или гетерогенный катализ?", ChemCatChem, 2 (11): 1444–1449, Дои:10.1002 / cctc.201000154
- ^ а б Beaumont, S.K .; Kyriakou, G .; Ламберт, Р. М. (2010), «Идентичность активного центра в катализируемом золотыми наночастицами сочетании Соногашира фенилацетилена и йодбензола». (PDF), Варенье. Chem. Soc., 132 (35): 12246–12248, Дои:10.1021 / ja1063179
- ^ а б М. Каррил; А. Корреа; К. Больм (2008), "Катализируемая железом реакция Соногашира", Энгью. Chem., 120 (26): 4940–4943, Дои:10.1002 / ange.200801539
- ^ Торстен Лаутербах; Мадлен Ливендаль; Антонио Роселлон; Пабло Эспине; Антонио М. Эчаваррен (2010 г.), «Невероятность реакций связывания Соногашира, не содержащих палладия, золота (I)», Органические буквы, 12 (13): 3006–3009, Дои:10.1021 / ol101012n
- ^ Tolnai, L.G .; Гонда, ЗС .; Новак, З. (2010). "Резкое влияние уровней палладия в миллиардных долях на" катализируемую медью "муфту Соногашира". Химия: европейский журнал. 16 (39): 11822–11826. Дои:10.1002 / chem.201001880.
- ^ Панда, Б .; Саркар, Т. К. (2013), "Золото и палладий в сочетании для взаимодействия Соногашира арил- и гетероарилгалогенидов", Синтез, 45 (6): 817–829, Дои:10.1055 / с-0032-1318119
- ^ Астрюк, Дидье; Heuzé, Карин; Гатар, Сильвен; Мери, Дениз; Нлате, Сильвен; Plault, Lauriane (февраль 2005 г.). «Металлодендритный катализ окислительно-восстановительных реакций и реакций образования углеродных связей: шаг к зеленой химии». Расширенный синтез и катализ. 347 (2–3): 329–338. Дои:10.1002 / adsc.200404247.
- ^ Heuzé, Карин; Мери, Дениз; Гаусс, Доминик; Астрюк, Дидье (2003). «Не содержащие меди, восстанавливаемые дендритные катализаторы Pd для реакции Соногашира». Chem. Commun. (18): 2274–2275. Дои:10.1039 / B307116M.
- ^ Ян, Юнь-Чин; Лух, Тянь-Яу (декабрь 2003 г.). «Полимерный фосфиновый лиганд из реакции метатезиса с раскрытием цикла производного норборнена. Применение в реакциях Хека, Соногашира и Негиши». Журнал органической химии. 68 (25): 9870–9873. Дои:10.1021 / jo035318z. PMID 14656129.
- ^ Buchmeiser, Michael R .; Шареина, Томас; Кемпе, Ретт; Вурст, Клаус (2001). «Палладиевые катализаторы на основе бис (пиримидина): синтез, рентгеновская структура и применение в соединениях Хека, Судзуки, Соногашира-Хагихара и реакциях аминирования». J. Organomet. Chem. 634: 39–46. Дои:10.1016 / S0022-328X (01) 01083-X.
- ^ Gil-Moltó, J .; Karström, S .; Nájera, C. (2005), «Комплекс ди (2-пиридил) метиламин – дихлорид палладия, ковалентно закрепленный на сополимере стирола и малеинового ангидрида в качестве восстанавливаемого катализатора для реакций кросс-сочетания C – C в воде», Тетраэдр, 61 (51): 12168–12176, Дои:10.1016 / j.tet.2005.08.122
- ^ а б c Газвода, М .; Вирант, М; Pevec, A .; Urankar, D .; Bolje, A .; Кочевар, М .; Кошмрль, J. (2016), "мезоионный бис (Py-tzNHC) комплекс палладия (II) катализирует зеленую реакцию Соногашира с помощью беспрецедентного механизма », Chem. Commun., 52 (8): 1571–1574, Дои:10.1039 / c5cc08717a, PMID 26575368
- ^ Crudden, Cathleen M .; Аллен, Дэрил П. (декабрь 2004 г.). «Стабильность и реакционная способность N-гетероциклических карбеновых комплексов». Обзоры координационной химии. 248 (21–24): 2247–2273. Дои:10.1016 / j.ccr.2004.05.013.
- ^ Batey, R.A .; Шен, М .; Лох, А. Дж. (2002), "Карбамоил-замещенный N-Гетероциклические карбеновые комплексы палладия (II): применение в реакциях поперечного связывания Соногашира », Органические буквы, 4 (9): 1411–1414, Дои:10,1021 / ol017245g
- ^ а б Corona C .; Bryant B.K .; Артерберн Дж. Б. (1883). Органические буквы. 2006: 8. Отсутствует или пусто
| название =(Помогите) - ^ Tulla-Puche J .; Бараны Г. (2005). «Разработка реакций переноса смолы на смолу (RRTR) с использованием химии Sonogashira». Тетраэдр. 61: 2195. Дои:10.1016 / j.tet.2004.12.029.
- ^ Хонг Б.-К., Нимье Р. Ю. (2006). Современная органическая химия. 10: 2191. Отсутствует или пусто
| название =(Помогите) - ^ Муджахидин, Д .; Дой, С. Европейский журнал органической химии 2005, 2689
- ^ Pedersen J.M .; Bowman W. R .; Эльсегуд М. Р. Дж .; Флетчер А. Дж .; Ловелл П. Дж. (2005). Журнал органической химии. 70: 10615. Отсутствует или пусто
| название =(Помогите) - ^ а б Муджахидин, Дидин; Дой, Свен (1 июля 2005 г.). «Энантиоселективный синтез (+) - (S) -Лауданозин и (-) - (S) -Ксилопинин ». Европейский журнал органической химии. 2005 (13): 2689–2693. Дои:10.1002 / ejoc.200500095.
- ^ а б Shao, L.-X .; Ши, М. (2005), "Простой синтез 2-алкинилбута-1,3-диенов с помощью методологии кросс-сочетания Соногашира", J. Org. Chem., 70 (21): 8635–8637, Дои:10.1021 / jo051434l, PMID 16209628
- ^ Bleicher, L.S .; Cosford, N.D.P .; Herbaut, A .; McCallum, J. S .; Макдональд, И. А. (1998), "Практический и эффективный синтез селективного нейронального агониста ионных каналов, управляемых ацетилхолином (S) - (-) - 5-Этинил-3- (1-метил-2-пирролидинил) пиридин малеат (SIB-1508Y) », Журнал органической химии, 63 (4): 1109–1118, Дои:10.1021 / jo971572d
- ^ Ван, Дэвид X .; Бут, Хизер; Лернер-Мармарош, Николь; Osdene, Thomas S .; Абуд, Лео Г. (1 сентября 1998 г.). «Соотношения структура-активность для аналогов никотина, сравнивающие конкуренцию за связывание [3H] никотина и психотропную активность». Исследования в области разработки лекарств. 45 (1): 10–16. Дои:10.1002 / (SICI) 1098-2299 (199809) 45: 1 <10 :: AID-DDR2> 3.0.CO; 2-G.
- ^ Исследование Паркинсона, группа (14 февраля 2006 г.). «Рандомизированное плацебо-контролируемое исследование никотинового агониста SIB-1508Y при болезни Паркинсона». Неврология. 66 (3): 408–410. Дои:10.1212 / 01.wnl.0000196466.99381.5c. PMID 16476941.
- ^ а б Бахерад, М .; Nasr-Isfahani, H .; Keivanloo, A .; Доостмохаммади, Н. (2008), "Pd-Cu катализируемая гетероциклизация во время сочетания Соногашира: синтез 2-бензилимидазо [1,2-а] пиридин », J. Organomet. Chem., 49 (23): 3819–3822, Дои:10.1016 / j.tetlet.2008.03.141

![Предлагаемая реакция сочетания, катализируемая железом { displaystyle { begin {matrix} {} { ce {{R - ! { Equiv} ! - H} + Ar-X -> [{ ce {FeCl3, dmeda}}] [ { ce {Cs2CO3, PhMe}}] R - ! { Equiv} ! - Ar}} {} end {matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f49d721cc5e4a53214d4c4f87b2f00b667e6210d)