Сузуки реакция - Suzuki reaction
| Сузуки реакция | |
|---|---|
| Названный в честь | Акира Сузуки |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | suzuki-сцепление |
| RSC ID онтологии | RXNO: 0000140 |
В Сузуки реакция является органическая реакция, классифицируется как реакция кросс-сочетания, где партнерами связи являются бороновая кислота и органо-галогенид и катализатор это комплекс палладия (0).[1][2][3] Впервые он был опубликован в 1979 г. Акира Сузуки, и он поделился 2010 Нобелевская премия по химии с Ричард Ф. Хек и Эй-ичи Негиси за их вклад в открытие и развитие катализируемых палладием перекрестных взаимодействий в органическом синтезе.[4] Эта реакция также известна как Реакция Сузуки – Мияуры и, как Муфта Suzuki. Он широко используется для синтезировать полиолефины, стиролы, и заменил бифенилы. Было опубликовано несколько обзоров, описывающих достижения и развитие реакции Сузуки.[5][6][7] Общая схема реакции Сузуки показана ниже, где одинарная связь углерод-углерод образуется путем сочетания борорганический виды (R1-К2) с галогенид (Р2-X) с помощью палладий катализатор и основание.
(Уравнение 1)
Механизм реакции
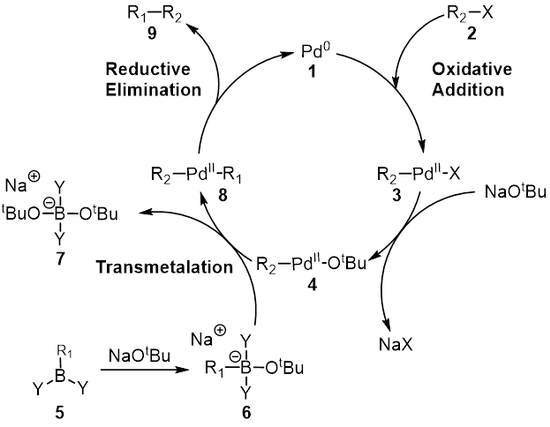
В механизм реакции Сузуки лучше всего рассматривать с точки зрения палладиевого катализатора. 1. Первый шаг - это окислительная добавка палладия в галогенид 2 сформировать органопалладий разновидность 3. Реакция (метатезис ) с базой дает средний 4, который через трансметалляция[8] с боромел комплекс 6 (образуется в результате реакции бороновой кислоты 5 с основанием) образует органопалладий разновидность 8. Восстановительное устранение желаемого продукта 9 восстанавливает оригинальный палладиевый катализатор 1 что завершает каталитический цикл. Сцепление Suzuki происходит при наличии базы, и долгое время роль базы не была полностью изучена. Сначала считалось, что основание образует триалкилборат (R3B-OR), в случае реакции триалкилборана (BR3) и алкоксид (−ИЛИ ЖЕ); этот вид можно рассматривать как более нуклеофильный а затем более реакционноспособен по отношению к комплексу палладия, присутствующему на стадии трансметаллирования.[9][10][11] Дюк с соавторами исследовали роль основания в механизме реакции сочетания Сузуки и обнаружили, что основание выполняет три роли: образование палладиевого комплекса [ArPd (OR) L2], образование триалкилбората и ускорение стадии восстановительного элиминирования реакцией алкоксида с комплексом палладия.[9]
Окислительное добавление
В большинстве случаев окислительная добавка - это этап определения ставки каталитического цикла.[12] На этом этапе палладиевый катализатор подвергается действию окисленный от палладия (0) до палладия (II). Палладиевый катализатор 1 сочетается с алкилгалогенидом 2 с образованием палладиевого комплекса 3. Как видно на диаграмме ниже, окислительная добавка шаг ломает углерод -галоген связь, где палладий теперь привязан к обоим галоген и группа R.
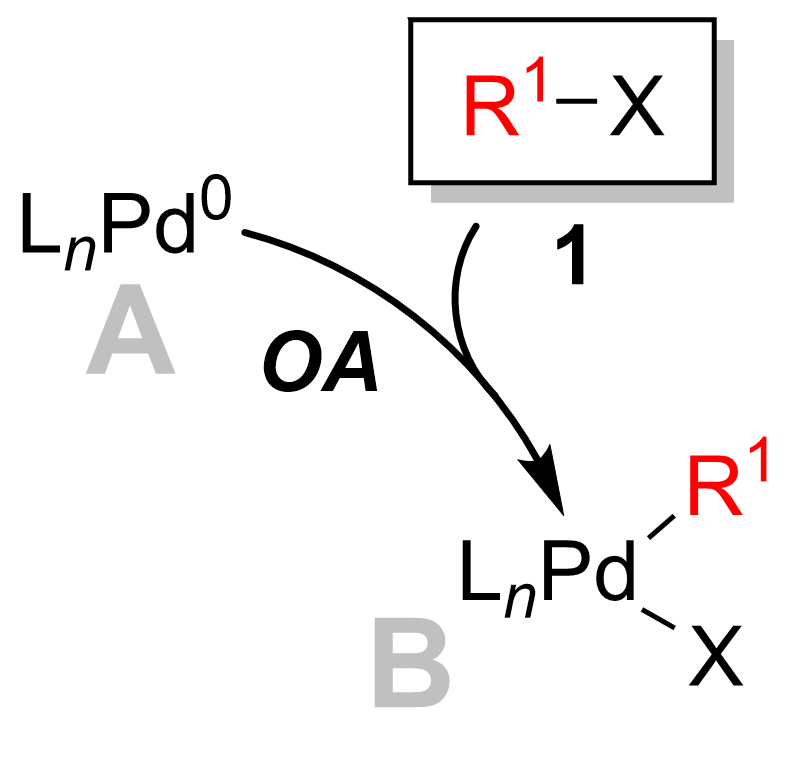
Окислительное добавление протекает с сохранением стереохимия с винилгалогениды, давая инверсия стереохимии с аллильный и бензиловый галогениды.[13] Окислительная добавка первоначально образует СНГ –Палладиевый комплекс, который быстро изомеризуется в транс-комплекс.[14]

Сочетание Suzuki происходит с сохранением конфигурации двойных связей как для борорганического реагента, так и для галогенида.[15] Однако конфигурация этой двойной связи, СНГ или же транс определяется цис-транс-изомеризацией палладиевого комплекса на стадии окислительного присоединения, где транс-палладиевый комплекс является преобладающей формой. Когда борорганическое соединение присоединено к двойной связи и связано с алкенилгалогенидом, продукт представляет собой диен, как показано ниже.

Трансметалляция
Трансметалляция - это металлоорганический реакция где лиганды переходят от одного вида к другому. В случае сочетания Сузуки лиганды переносятся из борорганических соединений. 6 к комплексу палладия (II) 4 где основание, добавленное на предыдущем этапе, заменяется на R1 заместитель на борорганических соединениях с образованием нового комплекса палладия (II) 8. Точный механизм трансметаллирования муфты Suzuki еще предстоит выяснить. Борорганические соединения не претерпевают трансметаллирования в отсутствие основания, и поэтому широко распространено мнение, что роль основания заключается в активации борорганического соединения, а также в облегчении образования R2-Pdll-OтБу из R2-Pdll-ИКС.[12]

Восстановительное устранение
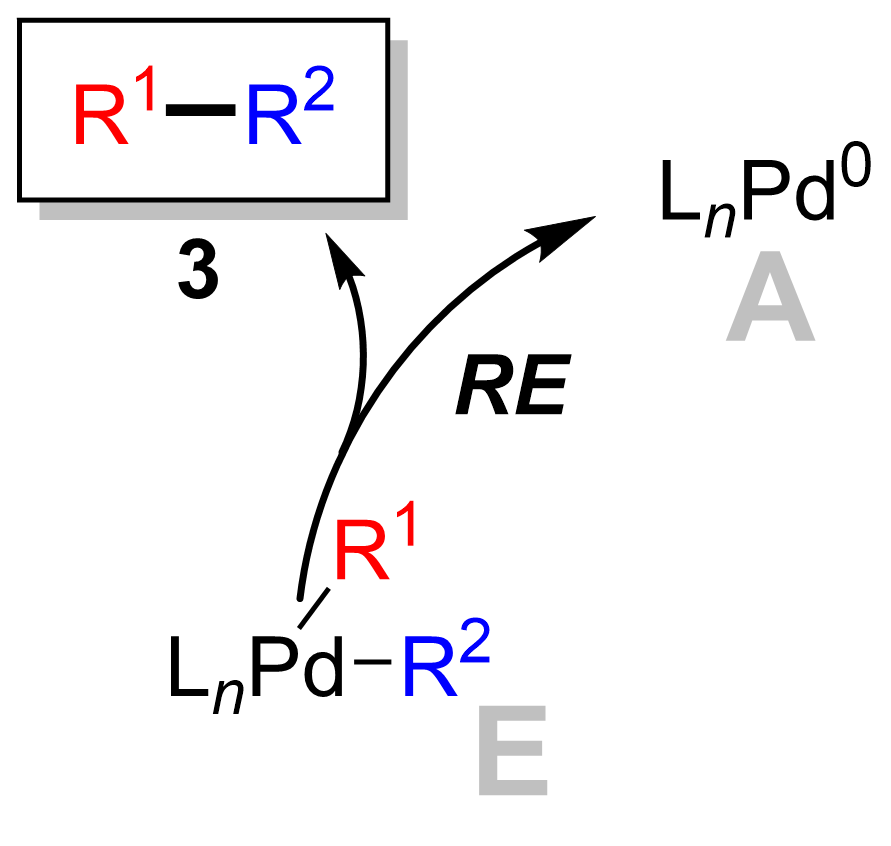
Заключительным этапом является этап восстановительного отщепления, на котором комплекс палладия (II) (8) исключает продукт (9) и регенерирует палладиевый (0) катализатор (1). С помощью маркировка дейтерием, Риджуэй и другие. показали, что восстановительное устранение протекает с сохранением стереохимии.[16]
Преимущества
Преимущества сочетания Сузуки по сравнению с другими подобными реакциями включают доступность обычных бороновых кислот, мягкие условия реакции и ее менее токсичный характер. Бороновые кислоты менее токсичны и безопаснее для окружающей среды, чем оловоорганическое вещество и цинкорганические соединения. Неорганические побочные продукты легко удалить из реакционной смеси. Кроме того, эта реакция предпочтительна, поскольку в ней используются относительно дешевые и легко получаемые реагенты. Возможность использовать воду как растворитель[17] делает эту реакцию более экономичной, экологичной и практичной для использования с различными водорастворимыми реагентами. Для муфты Suzuki можно использовать широкий спектр реагентов, например, арил - или же винил -борные кислоты и арил - или же винил -галогениды. Работа также расширила объем реакции за счет включения алкилбромидов.[18] В дополнение к тому, что для реакции сочетания Сузуки возможно множество различных типов галогенидов, реакция также работает с псевдогалогениды Такие как трифлаты (OTf), в качестве замены для галогениды. Относительная реакционная способность партнера связывания с галогенидом или псевдогалогенидом составляет: R2–I> R2–OTf> R2–Br >> R2–Cl. Бороновые эфиры и органотрифторборатные соли может использоваться вместо бороновой кислоты. Катализатором также может быть палладий. катализатор на основе наноматериалов.[19] С романом органофосфин лиганд (SPhos ), сообщалось о содержании катализатора до 0,001 мол.%:[20] Эти достижения и общая гибкость процесса сделали муфту Suzuki широко применяемой для химического синтеза.
Приложения
Промышленное применение
Реакция сочетания Сузуки масштабируема и рентабельна для использования в синтезе промежуточных продуктов для фармацевтические препараты или же тонкие химикаты.[21] Реакция Сузуки когда-то ограничивалась высоким уровнем катализатора и ограниченной доступностью бороновые кислоты. Замены для галогениды также были обнаружены, увеличивая количество партнеров по сцеплению для галогенид или же псевдогалогенид также. Были проведены реакции в расширенном масштабе при синтезе ряда важных биологических соединений, таких как CI-1034, в котором использовался тройной и бороновая кислота партнеры по связыванию, которые использовали в масштабе 80 кг с выходом 95%.[22]
Другим примером является сочетание 3-пиридилборана и 1-бром-3- (метилсульфонил) бензола, которое образовало промежуточное соединение, которое было использовано в синтезе потенциального агента центральной нервной системы. В результате реакции сочетания с образованием промежуточного продукта (278 кг) получали выход 92,5%.[15][21]

Значительные усилия были приложены к разработке гетерогенных катализаторов для реакции Suzuki CC, мотивированные увеличением производительности промышленного процесса (устранение отделения катализатора от подложки), и недавно было показано, что одноатомный гетерогенный катализатор Pd превосходит по характеристикам однородный промышленный Pd по умолчанию (PPh3)4 катализатор.[23]
Синтетические приложения
Муфта Сузуки часто используется при синтезе комплексных соединений.[24][25] Муфта Suzuki использовалась на цитронеллаль производная для синтеза капаратриен, натуральный продукт, который очень активен против лейкемии:[26]

Вариации
Металлический катализатор
Были разработаны различные каталитические применения металлов, отличных от палладия (особенно никеля).[27] О первой реакции кросс-сочетания, катализируемой никелем, сообщили Percec и его сотрудники в 1995 году с использованием арилмезилатов и бороновых кислот.[28] Хотя больше никеля катализатор было необходимо для реакции, около 5 мол.%, никель не так дорого или как драгоценный металл как палладий. Катализируемая никелем реакция сочетания Сузуки также позволила ряд соединений, которые не работали или работали хуже для системы, катализируемой палладием, чем система, катализируемая никелем.[27] Использование никелевых катализаторов позволило получить электрофилы, что оказалось сложной задачей для оригинального сочетания Suzuki с использованием палладия, включая такие субстраты, как фенолы, ариловые эфиры, сложные эфиры, фосфаты и фториды.[27]

Исследования перекрестного связывания, катализируемого никелем, продолжались и расширили масштабы реакции после того, как были продемонстрированы эти первые примеры и возрос исследовательский интерес. Мияура и Инада сообщили в 2000 году, что более дешевый никелевый катализатор может быть использован для перекрестная связь, с помощью трифенилфосфин (PPh3) вместо более дорогого лиганды бывшего употребления.[29] Однако перекрестное связывание, катализируемое никелем, по-прежнему требует высоких загрузок катализатора (3-10%), требует избытка лиганда (1-5 эквивалентов) и остается чувствительным к воздуху и влаге.[27] Достижения Хана и его сотрудников были направлены на решение этой проблемы путем разработки метода с использованием малых количеств никелевого катализатора (<1 мол.%) И без дополнительных эквивалентов лиганда.[30]

В 2011 году Ву и его сотрудники также сообщили, что можно использовать высокоактивный никелевый катализатор для кросс-сочетания арилхлоридов, который требует всего 0,01-0,1 мол.% Никелевого катализатора. Они также показали, что катализатор можно рециркулировать до шести раз практически без потери каталитической активности.[31] Катализатор подлежал вторичной переработке, потому что он представлял собой фосфинникель. наночастица катализатор (G3ДенП-Ни), изготовленный из дендримеры.

Преимущества и недостатки применимы к реакциям сочетания Сузуки, катализируемым как палладием, так и никелем. Помимо каталитической системы Pd и Ni, используются дешевые и нетоксичные источники металлов, такие как железо и медь.[32] были использованы в реакции сочетания Сузуки. Исследовательская группа Бедфорда[33] и исследовательская группа Накамура[34] активно работали над разработкой методологии катализируемой железом реакции сочетания Сузуки. Рутений - еще один источник металла, который использовался в реакции сочетания Сузуки.[35]
Амидная связь
При никелевом катализе можно образовывать связи C-C из амидов. Несмотря на инертную природу амидов как синтонов, для получения связей C-C можно использовать следующую методологию. Процедура сочетания мягкая и толерантна к множеству функциональных групп, включая амины, кетоны, гетероциклы, группы с кислотными протонами. Этот метод также можно использовать для получения биоактивных молекул и для контролируемого объединения гетероциклов с помощью продуманных последовательных перекрестных связей. Ниже приводится общий обзор схемы реакции.[36]
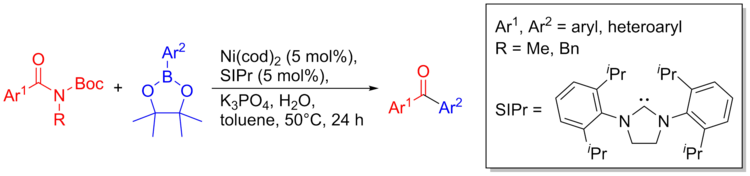
Синтез тубулин связующее соединение (антипролиферативный агент) проводили с использованием триметоксиамида и гетероциклического фрагмента.[36]

Органобораны
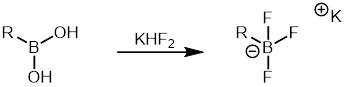
Арил бороновые кислоты сравнительно дешевле, чем другие органобораны и широкий спектр арильных бороновые кислоты имеются в продаже. Следовательно, он широко используется в реакции Судзуки в качестве органоборанового партнера. Арилтрифторборатные соли - это еще один класс часто используемых органоборанов, поскольку они менее склонны к протодеборация по сравнению с арилом бороновые кислоты. Их легко синтезировать и легко очистить.[37] Арилтрифторборатные соли может быть сформирован из бороновые кислоты лечением с фтористый водород калия который затем может быть использован в реакции сочетания Сузуки.[38]

Варианты растворителей
Реакция сочетания Сузуки отличается от других реакций сочетания тем, что ее можно проводить в двухфазной органической воде,[39] только вода,[17] или без растворителя.[40] Это увеличило объем реакций сочетания, поскольку можно было использовать различные водорастворимые основания, каталитические системы и реагенты, не беспокоясь об их растворимости в органическом растворителе. Использование воды в качестве системы растворителей также привлекательно из-за преимуществ с точки зрения экономики и безопасности. Часто используемые в системах растворителей для муфт Suzuki: толуол,[41] THF,[42] диоксан,[42] и DMF[43]. Наиболее часто используемые базы: K2CO3,[39] КОтБу,[44] CS2CO3,[45] K3PO4,[46] NaOH,[47] и Сеть3.[48]
Смотрите также
- Муфта Чан-Лам
- Чертовски реакция
- Муфта Хияма
- Муфта Кумада
- Муфта Негиши
- Петазис реакция
- Муфта Соногашира
- Стилле реакция
- Список органических реакций
Рекомендации
- ^ Мияура, Норио; Ямада, Кинджи; Судзуки, Акира (1979). «Новое стереоспецифическое кросс-сочетание катализируемой палладием реакции 1-алкенилборанов с 1-алкенил- или 1-алкинилгалогенидами». Буквы Тетраэдра. 20 (36): 3437–3440. Дои:10.1016 / S0040-4039 (01) 95429-2. HDL:2115/44006.
- ^ Мияура, Норио; Судзуки, Акира (1979). «Стереоселективный синтез арилированных (E) -алкенов по реакции алк-1-енилборанов с арилгалогенидами в присутствии палладиевого катализатора». Chem. Comm. 0 (19): 866–867. Дои:10.1039 / C39790000866.
- ^ Мияура, Норио; Сузуки, Акира (1995). "Катализируемые палладием реакции перекрестного связывания борорганических соединений". Химические обзоры. 95 (7): 2457–2483. CiteSeerX 10.1.1.735.7660. Дои:10.1021 / cr00039a007.
- ^ Nobelprize.org. «Нобелевская премия по химии 2010 г.». Фонд Нобелевской премии. Получено 2013-10-25.
- ^ Сузуки, Акира (1991). «Синтетические исследования посредством реакции кросс-сочетания борорганических производных с органическими галогенидами». Pure Appl. Chem. 63 (3): 419–422. Дои:10.1351 / pac199163030419.
- ^ Мияура, Норио; Судзуки, Акира (1979). «Катализируемые палладием реакции перекрестного связывания борорганических соединений». Химические обзоры. 95 (7): 2457–2483. CiteSeerX 10.1.1.735.7660. Дои:10.1021 / cr00039a007.(Рассмотрение)
- ^ Сузуки, Акира (1999). «Последние достижения в реакциях кросс-сочетания борорганических производных с органическими электрофилами, 1995–1998». Журнал металлоорганической химии. 576 (1–2): 147–168. Дои:10.1016 / S0022-328X (98) 01055-9.
- ^ Matos, K .; Содерквист, Дж. А. (1998). "Алкилбораны в сцеплении Сузуки-Мияура: стереохимические и механистические исследования". J. Org. Chem. 63 (3): 461–470. Дои:10.1021 / jo971681s. PMID 11672034.
- ^ а б Аматоре, Кристиан; Ютанд, Анни; Ле Дюк, Гаэтан (18 февраля 2011 г.). «Кинетические данные для трансметаллирования / восстановительного удаления в реакциях Сузуки-Мияуры, катализируемых палладием: неожиданная тройная роль гидроксид-ионов, используемых в качестве основания». Химия: европейский журнал. 17 (8): 2492–2503. Дои:10.1002 / chem.201001911. PMID 21319240.
- ^ Смит, Джордж Б .; Дезени, Джордж С .; Хьюз, Дэвид Л .; Кинг, Энтони О .; Верховен, Томас Р. (1 декабря 1994 г.). "Механистические исследования реакции перекрестной связи Сузуки". Журнал органической химии. 59 (26): 8151–8156. Дои:10.1021 / jo00105a036.
- ^ Матос, Карл; Содерквист, Джон А. (1 февраля 1998 г.). "Алкилбораны в сцеплении Сузуки-Мияура: стереохимические и механистические исследования". Журнал органической химии. 63 (3): 461–470. Дои:10.1021 / jo971681s. PMID 11672034.
- ^ а б Курти, Ласло (2005). Стратегические применения названных реакций в органическом синтезе. Elsevier Academic Press. ISBN 978-0124297852.
- ^ Стилл, Джон К .; Лау, Крейслер С. Ю. (1977). «Механизмы окислительного присоединения органических галогенидов к комплексам переходных металлов 8-й группы». Отчеты о химических исследованиях. 10 (12): 434–442. Дои:10.1021 / ar50120a002.
- ^ Casado, Arturo L .; Эспине, Пабло (1998). «О конфигурации, возникающей в результате окислительного присоединения RX к Pd (PPh3) 4, и механизме транс-изомеризации цис-транс-изомеризации комплексов PdRX (PPh3) 2] (R = арил, X = галогенид) †». Металлоорганические соединения. 17 (5): 954–959. Дои:10.1021 / om9709502.
- ^ а б Продвинутая органическая химия. Springer. 2007. С.739 –747.
- ^ Риджуэй, Брайан Х .; Вёрпель, К. А. (1998). "Трансметаллирование алкилборанов в палладий в реакции сочетания Сузуки протекает с сохранением стереохимии". Журнал органической химии. 63 (3): 458–460. Дои:10.1021 / jo970803d. PMID 11672033.
- ^ а б Casalnuovo, Albert L .; Калабрезе (1990). «Катализируемое палладием алкилирование в водных средах». Варенье. Chem. Soc. 112 (11): 4324–4330. Дои:10.1021 / ja00167a032.
- ^ Кирхгоф, Ян Х .; Нетертон, Мэтью Р .; Hills, Ivory D .; Фу, Грегори С. (2002). "Бороновые кислоты: новые партнеры связывания в реакциях Сузуки алкилбромидов при комнатной температуре. Кристаллографические характеристики окислительно-аддукта, полученного в исключительно мягких условиях". Журнал Американского химического общества. 124 (46): 13662–3. Дои:10.1021 / ja0283899. PMID 12431081.
- ^ Отака, Ацуши (2013). «Рециклируемые нанометаллические катализаторы на полимерной основе в воде». Химический рекорд. 13 (3): 274–285. Дои:10.1002 / tcr.201300001. PMID 23568378.
- ^ Martin, R .; Бухвальд, С. Л. (2008). «Катализируемые палладием реакции Сузуки-Мияура перекрестного связывания с использованием диалкилбиарилфосфиновых лигандов». Отчеты о химических исследованиях. 41 (11): 1461–1473. Дои:10.1021 / ar800036s. ЧВК 2645945. PMID 18620434.
- ^ а б Рухи, А. Морин (6 сентября 2004 г.). «Тонкая химия». C&EN.
- ^ Jacks1, Thomas E .; Belmont, Daniel T .; Бриггс, Кристофер А .; Хорн, Николь М .; Кантер, Джеральд Д.; Каррик, Грег Л .; Крикке, Джеймс Дж .; Маккейб, Ричард Дж .; Мустакис; Наннинга, Томас Н. (1 марта 2004 г.). «Разработка масштабируемого процесса для CI-1034, антагониста эндотелина». Исследования и разработки в области органических процессов. 8 (2): 201–212. Дои:10.1021 / op034104g.
- ^ Чен, Зупэн; Воробьева Евгения; Митчелл, Шэрон; Фако, Эдвин; Ортуньо, Мануэль А .; Лопес, Нурия; Коллинз, Шон М .; Мидгли, Пол А .; Ричард, Сильвия; Виле, Джанвито; Перес-Рамирес, Хавьер (2018). «Гетерогенный одноатомный палладиевый катализатор, превосходящий гомогенные системы для сочетания Сузуки» (PDF). Природа Нанотехнологии. 13 (8): 702–707. Дои:10.1038 / s41565-018-0167-2. HDL:2072/359786. PMID 29941887. S2CID 49415437.
- ^ Балог, Аарон; Мэн, Дунфан; Каменецка, Тед; Бертинато, Питер; Су, Дай-Ши; Соренсен, Эрик Дж .; Данишефский, Сэмюэл Дж. (1996). «Полный синтез (-) - эпотилона А». Angewandte Chemie International Edition на английском языке. 35 (2324): 2801–2803. Дои:10.1002 / anie.199628011.
- ^ Лю, Цзюньцзя; Лотеста, Стивен Д .; Соренсен, Эрик Дж. (2011). «Краткий синтез молекулярного каркаса плевромутилина». Химические коммуникации. 47 (5): 1500–2. Дои:10.1039 / C0CC04077K. ЧВК 3156455. PMID 21079876.
- ^ Vyvyan, J.R .; Петерсон, Эмили А .; Стефан, Мари Л. (1999). «Целесообразный полный синтез (+/−) - капарратриена». Буквы Тетраэдра. 40 (27): 4947–4949. Дои:10.1016 / S0040-4039 (99) 00865-5.
- ^ а б c d Хан, Фу-Шэ (1 января 2013 г.). «Реакции кросс-сочетания Сузуки – Мияуры, катализируемые переходными металлами: значительный прогресс от палладиевых к никелевым катализаторам». Обзоры химического общества. 42 (12): 5270–98. Дои:10.1039 / c3cs35521g. PMID 23460083.
- ^ Персек, Вергилий; Бэ, Джин-Ён; Хилл, Дейл (1995). "Арилмезилаты в катализируемых металлом гомосочетаниях и реакциях перекрестного связывания. 2. Катализируемое никелем перекрестное взаимодействие ариларенсульфонатов и арилмезилатов с арилбороновыми кислотами типа Сузуки". Журнал органической химии. 60 (4): 1060–1065. Дои:10.1021 / jo00109a044.
- ^ Инада, Каору; Норио Мияура (2000). «Синтез биарилов посредством реакции перекрестного связывания арилбороновых кислот с арилхлоридами, катализируемый комплексами NiCl2 / трифенилфосфин». Тетраэдр. 56 (44): 8657–8660. Дои:10.1016 / S0040-4020 (00) 00814-0.
- ^ Чжао, Юй-Лун; Ли, ты; Ли, Шуй-Мин; Чжоу И-Го; Сунь, Фэн-И; Гао, Лянь-Сюнь; Хан, Фу-Шэ (1 июня 2011 г.). «Практичный и надежный никелевый катализатор для взаимодействия Сузуки-Мияура арилгалогенидов». Расширенный синтез и катализ. 353 (9): 1543–1550. Дои:10.1002 / adsc.201100101.
- ^ Ву, Лей; Линг, Джи; У Цзун-Цюань (1 июня 2011 г.). «Высокоактивный и пригодный для повторного использования катализатор: наночастицы никеля, стабилизированные фосфиновым дендримером, для реакции связывания Сузуки». Расширенный синтез и катализ. 353 (9): 1452–1456. Дои:10.1002 / adsc.201100134.
- ^ Ян, C.T .; Чжан, Чжэнь-Ци; Лю Юй-Чен; Лю, Лэй (2011). "Катализируемая медью реакция перекрестного связывания борорганических соединений с первичными алкилгалогенидами и псевдогалогенидами". Энгью. Chem. Int. Эд. 50 (17): 3904–3907. Дои:10.1002 / anie.201008007. PMID 21455914.
- ^ Bredford, R.B .; Холл, Марка А .; Ходжес, Джордж Р .; Хуве, Майкл; Уилкинсон, Марк К. (2009). «Простые смешанные Fe-Zn катализаторы для сочетания тетраарилборатов Сузуки с бензилгалогенидами и 2-галогенпиридинами». Chem. Commun. (42): 6430–6432. Дои:10.1039 / B915945B. PMID 19841799. S2CID 40428708.
- ^ Накамура, М; Хашимото, Тору; Катриараччи, Калум К. А. Д. С .; Дзэнмё, Такеши; Сейке, Хирофуми; Накамура, Масахару (2012). "Катализированное железом соединение алкил-алкил Сузуки-Мияура". Энгью. Chem. Int. Эд. 51 (35): 8834–883. Дои:10.1002 / anie.201202797. PMID 22848024.
- ^ Na, Y; Пак, Соён; Хан, Су Бонг; Хан, Хун; Ко, Сангвон; Чанг, Сукбок (2004). «Катализируемое рутением олефинирование хека-типа и реакции связывания Сузуки: исследования природы каталитических разновидностей». Варенье. Chem. Soc. 126 (1): 250–258. Дои:10.1021 / ja038742q. PMID 14709090.
- ^ а б Weires, Николас А .; Бейкер, Эмма Л .; Гарг, Нил К. (2015). "Катализируемое никелем сочетание Сузуки-Мияуры амидов". Химия природы. 8 (1): 75–79. Bibcode:2016НатЧ ... 8 ... 75Вт. Дои:10.1038 / nchem.2388. PMID 26673267.
- ^ Molander, Gary A .; Биолатто, Бетина (2003). "Катализируемые палладием реакции кросс-сочетания Сузуки-Мияура арил- и гетероарилтрифторборатов калия". J. Org. Chem. 68 (11): 4302–4314. Дои:10.1021 / jo0342368. PMID 12762730.
- ^ Бейтс, Родерик (2012). Органический синтез с использованием переходных металлов. Вайли. ISBN 978-1119978930.
- ^ а б Долливер, Дебра; Bhattarai, Bijay T .; Панди, Арджун; Lanier, Megan L .; Bordelon, Amber S .; Адхикари, Сарджу; Dinser, Jordan A .; Цветы, Патрик Ф .; Уиллс, Вероника С .; Schneider, Caroline L .; Шонесси, Кевин Х .; Мур, Джейн Н .; Рейдерс, Стивен М .; Сноуден, Тимоти С .; McKim, Artie S .; Фрончек, Франк Р. (2013). "Стереоспецифические реакции сочетания Сузуки, Соногашира и Негиши N-алкоксиимидоил йодидов и бромидов". J. Org. Chem. 78 (8): 3676–3687. Дои:10.1021 / jo400179u. PMID 23534335.
- ^ Асаченко Андрей; Сорочкина, Кристина; Джеваков, Павел; Топчий Максим; Нечаев, Михаил (2013). "Перекрестная связь Сузуки – Мияура в условиях отсутствия растворителя". Adv. Synth. Катал. 355 (18): 3553–3557. Дои:10.1002 / adsc.201300741.
- ^ Пан, Чандуо; Лю, Чжан; Ву, Хуаюе; Дин, Цзиньчан; Ченг, Цзян (2008). «Катализируемая палладием реакция кросс-сочетания Сузуки без лиганда». Catalysis Communications. 9 (4): 321–323. Дои:10.1016 / j.catcom.2007.06.022.
- ^ а б Littke, Adam F .; Фу (2000). «Универсальные катализаторы для кросс-взаимодействия Suzuki арилбороновых кислот с арил- и винилгалогенидами и трифлатами в мягких условиях». Варенье. Chem. Soc. 122 (17): 4020–4028. Дои:10.1021 / ja0002058.
- ^ Ху, Мин-Ган; Вэй, Песня; Цзянь, Ай-Ай (2007). «Высокоэффективная Pd / C-катализируемая реакция связывания Сузуки п- (не) замещенного фенилгалогенида с (п-замещенным фенил) бороновой кислотой». Китайский журнал химии. 25 (8): 1183–1186. Дои:10.1002 / cjoc.200790220.
- ^ Сайто, B; Фу (2007). "Алкил-алкил Сузуки сшивки неактивированных вторичных алкилгалогенидов при комнатной температуре". Варенье. Chem. Soc. 129 (31): 9602–9603. Дои:10.1021 / ja074008l. ЧВК 2569998. PMID 17628067.
- ^ Kingston, J.V .; Веркаде, Джон Г. (2007). «Синтез и характеристика R2PNP (iBuNCH2CH2) 3N: новый объемный электронно-богатый фосфин для эффективных реакций взаимного связывания Сузуки-Мияура с участием палладия». J. Org. Chem. 72 (8): 2816–2822. Дои:10.1021 / jo062452l. PMID 17378611.
- ^ Бэйли, C; Чжан, Лисинь; Сяо, Цзяньлян (2004). "Ферроценил-монофосфиновые лиганды: синтез и применение в сочетании Сузуки-Мияура арилхлоридов". J. Org. Chem. 69 (22): 7779–7782. Дои:10.1021 / jo048963u. PMID 15498017.
- ^ Хан, Дж; Лю, Y; Го, Р. (2009). «Легкий синтез высокостабильных наночастиц золота и их неожиданно отличная каталитическая активность для реакции кросс-сочетания Сузуки-Мияура в воде». Варенье. Chem. Soc. 131 (6): 2060–2061. Дои:10.1021 / ja808935n. PMID 19170490.
- ^ Lipshutz, B.H .; Петерсен, Вт Б.; Абела, Александр Р. (2008). "Муфты Сузуки-Мияура при комнатной температуре в воде с участием неионных амфифилов †". Орг. Латыш. 10 (7): 1333–1336. Дои:10.1021 / ol702714y. PMID 18335944.

![{displaystyle {ce {{overset {organoboron species}{R1-BY2}}+{overset {halide}{R2-X}}->[{} atop {{ ext{Pd}} atop { ext{catalyst}}}][{ ext{Base}}]R1-R2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c43b40292dc12a954f37f136ec4bfb39d595c3e1)