Редуктивное устранение - Reductive elimination
Редуктивное устранение является элементарный шаг в металлоорганическая химия в которой степень окисления металлического центра уменьшается при образовании нового Ковалентная связь между двумя лиганды. Это микроскопический реверс из окислительная добавка, и часто является этапом образования продукта во многих каталитических процессах. Поскольку окислительное добавление и восстановительное отщепление являются обратными реакциями, для обоих процессов применяются одни и те же механизмы, а равновесие продукта зависит от термодинамики обоих направлений.[1][2]
Главная Информация
Восстановительное устранение часто наблюдается в более высоких степенях окисления и может включать двухэлектронное изменение в одном металлическом центре (моноядерном) или одноэлектронное изменение в каждом из двух металлических центров (биядерном, двухъядерном или биметаллическом).[1][2]
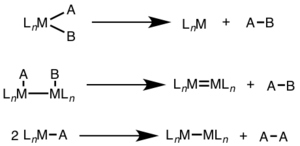
При моноядерном восстановительном элиминации степень окисления металла уменьшается на два, в то время как счет d-электронов металла увеличивается на два. Этот путь является общим для d8 металлы Ni (II), Pd (II), Au (III) и d6 металлы Pt (IV), Pd (IV), Ir (III) и Rh (III). Кроме того, мононуклеарное восстановительное отщепление требует, чтобы удаляемые группы находились цис-друг относительно друга на металлическом центре.[3]

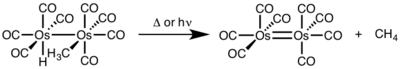
При биядерном восстановительном устранении степень окисления каждого металла уменьшается на единицу, а количество d-электронов каждого металла увеличивается на единицу. Этот тип реакционной способности обычно наблюдается с металлами первого ряда, которые предпочитают изменение степени окисления на одну единицу, но наблюдаются как для металлов второго, так и третьего ряда.[4]
Механизмы
Как и в случае окислительного добавления, при восстановительном удалении возможно несколько механизмов. Известный механизм - это согласованный путь, означающий, что это неполярный, трехцентровый переходное состояние с сохранением стереохимия. Кроме того, SN2 механизм, который происходит с инверсией стереохимии, или радикальный Механизм, который происходит при стирании стереохимии, - это другие возможные пути восстановительного устранения.[1]
Октаэдрические комплексы
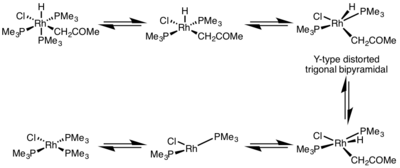
На скорость восстановительного удаления сильно влияет геометрия металлического комплекса. В восьмигранный комплексов, восстановительное устранение может происходить очень медленно из координационно насыщенного центра, и часто восстановительное устранение происходит только через диссоциативный механизм, при котором лиганд должен сначала диссоциировать, чтобы образовать пятикоординированный комплекс. Этот комплекс принимает искаженный Y-образный тригонально-бипирамидный структура, в которой π-донорный лиганд находится в базовом положении, и две группы, которые необходимо удалить, сближены очень близко друг к другу. После отщепления образуется Т-образный трехкоординатный комплекс, который будет ассоциироваться с лигандом с образованием квадратный плоский четырехкоординатный комплекс.[5]
Квадратные планарные комплексы
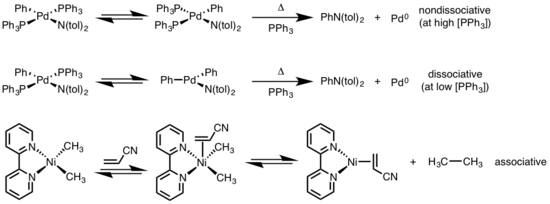
Восстановительное устранение плоских квадратных комплексов может происходить с помощью различных механизмов: диссоциативный, недиссоциативный и ассоциативный. Подобно октаэдрическим комплексам, диссоциативный механизм для квадратных плоских комплексов инициируется потерей лиганда, образуя трехкоординатный промежуточный продукт, который подвергается восстановительному отщеплению с образованием однокоординированного металлического комплекса. Для недиссоциативного пути редуктивное устранение происходит из четырехкоординатной системы, чтобы получить двухкоординатный комплекс. Если элиминирующие лиганды являются транс-друг к другу, комплекс сначала должен пройти транс к цис изомеризации перед устранением. В ассоциативном механизме лиганд должен первоначально ассоциироваться с четырехкоординированным комплексом металла для образования пятикоординированного комплекса, который подвергается восстановительному отщеплению, синониму механизма диссоциации для октаэдрических комплексов.[6][7]
Факторы, влияющие на восстановительную элиминацию
Восстановительное удаление чувствительно к целому ряду факторов, включая: 1) идентичность металла и электронную плотность; 2) стерика; 3) участвующие лиганды; 4) координационный номер; 5) геометрия; и 6) фотолиз / окисление. Кроме того, поскольку восстановительное удаление и окислительное добавление являются обратными реакциями, любые стерические или электронные устройства, которые увеличивают скорость восстановительного удаления, должны термодинамически препятствовать скорости окислительного добавления.[2]
Идентичность металла и электронная плотность
Комплексы металлов первого ряда, как правило, подвергаются восстановительному удалению быстрее, чем комплексы металлов второго ряда, которые, как правило, быстрее, чем комплексы металлов третьего ряда. Это связано с прочностью связи, причем связи металл-лиганд в комплексах первого ряда слабее, чем связи металл-лиганд в комплексах третьего ряда. Кроме того, металлические центры с низким содержанием электронов подвергаются восстановительному удалению быстрее, чем металлические центры, богатые электронами, так как полученный металл будет приобретать электронную плотность при восстановительном удалении.[8]
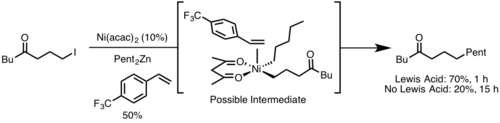
Стерики
Восстановительное удаление обычно происходит быстрее из металлического центра с более стерическими препятствиями, поскольку стерическое препятствие уменьшается после восстановительного удаления. Дополнительно широкий лиганд углы прикуса как правило, ускоряют восстановительное устранение, потому что стерические свойства заставляют удаляющие группы ближе друг к другу, что позволяет орбитальное перекрытие.[9]
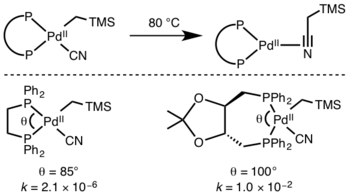
Участвующие лиганды
Кинетика редуктивного выведения трудно предсказать, но реакции, которые включают гидриды работают особенно быстро из-за эффектов перекрытия орбит в переходном состоянии.[10]

Координационный номер
Восстановительное отщепление происходит быстрее для комплексов трех- или пятикоординатных металлических центров, чем для четырех- или шестикоординатных металлических центров. Для комплексов с четным координационным числом восстановительное отщепление приводит к промежуточному соединению с сильно металл-лигандом. разрыхляющая орбиталь. Когда восстановительное отщепление происходит из комплексов с нечетным координационным числом, полученное промежуточное соединение занимает несвязывающая молекулярная орбиталь.[11]

Геометрия
Восстановительное выведение обычно происходит быстрее для комплексов, структура которых напоминает продукт.[2]
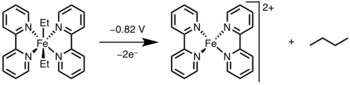
Фотолиз / окисление
Восстановительное удаление может быть вызвано окислением металлического центра до более высокой степени окисления с помощью света или окислителя.[12]
Приложения
Восстановительное устранение нашло широкое применение в научных кругах и промышленности, наиболее заметным из которых является: гидрирование,[13] то Процесс с уксусной кислотой Monsanto,[14] гидроформилирование,[15] и реакции кросс-сочетания.[16] Во многих из этих каталитических циклов восстановительное отщепление является стадией образования продукта и регенерирует катализатор; однако в Чертовски реакция[17] и Wacker процесс,[18] восстановительное отщепление участвует только в регенерации катализатора, поскольку продукты этих реакций образуются через отщепление β – гидрида.
использованная литература
- ^ а б c Крэбтри, Роберт Х. (2014). Металлоорганическая химия переходных металлов. (6 изд.). Вайли. п. 173. ISBN 978-1-118-13807-6.
- ^ а б c d Хартвиг, Джон Ф. (2010). Химия органических переходных металлов, от связывания до катализа. Книги университетских наук. п. 321. ISBN 978-1-891389-53-5.
- ^ Gillie, A .; Стилле, Дж. К. (1980). «Механизмы 1,1-восстановительного удаления из палладия». Варенье. Chem. Soc. 102 (15): 4933–4941. Дои:10.1021 / ja00535a018.
- ^ Okrasinski, S.J .; Нортом, Дж. Р. (1977). «Механизм восстановительного удаления. 2. Контроль двухядерного против моноядерного удаления метана из цис-гидридометилтетракарбонилосмия». Варенье. Chem. Soc. 99: 295–297. Дои:10.1021 / ja00443a076.
- ^ Мильштейн, Д. (1982). «Первые изолированные стабильные цис-гидридоалкилродиевые комплексы и реакция их восстановительного элиминирования». Варенье. Chem. Soc. 104 (19): 5227–5228. Дои:10.1021 / ja00383a039.
- ^ Драйвер, М. С .; Хартвиг, Дж. Ф. (1997). "Восстановительное удаление ариламинов из комплексов фосфина палладия (II), образующих углерод-азотные связи". Варенье. Chem. Soc. 119 (35): 8232–8245. Дои:10.1021 / ja971057x.
- ^ Ямамото, Т .; Ямамото, А .; Икеда, С. (1971). «Изучение органо (дипиридил) никелевых комплексов. I. Стабильность и активация алкил-никелевых связей диалкил (дипиридил) никеля путем координации с различными замещенными олефинами». Варенье. Chem. Soc. 93: 3350. Дои:10.1021 / ja00743a009.
- ^ Giovannini, R .; Stüdemann, T .; Dussin, G .; Knochel, P. (1998). «Эффективная перекрестная связь, катализируемая никелем, между центрами углерода sp3». Энгью. Chem. Int. Эд. 37 (17): 2387–2390. Дои:10.1002 / (SICI) 1521-3773 (19980918) 37:17 <2387 :: AID-ANIE2387> 3.0.CO; 2-M.
- ^ Marcone, J.E .; Молой, К. Г. (1998). «Кинетическое исследование восстановительного выведения из комплексов (дифосфин) Pd (R) (CN)». Варенье. Chem. Soc. 120 (33): 8527–8528. Дои:10.1021 / ja980762i.
- ^ Low, J. J .; Годдард, III, У.А. (1984). «Восстановительное связывание водородно-водородных, водород-углеродных и углерод-углеродных связей из комплексов палладия». Варенье. Chem. Soc. 106 (26): 8321–8322. Дои:10.1021 / ja00338a067.
- ^ Crumpton-Bregel, D.M .; Гольдберг, К. И. (2003). "Механизмы восстановительного удаления C-C и C-H алканов из октаэдрической Pt (IV): реакция через пятикоординатные промежуточные соединения или прямое удаление?". Варенье. Chem. Soc. 125: 9442. Дои:10.1021 / ja029140u. PMID 12889975.
- ^ Lau, W .; Huffman, J. C .; Кочи, Дж. К. (1982). "Электрохимическое окисление-восстановление металлоорганических комплексов. Влияние состояния окисления на пути восстановительного удаления комплексов диалкилжелеза". Металлоорганические соединения. 1: 155–169. Дои:10.1021 / om00061a027.
- ^ де Фрис, Дж. Г. (2007). Справочник по гомогенному гидрированию. Вайли. ISBN 978-3-527-31161-3.
- ^ Paulik, F.E .; Рот, Дж. Ф. (1968). «Новые катализаторы карбонилирования метанола до уксусной кислоты при низком давлении». Chem. Commun. (24): 1578. Дои:10.1039 / C1968001578A.
- ^ Ojima, I .; Tsai, C.-H .; Tzamarioudaki, M .; Бонафу, Д. (2004). «Реакция гидроформилирования». Органические реакции. 56: 1–354. Дои:10.1002 / 0471264180.or056.01. ISBN 0471264180.
- ^ Новые тенденции в перекрестной связи: теория и приложения Томас Колакот (редактор) 2014 ISBN 978-1-84973-896-5
- ^ де Фрис, Дж. Г. (2001). «Реакция Хека в производстве тонких химикатов» (PDF). Мочь. J. Chem. 79 (5–6): 1086–1092. Дои:10.1139 / v01-033.
- ^ Dong, J. J .; Browne, W. R .; Феринга, Б. Л. (2015). "Антимарковниковское окисление концевых алкенов, катализируемое палладием". Энгью. Chem. Int. Эд. 54 (3): 734–744. Дои:10.1002 / anie.201404856. PMID 25367376.
