Муфта Хияма - Hiyama coupling - Wikipedia
| Муфта Хияма | |
|---|---|
| Названный в честь | Тамэдзиро Хияма |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | хияма-сцепление |
| RSC ID онтологии | RXNO: 0000193 |
В Муфта Хияма это палладий катализированный реакция кросс-сочетания из органосиланы с органические галогениды используется в органическая химия формировать углерод-углеродные связи (Связи C-C). Эта реакция была открыта в 1988 г. Тамэдзиро Хияма и Ясуо Хатанака как метод синтетического образования углерод-углеродных связей с химиотерапия - и региоселективность.[1] Сочетание Хияма применялось для синтеза различных натуральные продукты.[2]
- : арил, алкенил или алкинил
- : арил, алкенил, алкинил или алкил
- : Cl, F или алкил
- : Cl, Br, I или OTf
История реакций
Муфта Hiyama была разработана для решения проблем, связанных с другими металлоорганический реагенты. Первоначальная реакционная способность кремнийорганического соединения фактически не была впервые сообщена Хиямой, поскольку Кумада сообщил о реакции сочетания с использованием фторсиликатоворганических соединений.[3] показано ниже. Затем Хияма обнаружил, что органосиланы обладают реакционной способностью при активации источником фтора.[4][5] Эта реакционная способность в сочетании с солью палладия создает углерод-углеродную связь с электрофильным углеродом, таким как органический галогенид. По сравнению с проблемами, присущими хорошо используемым металлоорганическим реагентам, таким как магнийорганический (Реагенты Гриньяра ) и органо-медь реагенты, которые очень реакционноспособны и, как известно, обладают низкой хемоселективностью, достаточной для разрушения функциональных групп на обоих партнерах сочетания, кремнийорганические соединения неактивны. Другие металлоорганические реагенты с использованием металлов, таких как цинк, банка, и бор, уменьшают проблему реактивности, но имеют другие проблемы, связанные с каждым реагентом. Цинкорганический реагенты чувствительны к влаге, оловоорганическое вещество соединения токсичны, и борорганический реагенты недоступны, дороги и часто нестабильны. Органосиланы представляют собой легкодоступные соединения, которые при активации (во многом подобно оловоорганическому или борорганическому соединению) из фторида или основания могут реагировать с галогенорганическими соединениями с образованием связей C-C хемо- и региоселективным образом. Реакция, о которой впервые сообщалось, была использована для соединения легко производимого (и активированного) кремнийорганического соединения. нуклеофилы и органо-галогениды (электрофилы ) в присутствии палладиевого катализатора.[1] С момента этого открытия различными группами была проделана работа по расширению объема этой реакции и «исправлению» проблем с этим первым сочетанием, таких как необходимость активации фторидом органосилана.

Механизм
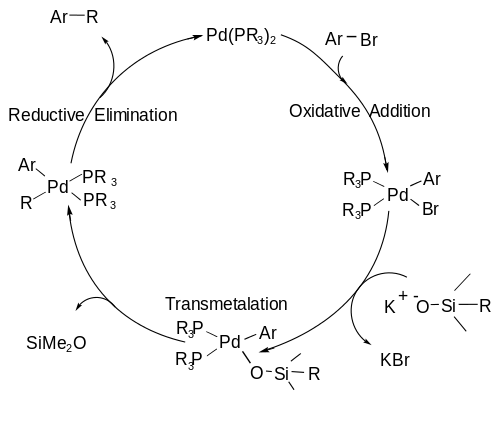
Органосилан активируется фторид (в виде какой-то соли, например TBAF или же ТАСФ ) или основу для формирования пятивалентный кремниевый центр, который лабильный достаточно, чтобы позволить разрыв связи C-Si во время стадии трансметаллирования.[6] Общая схема формирования этого ключевого промежуточного продукта показана ниже. Этот шаг происходит на месте или одновременно с каталитическим циклом реакции.

Механизм сочетания Hiyama следует каталитическому циклу, включая A) окислительная добавка стадия, на которой органический галогенид добавляют к палладию, окисляя металл от палладия (0) до палладия (II); а Б) трансметалляция этап, на котором связь C-Si разрывается и второй углеродный фрагмент связывается с центром палладия; и, наконец, C) a восстановительное устранение Этап, на котором образуется связь C-C и палладий возвращается в свое нулевалентное состояние, чтобы начать цикл заново.[7] В каталитический цикл показано ниже.

Объем и ограничения
Объем
Муфта Hiyama может применяться для образования Cзр2-Cзр2 (например. арил –Арил) связи, а также Cзр2-Cзр3 (например, арил–алкил ) облигации. Хорошие синтетические выходы получаются при соединении арилгалогениды, винилгалогениды, и аллильный галогениды и йодорганические соединения обеспечивают лучшие урожаи. Объем этой реакции был расширен за счет замыкания колец среднего размера посредством Скотт Э. Дания.[8]

Также было выполнено сочетание алкилгалогенидов с органо-галогенсиланами в качестве альтернативных органосиланов. Хлорсиланы позволяют связываться с арилхлоридами, которых много и которые, как правило, более экономичны, чем арилйодиды.[9] Никелевый катализатор открывает доступ к новой реакционной способности трифторсилановорганических соединений, как сообщает GC Fu. и другие.[10] Вторичный алкилгалогениды сочетаются с арилсиланами[11] с хорошими выходами при использовании этой реакции.

Ограничения
Сочетание Хиямы ограничено необходимостью фторида для активации кремнийорганического реагента. Добавление фторида отщепляет любые защитные группы кремния (например, силиловые эфиры[12]), которые часто используются в органическом синтезе. Ион фтора также является основным, поэтому на чувствительные к основанию защитные группы, кислотные протоны и функциональные группы может повлиять добавление этого активатора. Большинство активных исследований, касающихся этой реакции, включает в себя решение этой проблемы. Чтобы преодолеть эту проблему, многие группы обратились к использованию других основных добавок для активации или к использованию различных органосилановых реагентов вместе, что привело к множеству вариантов первоначального сочетания Hiyama.
Вариации
В одной модификации сочетания Hiyama используется силациклобутановое кольцо и источник фторида, который гидратирован, как показано ниже.[13] Это имитирует использование алкоксисилана / органосиланола, а не использование алкилсилана. Механизм этой реакции с использованием источника фторида позволил разработать будущие реакции, в которых можно избежать использования источника фторида.

Муфты Hiyama без фтора
Было разработано множество модификаций сочетания Hiyama, исключающих использование фторидного активатора / основы. Используя хлорсиланы, Хияма нашел схему сочетания, использующую NaOH как основной активатор.[14] Сообщалось о модификациях с использованием алкоксисиланов с использованием более мягких оснований, таких как NaOH. [15] и даже вода.[16] Изучение этих механизмов привело к развитию соединения Хияма-Дания, в котором используется органосиланолы как партнеры по связке.

Другой класс безфторидных муфт Hiyama включает использование Кислота Льюиса добавка, которая позволяет использовать такие основы, как K3PO4[17] для использования или для протекания реакции без основной добавки.[18][19] Добавление медь Сообщается также, что сокатализатор позволяет использовать более мягкий активирующий агент.[17] и даже было показано, что он оборот в котором оборот палладия (II) и меди (I) в каталитическом цикле, а не добавление стехиометрический Кислота Льюиса (например, серебро (I),[18] медь (I)[19]).

Соединение Хияма и Дании
| Соединение Хияма и Дании | |
|---|---|
| Названный в честь | Тамэдзиро Хияма Скотт Э. Дания |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | hiyama-denamrk-сцепление |
В Соединение Хияма и Дании представляет собой модификацию сочетания Hiyama, которая не требует фторидной добавки для использования органосиланолов и органических галогенидов в качестве партнеров сочетания. Общая схема реакции показана ниже, демонстрируя использование База Бронстеда в качестве активирующего агента в отличие от фторида, фосфиновые лиганды также используются на металлическом центре.[2]

Конкретный пример этой реакции показан с реагентами. Если бы использовался фторид, как в исходном протоколе Хиямы, терт-бутилдиметилсилиловый (TBS) эфир был бы, вероятно, уничтожен.[20]

Механизм сцепления Хияма-Дания
Изучение механизма этой реакции позволяет предположить, что образование силоната - это все, что необходимо для активации добавления органосилана к центру палладия. Наличие пятивалентного кремния не требуется и кинетический Анализ показал, что эта реакция имеет зависимость первого порядка от концентрации силоната.[2] Это происходит из-за образования ключевой связи, связи Pd-O во время стадии трансметаллирования, которая затем позволяет переносить углеродный фрагмент на центр палладия. На основании этого наблюдения кажется, что стадией ограничения скорости в этом каталитическом цикле является образование связи Pd-O, при котором повышенные концентрации силоната увеличивают скорость этой реакции (что указывает на более быстрые реакции).

Смотрите также
- Чертовски реакция
- Муфта Кумада
- Муфта Негиши
- Муфта Соногашира
- Стилле реакция
- Сузуки реакция
- Катализируемые палладием реакции сочетания
внешняя ссылка
Рекомендации
- ^ а б Hatanaka, Y .; Хияма, Т. (1988). «Перекрестное сочетание органосиланов с органическими галогенидами, опосредованное палладиевым катализатором и дифтортриметилсиликатом трис (диэтиламино) сульфония». Журнал органической химии. 53 (4): 918–920. Дои:10.1021 / jo00239a056.
- ^ а б c Дания, S. E .; Регенс, С. С. (2008). «Катализируемые палладием реакции перекрестного связывания органосиланолов и их солей: практические альтернативы методам на основе бора и олова». Отчеты о химических исследованиях. 41 (11): 1486–1499. Дои:10.1021 / ar800037p. ЧВК 2648401. PMID 18681465.
- ^ а б Yoshida, J .; Tamao, K .; Yamamoto, H .; Какуй, Т .; Uchida, T .; Кумада, М. (1982), "Фторорганические силикаты в органическом синтезе. 14. Образование углерод-углеродных связей, стимулируемое солями палладия", Металлоорганические соединения, 1 (3): 542–549, Дои:10.1021 / om00063a025
- ^ Hiyama, T .; Obayashi, M .; Мори, I .; Нозаки, Х. (1983), "Получение свободных от металлов силильных анионов из дисиланов и фторидного катализатора. Синтетические реакции с альдегидами и 1,3-диенами", Журнал органической химии, 48 (6): 912–914, Дои:10.1021 / jo00154a043
- ^ Fujita, M .; Хияма, Т. (1988), "Эритро-директивное восстановление -замещенных алканонов с помощью гидросиланов в кислой среде", Журнал органической химии, 53 (23): 5415–5421, Дои:10.1021 / jo00258a004
- ^ Хияма, Т. (2002), «Как я столкнулся с реакцией кросс-сочетания на основе кремния», Журнал металлоорганической химии, 653 (1–2): 58–61, Дои:10.1016 / s0022-328x (02) 01157-9
- ^ Miyaura, N .; Сузуки, А. (1995), "Катализируемые палладием реакции перекрестной связи борорганических соединений", Химические обзоры, 95 (7): 2457–2483, CiteSeerX 10.1.1.735.7660, Дои:10.1021 / cr00039a007
- ^ а б Дания, S. E .; Ян, С.-М. (2002), "Внутримолекулярные реакции перекрестного связывания при помощи кремния: общий синтез колец среднего размера, содержащих 1,3-цис-цис-диеновое звено", Журнал Американского химического общества, 124 (10): 2102–2103, Дои:10.1021 / ja0178158, PMID 11878949
- ^ Gouda, K.-i .; Hagiwara, E .; Hatanaka, Y .; Хияма, Т. (1996), "Реакции перекрестного связывания арилхлоридов с хлорорганическими соединениями: высокоэффективные методы арилирования или алкенилирования арилхлоридов", Журнал органической химии, 61 (21): 7232–7233, Дои:10.1021 / jo9611172, PMID 11667637
- ^ Пауэлл, Д. А .; Фу, Г. С. (2004), "Катализируемые никелем перекрестные связи кремнийорганических реагентов с неактивированными вторичными алкилбромидами", Журнал Американского химического общества, 126 (25): 7788–7789, Дои:10.1021 / ja047433c, PMID 15212521
- ^ Стротман, Н. А .; Sommer, S .; Фу, Г.С. (2007), "Реакции Хиямы активированных и неактивированных вторичных алкилгалогенидов, катализируемые комплексом никель / норэфедрин", Angewandte Chemie International Edition, 46 (19): 3556–3558, Дои:10.1002 / anie.200700440, PMID 17444579
- ^ Greene, T. W .; Wuts, P. G. M. Защитные группы в органическом синтезе, 3-е изд .; Джон Вили и сыновья: Нью-Йорк, 1991. ISBN 0471160199
- ^ а б Дания, S. E .; Wehrli, D .; Чой, Дж. Я. (2000), "Конвергенция механистических путей в катализируемом палладием (0) перекрестном взаимодействии алкенилсилациклобутанов и алкенилсиланолов", Органические буквы, 2 (16): 2491–2494, Дои:10.1021 / ol006170y, PMID 10956529
- ^ а б Hagiwara, E .; Gouda, K.-i .; Hatanaka, Y .; Хияма, Т. (1997), «Реакции кросс-сочетания кремнийорганических соединений с органическими галогенидами, стимулированные NaOH: практические пути к биарилам, алкениларенам и сопряженным диенам», Буквы Тетраэдра, 38 (3): 439–442, Дои:10.1016 / с0040-4039 (96) 02320-9
- ^ Shi, S .; Чжан, Ю. (2007), "Pd (OAc) 2-Катализированные реакции перекрестного связывания без фторидов арилсилоксанов с арилбромидами в водной среде", Журнал органической химии, 72 (15): 5927–5930, Дои:10.1021 / jo070855v, PMID 17585827
- ^ Wolf, C .; Lerebours, R. (2004), "Катализированные палладием-фосфиновой кислотой NaOH-промотированные реакции перекрестного связывания арилсилоксанов с арилхлоридами и бромидами в воде", Органические буквы, 6 (7): 1147–1150, Дои:10.1021 / ol049851s, PMID 15040744
- ^ а б c Nakao, Y .; Takeda, M .; Matsumoto, T .; Хияма, Т. (2010), "Реакции перекрестного связывания посредством внутримолекулярной активации алкил (триоргано) силанов", Angewandte Chemie, 122 (26): 4549–4552, Дои:10.1002 / ange.201000816
- ^ а б Hirabayashi, K .; Мори, А .; Kawashima, J .; Сугуро, М .; Nishihara, Y .; Хияма, Т. (2000), "Катализированное палладием перекрестное связывание силанолов, силандиолов и силантриолов под действием оксида серебра (I)", Журнал органической химии, 65 (17): 5342–5349, Дои:10.1021 / jo000679p, PMID 10993364
- ^ а б Nishihara, Y .; Икегашира, К .; Hirabayashi, K .; Ando, J.-i .; Мори, А .; Хияма, Т. (2000), «Реакции связывания алкинилсиланов, опосредованные солью Cu (I): новые синтезы конъюгированных дийнов и дизамещенных этинов», Журнал органической химии, 65 (6): 1780–1787, Дои:10.1021 / jo991686k, PMID 10814151
- ^ а б Дания, S. E .; Smith, R.C .; Чанг, В.-Т. Т .; Мухухи, Дж. М. (2009), "Реакции перекрестного связывания ароматических и гетероароматических силанолатов с ароматическими и гетероароматическими галогенидами", Журнал Американского химического общества, 131 (8): 3104–3118, Дои:10.1021 / ja8091449, ЧВК 2765516, PMID 19199785

![Общая схема соединения Хияма { displaystyle { begin {matrix} {} { ce {{R-SiR '' _ {3}} + R'-X -> [ mathrm {F ^ {-}}] [{ text {Pd cat.}}] R-R '}} end {matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45686837800f1a0e625c8ab13b8224dd6e26a10e)



