Силиловый эфир - Silyl ether

Силиловые эфиры группа химические соединения которые содержат кремний атом ковалентно связанный для алкокси группа. Общая структура R1р2р3Si − O − R4 где R4 является алкил группа или арил группа. Силиловые эфиры обычно используются в качестве защитные группы для спиртов в органический синтез. Поскольку R1р2р3 могут быть комбинациями различных групп, которые можно варьировать для получения ряда силиловых эфиров, эта группа химические соединения обеспечивает широкий спектр селективности химии защитных групп. Обычные силиловые эфиры: триметилсилил (ТМС), терт-бутилдифенилсилил (TBDPS), терт-бутилдиметилсилил (TBS / TBDMS) и триизопропилсилил (ЧАЕВЫЕ). Они особенно полезны, потому что их можно очень выборочно устанавливать и снимать в мягких условиях.
Обычные силиловые эфиры
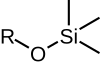 |  |  |  | 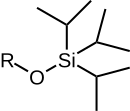 |
| ТМС | TES | TBS / TBDMS | TBDPS | ЧАЕВЫЕ |
| Триметилсилил эфир | Триэтилсилил эфир | терт-Бутилдиметилсилил эфир | терт-Бутилдифенилсилил эфир | Триизопропилсилил эфир |
Формирование
Хотя существует множество методов образования силиловых эфиров, две общие стратегии силилирование спиртов: реакция спирта с силилхлорид с использованием аминового основания при комнатной температуре и реакции спирта с силилом тройной используя затрудненный амин база при низкой температуре. Силилтрифлаты более реакционноспособны, чем их соответствующие хлориды, поэтому их можно использовать для установки силильных групп на затрудненный позиции. Одна чрезвычайно надежная и быстрая процедура - это протокол Кори, в котором спирт реагирует с силилхлоридом и имидазол при высокой концентрации в DMF.[1] Если ДМФ заменить дихлорметаном, реакция протекает несколько медленнее, но очистка соединения упрощается. Обычной затрудненной основой для использования с силилтрифлатами является 2,6-лутидин.[2] Первичные спирты можно защитить менее чем за час, в то время как для некоторых затрудненных спиртов может потребоваться время реакции.
При использовании силилхлорида особых мер предосторожности обычно не требуется, за исключением исключения большого количества воды. Можно использовать избыток силилхлорида, но это не обязательно. Если используется избыток реагента, для продукта потребуется флэш-хроматография убрать лишнее силанол и силоксан. Силилтрифлаты чувствительны к воде и требуют инертная атмосфера условия. Очистка включает добавление водной кислоты, такой как насыщенный хлорид аммония решение. Это гасит оставшийся силильный реагент и протонирует аминные основания, удаляя их из реакционной смеси. После экстракции продукт можно очистить флэш-хроматографией.
Силилтрифлат более реакционноспособен и также преобразует кетоны к силиловые эфиры енола.
Удаление защитных групп силилового эфира[3]
Реакция с кислотами или фторидами, такими как фторид тетра-н-бутиламмония удаляет силильную группу, когда защита больше не нужна. Более крупные заместители повышают устойчивость к гидролиз, но также затрудняют введение силильной группы.
В кислой среде относительное сопротивление составляет:
- TMS (1)
В основных средах относительное сопротивление составляет:
- TMS (1)
Монозащита симметричных диолов
Симметричный диол можно моносилилировать, хотя, как известно, иногда это бывает проблематично. Например, сообщалось о следующем моносилилировании:[4]
Однако оказывается, что повторить эту реакцию сложно. Если бы реакция контролировалась исключительно термодинамикой, то статистически, если бы дианион имеет такую же реакционную способность, что и моноанион, тогда будет получена соответствующая статистическая смесь 1: 2: 1 дисилилированный: моносилилированный: несилилированный диол. Однако реакция в ТГФ осуществляется селективной благодаря двум факторам: кинетическому депротонированию первого аниона И нерастворимости моноаниона. При первоначальном добавлении TBSCl в растворе присутствует лишь незначительное количество моноаниона, а остальное находится в суспензии. Эта небольшая часть реагирует и сдвигает равновесие моноаниона, чтобы втягивать больше в раствор, тем самым позволяя получить высокие выходы соединения моно-TBS. Превосходные результаты в некоторых случаях могут быть получены с бутиллитий:[5]
Третий метод использует смесь DMF и DIPEA.[6]
- В качестве альтернативы можно использовать избыток (4 экв.) Диола, ускоряя реакцию до монозащиты.
Селективное снятие защиты
Во многих случаях возможно селективное снятие защиты с силильных групп. Например, при синтезе таксол:[7]

Силиловые эфиры в основном различают по стерическим или электронным причинам. В общем, кислотное снятие защиты снимает защиту с менее затрудненных силильных групп быстрее, причем стерическая масса кремния более значима, чем стерическая масса кислорода. Снятие защиты на основе фтора снимает защиту силильных групп с низким содержанием электронов быстрее, чем силильные группы с высоким содержанием электронов. Есть некоторые свидетельства того, что снятие защиты с силила происходит через гипервалентный разновидности кремния.
Селективное снятие защиты с силиловых эфиров подробно рассмотрено.[8][9] Хотя селективное снятие защиты было достигнуто во многих различных условиях, некоторые процедуры, описанные ниже, являются более надежными. Избирательное снятие защиты, вероятно, будет успешным, если есть существенная разница в стерильности (например, первичный TBS против вторичного TBS или первичный TES против первичного TBS) или электронике (например, первичный TBDPS против первичного TBS). К сожалению, неизбежно требуется некоторая оптимизация, и часто необходимо частично выполнить снятие защиты и переработать материал.
- Некоторые распространенные кислотные условия
- 100 мол.% 10-CSA (камфорсульфоновая кислота ) в MeOH, комнатная температура; «взрыв» кислоты снимает защиту с первичных групп TBS в течение десяти минут.
- 10 мол.% 10-CSA, 1: 1 MeOH: DCM, -20 или 0 ° C; снимает защиту с первичной группы TBS в течение двух часов при 0; если CSA заменяется на PPTS, скорость примерно в десять раз меньше; с п-ЦОН примерно в десять раз быстрее; смесь растворителей имеет решающее значение.
- 4: 1: 1 об / об / об AcOH: THF: вода, комнатная температура; это очень медленно, но может быть очень избирательным.
- Некоторые общие основные условия
- HF-пиридин, 10: 1 ТГФ: пиридин, 0 ° C; отличное снятие защиты; удаляет основные группы TBS в течение восьми часов; реакции с использованием HF должны проводиться в пластиковых контейнерах.
- TBAF, THF или 1: 1 TBAF / АсОН, ТГФ; С групп TBDPS и TBS можно снять защиту в присутствии друг друга в разных условиях.[10]
Рекомендации
- ^ Кори, Э. Дж .; Венкатешварлу А. "Защита гидроксильных групп как терт-бутилдиметилсилильные производные ». Варенье. Chem. Soc. 1972, 94, 6190–6191. Дои:10.1021 / ja00772a043
- ^ Кори, Э. Дж .; Чо, H .; Rücker C .; Хуа, Д. Х. "Исследования с триалкилсилилтрифлатами: новые синтезы и применения". Tetrahedron Lett. 1981, 22, 3455–3458. Дои:10.1016 / S0040-4039 (01) 81930-4
- ^ Greene, T. W .; Вутс, П. Г. М. (1999). Защитные группы в органическом синтезе. Нью-Йорк: Джон Вили и сыновья. п. 114. ISBN 9780471160199.
- ^ McDougal, P.G .; Rico, J.G .; Ой, Ю.-И .; Кондон, Б. Д. "Удобная процедура для моносилилирования симметричного 1,п-диолы ". J. Org. Chem. 1986, 51, 3388–3390. Дои:10.1021 / jo00367a033
- ^ Roush, W. R .; Gillis, H.R .; Эссенфельд, А. П. "Внутримолекулярные реакции Дильса-Альдера, катализируемые плавиковой кислотой" J. Org. Chem. 1983, 49, 4674–4682. Дои:10.1021 / jo00198a018
- ^ Hu, L .; Лю, Б .; Yu, C. Tetrahedron Lett. 2000, 41, 4281. Дои:10.1016 / S0040-4039 (00) 00626-2
- ^ Holton, R.A. et al. «Первый полный синтез таксола. 2. Завершение циклов C и D». Варенье. Chem. Soc. 1994, 116, 1599–1600. Дои:10.1021 / ja00083a067
- ^ Nelson, T. D .; Крауч, Р. Д. "Селективное снятие защиты силиловых эфиров". Синтез 1996, 1031–1069. Дои:10.1055 / с-1996-4350
- ^ Крауч, Р. Д. "Селективная монозащита бис-силиловых эфиров". Тетраэдр 2004, 60, 5833–5871. Дои:10.1016 / j.tet.2004.04.042
- ^ Higashibayashi, S .; Шинко, К .; Ishizu, T .; Хашимото, К .; Shirahama, H .; Наката М. "Избирательное снятие защиты с т-бутилдифенилсилиловые эфиры в присутствии т-бутилдиметилсилиловые эфиры с помощью фторида тетрабутиламмония, уксусной кислоты и воды ». Synlett 2000, 1306–1308. Дои:10.1055 / с-2000-7158
