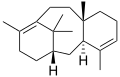
Терпен - Terpene

Было высказано предположение, что терпеноид быть слился в эту статью. (Обсуждать) Предлагается с ноября 2020 года. |
Терпены (/ˈтɜːrпяп/) являются классом натуральные продукты состоящий из соединений формулы (C5ЧАС8)п. Состоящие из более чем 30 000 соединений, эти ненасыщенные углеводороды производятся преимущественно растения, особенно хвойные породы.[1][2] Далее терпены классифицируются по количеству атомов углерода: монотерпены (C10), сесквитерпены (C15), дитерпены (C20) и т. д. Хорошо известным монотерпеном является альфа-пинен, основной компонент скипидара.
Еще более многочисленным, чем терпены, является класс соединений, называемых терпеноидами. Терпеноиды - это терпены, которые были модифицированы (обычно кислородсодержащими) функциональные группы. Термины терпены и терпеноиды используются как синонимы. Оба имеют сильный и часто приятный запах, который может защитить их хозяев или привлечь опылителей. Запасы терпенов и терпеноидов оцениваются в 55 000 химических соединений.[3]
Биологическая функция
Терпены также являются основными строительными блоками биосинтеза. Стероиды, например, производные тритерпена сквален. Терпены и терпеноиды также являются основными составляющими эфирные масла из многих видов растений и цветов.[4] У растений терпены и терпеноиды являются важными медиаторами экологической взаимодействия. Например, они играют роль в защита растений от травоядных, устойчивость к болезням, привлечение мутуалисты Такие как опылители, а также потенциально растение-заводская коммуникация.[5][6] Кажется, они играют роли антифеданты и заживление ран.
В более теплую погоду деревья выделяют большее количество терпенов, где они могут функционировать как естественный механизм засев облаков. Облака отражают солнечный свет, позволяя регулировать температуру в лесу.[7]
Терпены также используются насекомыми в качестве защиты. Например, термиты подсемейства Nasutitermitinae к отпугивать хищных насекомых, с помощью специального механизма, называемого родничковый пистолет, который выбрасывает смолистую смесь терпенов.[8]
Приложения
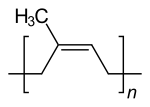
Один терпен, который имеет основное применение, - это натуральная резина (т.е. полиизопрен ). Возможность того, что другие терпены могут быть использованы в качестве прекурсоров для производства синтетических полимеры был исследован как альтернатива использованию нефтяного сырья. Однако некоторые из этих приложений были коммерциализированы.[9] Однако многие другие терпены находят коммерческое и промышленное применение в меньших масштабах. Например, скипидар, смесь терпенов (например, пинен ), полученный при перегонке сосны смола, используется органический растворитель и как химическое сырье (в основном для производства других терпеноидов).[10] Канифоль, еще один побочный продукт смолы хвойных деревьев, широко используется в качестве ингредиента в различных промышленных продуктах, таких как чернила, лаки и клеи. Терпены широко используются в качестве ароматизаторов и ароматизаторов в потребительских товарах, таких как духи, косметика и чистящие средства, а также продукты питания и напитки. Например, аромат и вкус хмель происходит частично из сесквитерпены (в основном α-гумулен и β-кариофиллен ), которые влияют пиво качественный.[11]Они также входят в состав некоторых традиционные лекарства, Такие как ароматерапия. Некоторые из них образуют гидропероксиды, которые ценятся как катализаторы при производстве полимеров.
Отражая свою защитную роль, терпены используются в качестве активных ингредиентов натуральных пестициды в сельском хозяйстве.[12]
Физические и химические свойства
Терпены бесцветны, хотя нечистые образцы часто желтые. Шкала точек кипения с размером молекул: терпены, сесквитерпены и дитерпены соответственно при 110, 160 и 220 ° C. Поскольку они неполярны, они нерастворимы в воде. Будучи углеводородами, они легко воспламеняются и имеют низкий удельный вес (плавают на воде).
Терпеноиды (моно-, полутора, ди- и т. д.) имеют аналогичные физические свойства, но имеют тенденцию быть более полярными и, следовательно, немного более растворимыми в воде и несколько менее летучими, чем их терпеновые аналоги. Высокополярные производные терпеноидов - гликозиды, связанные с сахарами. Это водорастворимые твердые вещества. Это тактильно легкие масла, значительно меньшие вязкий чем привычные растительные масла, такие как кукурузное масло (28 cP ) с вязкостью от 1 сП (ала вода) до 6 сП. Как и другие углеводороды, они легко воспламеняются. Терпены являются местными раздражителями и при проглатывании могут вызвать желудочно-кишечные расстройства.
Терминология
Термин «терпен» был изобретен в 1866 году немецким химиком. Август Кекуле.[13] Хотя иногда используется как синоним «терпенов», терпеноиды (или же изопреноиды ) представляют собой модифицированные терпены, содержащие дополнительные функциональные группы, обычно кислородсодержащий.[14] Название «терпен» - это сокращенная форма от «терпентин», устаревшее написание «скипидар ".
Биосинтез

Концептуально получено из изопрены, структуры и формулы терпенов соответствуют правило биогенетического изопрена или C5 правило, как описано в 1953 г. Леопольд Ружичка и коллеги.[15] Изопреновые единицы поставляются из изопренилпирофосфат (он же диметилаллил пирофосфат ) и изопентенилпирофосфат, которые существуют в равновесии. Эта пара строительных блоков производится двумя разными метаболические пути: путь мевалоновой кислоты и путь MEP / DOXP.
Путь мевалоновой кислоты
Большинство организмов продуцируют терпены посредством пути HMG-CoA редуктазы, известного как путь мевалоната, названного в честь промежуточных соединений. мевалоновая кислота. Этот путь начинается с ацетил-КоА.
Путь MEP / DOXP
2-C-метил-D-эритритол-4-фосфат / 1-дезокси-D-ксилулозо-5-фосфатный путь (путь MEP / DOXP), также известный как немевалонатный путь или независимый от мевалоновой кислоты путь, начинается с пирувата в качестве источника углерода.
Пируват и глицеральдегид-3-фосфат преобразуются DOXP-синтазой (Dxs) в 1-дезокси-D-ксилулозо-5-фосфат, а DOXP-редуктазой (Dxr, IspC) в 2-C-метил-D-эритритол 4-фосфат (MEP). Последующие три стадии реакции, катализируемые 4-дифосфоцитидил-2-C-метил-D-эритритолсинтаза (YgbP, IspD), 4-дифосфоцитидил-2-C-метил-D-эритритолкиназа (YchB, IspE) и 2-C-метил-D-эритритол-2,4-циклодифосфатсинтаза (YgbB, IspF) опосредует образование 2-C-метил-D-эритритол-2,4-циклопирофосфат (MEcPP). Наконец, MEcPP преобразуется в (E) -4-гидрокси-3-метил-бут-2-енилпирофосфат (HMB-PP ) синтазой HMB-PP (GcpE, IspG), а HMB-PP преобразуется в изопентенилпирофосфат (IPP) и диметилаллил пирофосфат (DMAPP) редуктазой HMB-PP (LytB, IspH).
IPP и DMAPP являются конечными продуктами любого пути и предшественниками изопрен, монотерпеноиды (10-углерод), дитерпеноиды (20-углерод), каротиноиды (40-углерод), хлорофиллы, и пластохинон -9 (45-углерод). Синтез всех высших терпеноидов протекает через образование геранилпирофосфат (GPP), фарнезилпирофосфат (FPP) и геранилгеранилпирофосфат (GGPP).
MVA и MEP исключают друг друга у большинства организмов.
| Организм | Пути |
|---|---|
| Бактерии | MVA или MEP |
| Археи | МВА |
| Зеленый Водоросли | MEP |
| Растения | MVA и MEP |
| Животные | МВА |
| Грибы | МВА |
Фаза геранилпирофосфата и выше

Как в пути MVA, так и в пути MEP, IPP изомеризуется в DMAPP ферментом изопентенилпирофосфат-изомеразой. IPP и DMAPP конденсируются с образованием геранилпирофосфат, предшественник монотерпенов и монотерпеноидов.
Геранилпирофосфат также превращается в фарнезилпирофосфат и геранилгеранилпирофосфат, соответственно предшественники C15 и C20 сесквитерпены и дитерпены (а также секвитерпеноиды и дитерпеноиды).[2] Биосинтез опосредуется терпен-синтаза.[16][17]
Терпены в терпеноиды
Геномы 17 видов растений содержат гены, которые кодируют ферменты терпеноидсинтазы, придающие терпены их основную структуру, и цитохром P450s которые изменяют эту базовую структуру.[2][18]
Структура
Терпены можно представить как результат связывания изопрена (C5ЧАС8) единицы «голова к хвосту» образуют цепи и кольца.[19] Некоторые терпены связаны «хвост к хвосту», а более крупные разветвленные терпены могут быть связаны «хвост к середине». Их называют «неправильными» терпенами.
- Формула
Строго говоря, все монотерпены имеют одну и ту же химическую формулу C10ЧАС16. Аналогично, все секвитерпены и дитерпены соответственно являются C15ЧАС24 и C20ЧАС32. Структурное разнообразие моно-, сескви- и дитерпенов является следствием изомерии.
- Хиральность
Терпены и терпеноиды обычно хиральный. Хиральные соединения могут существовать как несовместимые зеркальные изображения, которые проявляют различные свойства (запах, токсичность и т. Д.).
- Ненасыщенность
Большинство терпенов и терпеноидов имеют группы C = C, т.е. они ненасыщенные. Поскольку они не содержат функциональных групп, кроме своей ненасыщенности, терпены структурно различимы. Ненасыщенность связана с ди- и тризамещенными алкенами. Ди- и тризамещенные алкены устойчивы к полимеризации (низкая потолочные температуры ), но чувствительны к кислотно-индуцированному карбокатион формирование.
Классификация
- Избранные терпены

Лимонен, монотерпен.

Carvone представляет собой монотерпеноид, модифицированный монотерпен.
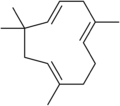
Гумулен, сесквитерпен.
Терпены можно классифицировать по количеству изопреновых звеньев в молекуле; префикс в названии указывает количество пар изопрена, необходимое для сборки молекулы. Обычно терпены содержат 2, 3, 4 или 6 изопреновых звеньев; тетратерпены (8 изопреновых звеньев) образуют отдельный класс соединений, называемых каротиноидами; остальные редки. Классификация носит чисто формальный характер; ничего нельзя сделать вывод об их свойствах, использовании или происхождении.
- Гемитерпены состоит из единственный изопрен единица. Сам изопрен считается единственным гемитерпеном, но кислородсодержащие производные, такие как пренол и изовалериановая кислота гемитерпеноиды.
- Монотерпены состоит из два изопрена единиц и имеют молекулярную формулу C10ЧАС16. Примеры монотерпенов и монотерпеноидов включают: гераниол, терпинеол (присутствует в сирени), лимонен (присутствует в цитрусовых), мирцен (присутствует в хмеле), линалоол (присутствует в лаванде) или пинен (присутствует в соснах).[20] Иридоиды происходят из монотерпенов.
- Сесквитерпены состоит из три изопрена единиц и имеют молекулярную формулу C15ЧАС24. Примеры сесквитерпенов и сесквитерпеноидов включают: гумулен, фарнезен, фарнезол. (The полуторный префикс означает полторы.)
- Дитерпены состоят из четыре изопрена единиц и имеют молекулярную формулу C20ЧАС32. Они происходят от геранилгеранилпирофосфат. Примеры дитерпенов и дитерпеноидов: кафестол, кахвеол, Cembrene и таксадиен (предшественник таксол ). Дитерпены также составляют основу биологически важных соединений, таких как ретинол, сетчатка, и фитол.
- Сестертерпены, терпены с 25 атомами углерода и пять изопрена единиц, встречаются редко по сравнению с другими размерами. (The сестер- префикс означает два с половиной.) Пример сестертерпеноида: геранилфарнезол.
- Тритерпены состоит из шесть изопрена единиц и имеют молекулярную формулу C30ЧАС48. Линейный тритерпен сквален, основная составляющая жир печени акулы, происходит в результате восстановительного взаимодействия двух молекул фарнезилпирофосфат. Затем сквален биосинтетически перерабатывается с образованием либо ланостерин или же циклоартенол, структурные предшественники всех стероиды.
- Сесквартерпены состоят из семь изопрена единиц и имеют молекулярную формулу C35ЧАС56. Сесквартерпены обычно имеют микробное происхождение. Примерами сесквартерпеноидов являются ферругикадиол и тетрапренилкукумен.
- Тетратерпены содержать восемь изопрена единиц и имеют молекулярную формулу C40ЧАС64. Биологически важные тетратерпеноиды включают ациклические ликопин, моноциклический гамма-каротин, а бициклический альфа- и бета-каротины.
- Политерпены состоят из длинных цепочек много изопрена единицы. Естественный резинка состоит из полиизопрена, в котором двойные связи СНГ. Некоторые заводы производят полиизопрен с транс двойные связи, известные как гуттаперча.
- Норизопреноиды, например, C13-норизопреноид 3-оксо-α-ионол, присутствующий в Мускат Александрийский листьев и производные 7,8-дигидроионона, такие как мегастигман-3,9-диол и 3-оксо-7,8-дигидро-α-ионол, обнаруженные в Шираз листья (оба сорта винограда в виде Vitis vinifera )[21] или же вино[22][23] (отвечает за некоторые из ноты специй в Шардоне ), могут быть вызваны грибковыми пероксидазы[24] или же гликозидазы.[25]

Промышленные синтезы
Хотя терпены и терпеноиды широко распространены, их извлечение из природных источников часто бывает проблематичным. Следовательно, их получают путем химического синтеза, обычно из нефтехимия. В одном случае ацетон и ацетилен конденсируются с образованием 2-метилбут-3-ин-2-ол, который расширен ацетоуксусным эфиром с образованием геранилового спирта. Другие готовятся из тех терпенов и терпеноидов, которые легко выделяются в большом количестве, например, из бумаги и талловое масло отрасли. Например, α-пинен, который легко получить из природных источников, превращается в цитронеллаль и камфора. Цитронеллаль также превращается в оксид розы и ментол.[1]

Рекомендации
- ^ а б Эберхард Брайтмайер (2006). Терпены: ароматизаторы, ароматизаторы, Pharmaca, феромоны. Wiley-VCH. Дои:10.1002/9783527609949. ISBN 9783527609949.
- ^ а б c d Дэвис, Эдвард М .; Крото, Родни (2000). «Ферменты циклизации в биосинтезе монотерпенов, сесквитерпенов и дитерпенов». Биосинтез. Темы современной химии. 209. С. 53–95. Дои:10.1007 / 3-540-48146-X_2. ISBN 978-3-540-66573-1.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ . Дои:10.1038 / природа08043. Цитировать журнал требует
| журнал =(помощь); Отсутствует или пусто| название =(помощь) - ^ Омар, Джоун; Оливарес, Майтан; Алонсо, Ибоне; Вальехо, Азиер; Айзпуруа-Олайзола, Ойер; Etxebarria, Нестор (апрель 2016 г.). «Количественный анализ биоактивных соединений из ароматических растений с помощью динамической экстракции в свободном пространстве и множественной экстракции в свободном пространстве - газовая хроматография-масс-спектрометрия: количественный анализ биоактивных соединений…». Журнал пищевой науки. 81 (4): C867 – C873. Дои:10.1111/1750-3841.13257. PMID 26925555.
- ^ Мартин, Д. М .; Gershenzon, J .; Больманн, Дж. (Июль 2003 г.). «Индукция биосинтеза летучих терпенов и суточной эмиссии метилжасмонатом в листве ели европейской». Физиология растений. 132 (3): 1586–1599. Дои:10.1104 / стр.103.021196. ЧВК 167096. PMID 12857838.
- ^ Пичерский, Е. (10 февраля 2006 г.). «Биосинтез летучих веществ растений: разнообразие природы и изобретательность». Наука. 311 (5762): 808–811. Bibcode:2006Научный ... 311..808П. Дои:10.1126 / science.1118510. ЧВК 2861909. PMID 16469917.
- ^ Адам, Дэвид (31 октября 2008 г.). «Ученые обнаруживают в деревьях вещества, сгущающие облака, которые могут стать новым оружием в борьбе с глобальным потеплением».. Хранитель.
- ^ Nutting, W. L .; Blum, M. S .; Фалес, Х. М. (1974). "Поведение термитов Северной Америки, Tenuirostritermes tenuirostris, с особым акцентом на секрете лобной железы солдата, его химическом составе и использовании в защите ". Психея. 81 (1): 167–177. Дои:10.1155/1974/13854. Получено 22 июля 2011.
- ^ Silvestre, Armando J.D .; Гандини, Алессандро (2008). «Терпены: основные источники, свойства и применение». Мономеры, полимеры и композиты из возобновляемых источников. С. 17–38. Дои:10.1016 / B978-0-08-045316-3.00002-8. ISBN 9780080453163.
- ^ Эггерсдорфер, Манфред (2000). «Терпены». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a26_205.
- ^ Steenackers, B .; De Cooman, L .; Де Вос, Д. (2015). «Химические превращения характерных вторичных метаболитов хмеля в зависимости от свойств пива и процесса пивоварения: обзор». Пищевая химия. 172: 742–756. Дои:10.1016 / j.foodchem.2014.09.139. PMID 25442616.
- ^ Исман, М. Б. (2000). «Эфирные масла растений для борьбы с вредителями и болезнями». Защита урожая. 19 (8–10): 603–608. Дои:10.1016 / S0261-2194 (00) 00079-X.
- ^ Кекуле ввел термин «терпен» для обозначения всех углеводородов, имеющих эмпирическую формулу C10ЧАС16, из которых камфена был одним. Ранее многие углеводороды, имеющие эмпирическую формулу C10ЧАС16 был назван «камфеном», но многие другие углеводороды того же состава носили другие названия. Поэтому Кекуле ввел термин «терпен», чтобы уменьшить путаницу.
- Кекуле, август (1866 г.). Lehrbuch der Organischen Chemie [Учебник органической химии] (на немецком). т. 2. Эрланген, (Германия): Фердинанд Энке. С. 464–465. Со стр. 464–465: "Mit dem Namen Terpene bezeichnen wir… unter verschiedenen Namen aufgeführt werden". (Под названием «терпен» мы обычно обозначаем углеводороды, составленные согласно [эмпирической] формуле C10ЧАС16 (см. § 1540). Многие химики относят углеводороды формулы C10ЧАС16 под общим названием «камфен». Это название кажется неподходящим, потому что определенное вещество этой группы было обозначено как «камфен». В общем, существует большая путаница в обозначении веществ, принадлежащих здесь [т. Е. К терпеновой группе]. Многие, очевидно, разные углеводороды долгое время не различались и им были присвоены одни и те же названия, в то время как, с другой стороны, вероятно идентичные вещества из разных источников часто определялись разными именами.
- Дев, Сух (1989). «Глава 8. Изопреноиды: 8.1. Терпеноиды.». В Роу, Джон У. (ред.). Натуральные продукты древесных растений: химические вещества, посторонние для лигноцеллюлозной клеточной стенки. Берлин и Гейдельберг, Германия: Springer-Verlag. С. 691–807. ; см. стр. 691.
- ^ «Золотая книга ИЮПАК - терпеноиды».
- ^ . Дои:10.1002 / hlca.200590245. Цитировать журнал требует
| журнал =(помощь); Отсутствует или пусто| название =(помощь) - ^ Кумари, I .; Ахмед, М .; Ахтер, Ю. (2017). «Эволюция каталитического микроокружения определяет разнообразие субстратов и продуктов в триходиен-синтазе и других ферментах терпеновой складки». Биохимия. 144: 9–20. Дои:10.1016 / j.biochi.2017.10.003. PMID 29017925.
- ^ Pazouki, L .; Niinemets, Ü. (2016). «Многосубстратные терпеносинтазы: их появление и физиологическое значение». Границы науки о растениях. 7: 1019. Дои:10.3389 / fpls.2016.01019. ЧВК 4940680. PMID 27462341.
- ^ Бутанаев, А. М .; Моисей, Т .; Zi, J .; Nelson, D. R .; Mugford, S.T .; Peters, R.J .; Осборн, А. (2015). «Исследование диверсификации терпенов в нескольких секвенированных геномах растений». Труды Национальной академии наук. 112 (1): E81 – E88. Bibcode:2015ПНАС..112Э..81Б. Дои:10.1073 / pnas.1419547112. ЧВК 4291660. PMID 25502595.
- ^ Ружичка, Леопольд (1953). «Правило изопрена и биогенез терпеновых соединений». Клеточные и молекулярные науки о жизни. 9 (10): 357–367. Дои:10.1007 / BF02167631. PMID 13116962. S2CID 44195550.
- ^ Брейтмайер, Эберхард (2006). Терпены: ароматизаторы, ароматизаторы, Pharmaca, феромоны. Джон Вили и сыновья. С. 1–13. ISBN 978-3527317868.
- ^ Günata, Z .; Wirth, J. L .; Guo, W .; Баумес, Р. Л. (2001). Ароматические соединения, производные каротиноидов; Глава 13: Состав норизопреноидного агликона из листьев и ягод винограда из муската Александрийского и Ширазского сортов. Серия симпозиумов ACS. 802. С. 255–261. Дои:10.1021 / bk-2002-0802.ch018. ISBN 978-0-8412-3729-2.
- ^ Winterhalter, P .; Сефтон, М. А .; Уильямс, П. Дж. (1990). "Летучий C13-Норизопреноидные соединения в вине Рислинг образуются из множества прекурсоров ». Американский журнал энологии и виноградарства. 41 (4): 277–283.
- ^ Vinholes, J .; Коимбра, М. А .; Роча, С. М. (2009). «Быстрый инструмент для оценки C13 норизопреноиды в винах ». Журнал хроматографии А. 1216 (47): 8398–8403. Дои:10.1016 / j.chroma.2009.09.061. PMID 19828152.
- ^ Зеленая, К .; Hardebusch, B .; Hülsdau, B .; Berger, R.G .; Зорн, Х. (2009). «Генерация норизопреноидных ароматизаторов из каротиноидов грибковыми пероксидазами». Журнал сельскохозяйственной и пищевой химии. 57 (21): 9951–9955. Дои:10.1021 / jf901438m. PMID 19817422.
- ^ Cabaroğlu, T .; Selli, S .; Canbaş, A .; Lepoutre, J.-P .; Гюната, З. (2003). «Улучшение вкуса вина за счет использования экзогенных грибковых гликозидаз». Ферментные и микробные технологии. 33 (5): 581–587. Дои:10.1016 / S0141-0229 (03) 00179-0.
внешняя ссылка
- Институт химии - терпены
- Структуры альфа-пинена и бета-пинена
- Терпены в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Папа, Фрэнк Джордж (1911). . В Чисхолме, Хью (ред.). Британская энциклопедия. 26 (11-е изд.). Издательство Кембриджского университета. С. 647–652. Это содержит подробный обзор химии многих терпенов, которые недавно были полностью исследованы.