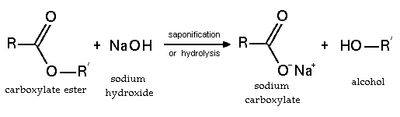
Сложный эфир - Ester
В химия, сложный эфир это химическое соединение полученный из кислота (органический или неорганический), в котором хотя бы один –OH (гидроксил) заменяется на –O–алкил (алкокси ) группа.[1] Обычно сложные эфиры получают в результате реакции замещения карбоновая кислота и алкоголь. Глицериды, которые сложные эфиры жирных кислот из глицерин, являются важными эфирами в биологии, являясь одним из основных классов липиды, и составляют основную часть животных жиров и растительных масел. Сложные эфиры с низкой молекулярной массой обычно используются в качестве ароматизаторов и содержатся в эфирные масла и феромоны. Фосфоэфиры сформировать основу ДНК молекулы. Сложные эфиры нитратов, Такие как нитроглицерин, известны своими взрывоопасными свойствами, а полиэфиры важные пластмассы, с мономеры связано эфиром части. Сложные эфиры обычно имеют сладкий запах и считаются высококачественными растворителями для широкого спектра пластиков, пластификаторы, смолы, и лаки.[2] Они также являются одним из крупнейших классов синтетических смазочных материалов на коммерческом рынке.[3]
Номенклатура
Этимология
Слово сложный эфир был изобретен в 1848 году немецким химиком Леопольд Гмелин,[4] вероятно как сокращение немецкого Эссигэтер, "уксусный эфир ".
Номенклатура ИЮПАК
Названия сложных эфиров образованы от исходного спирта и исходной кислоты, причем последняя может быть органической или неорганической. Сложные эфиры, полученные из простейших карбоновых кислот, обычно называют в соответствии с более традиционным, так называемым "банальные имена «например, как формиат, ацетат, пропионат и бутират, в отличие от метаноата, этаноата, пропаноата и бутаноата по номенклатуре ИЮПАК. Сложные эфиры, полученные из более сложных карбоновых кислот, с другой стороны, чаще называют с использованием систематического названия ИЮПАК, основанного на в названии кислоты следует суффикс -оат. Например, гексилоктаноат сложного эфира, также известный под тривиальным названием гексил каприлат, имеет формулу CH3(CH2)6CO2(CH2)5CH3.
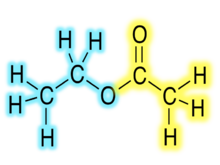
Химические формулы органических сложных эфиров обычно имеют вид RCO2R ', где R и R' представляют собой углеводородные части карбоновой кислоты и спирта соответственно. Например, бутил ацетат (систематически бутилэтаноат), полученный из бутанол и уксусная кислота (систематически этановая кислота) будет написано CH3CO2C4ЧАС9. Альтернативные презентации распространены, включая BuOAc и CH.3COOC4ЧАС9.
Циклические эфиры называются лактоны, независимо от того, получены ли они из органической или неорганической кислоты. Одним из примеров органического лактона является γ-валеролактон.
Ортоэфиры
Необычным классом органических сложных эфиров являются ортоэфиры, которые имеют формулу RC (OR ′)3. Триэтилортоформиат (HC (OC2ЧАС5)3) происходит от имени (но не синтеза) от ортомуравьиная кислота (НС (ОН)3) и этиловый спирт.
Неорганические эфиры

Сложные эфиры также могут быть производными неорганических кислот.
- Фосфорная кислота формы фосфорные эфиры, например трифенилфосфат
- серная кислота формы сульфатные эфиры, например, диметилсульфат
- азотная кислота формы нитратные эфиры, например метилнитрат
- борная кислота формы бораты, например триметилборат.
- угольная кислота формы карбонатные эфиры, например этиленкарбонат
Неорганические кислоты, существующие в виде таутомеров, образуют различные сложные эфиры.
- фосфористая кислота образует два вида фосфитовые эфиры, например триэтилфосфит (Поэт)3) и диэтилфосфит (HP (O) (OEt)2).
Неорганические кислоты, которые являются нестабильными или трудноуловимыми, образуют стабильные сложные эфиры.
- хромовая кислота, который никогда не был обнаружен, формирует ди-трет-бутилхромат
- сернистая кислота, что редко, образует диметилсульфит
В принципе все металлы и металлоиды алкоксиды, из которых известны многие сотни, могут быть классифицированы как сложные эфиры гипотетических кислот.
Структура и склеивание
Сложные эфиры содержат карбонил центр, что дает углы 120 ° C – C – O и O – C – O. В отличие от амиды, сложные эфиры являются структурно гибкими функциональными группами, поскольку вращение вокруг связей C – O – C имеет низкий барьер. Их гибкость и низкая полярность проявляется в их физических свойствах; они имеют тенденцию быть менее жесткими (более низкая точка плавления) и более летучими (более низкая температура кипения), чем соответствующие амиды.[5] В пKа альфа-водородов сложных эфиров составляет около 25.[6]
Многие эфиры обладают потенциалом конформационная изомерия, но они склонны принимать s-cis (или Z) конформация, а не s-trans (или E) альтернатива, из-за комбинации сверхсопряжение и дипольная минимизация последствия. Предпочтение Z-конформации зависит от природы заместителей и растворителя, если он присутствует.[7][8] Лактоны с маленькими кольцами ограничены s-транс (то есть E) конформация из-за их циклической структуры.

Физические свойства и характеристики
Эфиры более полярны, чем эфиры но менее полярны, чем спирты. Они участвуют в водородные связи как акцепторы водородных связей, но не могут действовать как доноры водородных связей, в отличие от их родительских спиртов. Эта способность участвовать в водородных связях придает некоторую растворимость в воде. Из-за отсутствия способности отдавать водородные связи сложные эфиры не образуют самоассоциации. Следовательно, сложные эфиры более летучие, чем карбоновые кислоты аналогичной молекулярной массы.[5]
Характеристика и анализ
Сложные эфиры обычно идентифицируют с помощью газовой хроматографии, учитывая их летучесть. ИК спектры для сложных эфиров - интенсивная резкая полоса в диапазоне 1730–1750 см.−1 назначен νC = O. Этот пик изменяется в зависимости от функциональных групп, присоединенных к карбонилу. Например, бензольное кольцо или двойная связь в сочетании с карбонилом уменьшит волновое число примерно на 30 см.−1.
Приложения и возникновение
Сложные эфиры широко распространены в природе и широко используются в промышленности. В природе, жиры в основном триэфиры, полученные из глицерин и жирные кислоты.[10] Сложные эфиры отвечают за аромат многих фруктов, в том числе яблоки, дурианы, груши, бананы, ананасы, и клубника.[11] Ежегодно промышленным способом производится несколько миллиардов килограммов полиэфиров, важными из которых являются полиэтилентерефталат, акрилатные эфиры, и ацетат целлюлозы.[12]
 Типичный триглицерид, содержащийся в льняном масле, триэфир (триглицерид ) полученный из линолевая кислота, альфа-линоленовая кислота, и олеиновая кислота.
Типичный триглицерид, содержащийся в льняном масле, триэфир (триглицерид ) полученный из линолевая кислота, альфа-линоленовая кислота, и олеиновая кислота.
Подготовка
Этерификация - общее название химическая реакция в котором два реагента (обычно спирт и кислота) образуют сложный эфир в качестве продукт реакции. Сложные эфиры распространены в органической химии и биологических материалах и часто имеют приятный характерный фруктовый запах. Это приводит к их широкому использованию в аромат и вкус промышленность. Сложноэфирные связи также встречаются во многих полимеры.
Этерификация карбоновых кислот спиртами
Классический синтез - это Этерификация Фишера, который включает обработку карбоновой кислоты спиртом в присутствии обезвоживание агент:
- RCO2H + R'OH ⇌ RCO2R ′ + H2О
Константа равновесия для таких реакций составляет около 5 для типичных сложных эфиров, например этилацетата.[13] В отсутствие катализатора реакция протекает медленно. Серная кислота является типичным катализатором этой реакции. Также используются многие другие кислоты, такие как полимерные сульфоновые кислоты. Поскольку этерификация очень обратима, выход сложного эфира можно повысить, используя Принцип Ле Шателье:
- Использование спирта в больших количествах (т.е. в качестве растворителя).
- Использование дегидратирующего агента: серная кислота не только катализирует реакцию, но и связывает воду (продукт реакции). Другие осушающие агенты, такие как молекулярные сита также эффективны.
- Удаление воды физическими средствами, такими как дистилляция как низкокипящий азеотропы с толуол, в сочетании с Аппарат Дина-Старка.
Известны реагенты, управляющие дегидратацией смесей спиртов и карбоновых кислот. Одним из примеров является Этерификация Стеглиха, который представляет собой метод образования сложных эфиров в мягких условиях. Метод популярен в пептидный синтез, где подложки чувствительны к суровым условиям, например к высокой температуре. DCC (дициклогексилкарбодиимид ) используется для активации карбоновой кислоты для дальнейшей реакции. 4-диметиламинопиридин (DMAP) используется как переносчик ацила катализатор.[14]
Другой метод обезвоживания смесей спиртов и карбоновых кислот - это Мицунобу реакция:
- RCO2H + R′OH + P (C6ЧАС5)3 + R2N2 → RCO2R ′ + OP (C6ЧАС5)3 + R2N2ЧАС2
Карбоновые кислоты могут быть этерифицированы с использованием диазометан:
- RCO2H + CH2N2 → RCO2CH3 + N2
Используя этот диазометан, смеси карбоновых кислот могут быть превращены в их метиловые эфиры с почти количественными выходами, например, для анализа с помощью газовая хроматография. Этот метод полезен в специализированных операциях по производству органического синтеза, но считается слишком опасным и дорогим для крупномасштабных применений.
Этерификация карбоновых кислот эпоксидами
Карбоновые кислоты этерифицируются обработкой эпоксидами с образованием β-гидроксиэфиров:
- RCO2H + RCHCH2O → RCO2CH2СН (ОН) R
Эта реакция используется в производстве винилэфирная смола смолы из акриловая кислота.
Алкоголиз ацилхлоридов и ангидридов кислот
Спирты реагируют с ацилхлориды и ангидриды кислот дать сложные эфиры:
- RCOCl + R′OH → RCO2R ′ + HCl
- (RCO)2O + R′OH → RCO2R ′ + RCO2ЧАС
Реакции необратимые, упрощающие отработка. Поскольку ацилхлориды и ангидриды кислот также реагируют с водой, предпочтительны безводные условия. Аналогичное ацилирование аминов с получением амиды менее чувствительны, потому что амины сильнее нуклеофилы и реагирует быстрее, чем вода. Этот метод используется только для лабораторных процедур, так как он дорогостоящий.
Алкилирование карбоксилатных солей
Хотя соли карбоксилат-анионов широко не используются для этерификации, они могут быть алкилирующим агентом с алкилгалогениды давать эфиры.[12] В случае, если алкилхлорид используется йодидная соль может катализировать реакцию (Реакция Финкельштейна ). Карбоксилатная соль часто образуется на месте.[15] В сложных случаях можно использовать карбоксилат серебра, поскольку ион серебра координируется с галогенидом, способствуя его уходу и улучшая скорость реакции. Эта реакция может страдать от проблем с доступностью анионов и, следовательно, может выиграть от добавления катализаторы межфазного переноса или сильно полярный апротонные растворители Такие как DMF.
Переэтерификация
Переэтерификация, который включает в себя замену одного сложного эфира на другой, широко практикуется:
- RCO2R ′ + CH3OH → RCO2CH3 + R'OH
Как и гидролизация, переэтерификация катализируется кислотами и основаниями. Реакция широко используется для разложения триглицериды, например при производстве сложных эфиров жирных кислот и спиртов. Полиэтилентерефталат) производится путем переэтерификации диметилтерефталат и этиленгликоль:[12]
- (C6ЧАС4) (CO2CH3)2 + 2 С2ЧАС4(ОЙ)2 → 1⁄п {(C6ЧАС4) (CO2)2(C2ЧАС4)}п + 2 канала3ОЙ
Подмножеством переэтерификации является алкоголиз дикетен. Эта реакция дает 2-кетоэфиры.[12]
- (CH2CO)2 + ROH → CH3C (O) CH2CO2р
Карбонилирование
Алкены претерпевают "гидроэтерификация " в присутствии карбонил металла катализаторы. Сложные эфиры пропионовая кислота производятся серийно этим методом:
- C2ЧАС4 + ROH + CO → C2ЧАС5CO2р
Препарат метилпропионат один иллюстративный пример.
- C2ЧАС4 + CO + MeOH → MeO2CCH2CH3
Карбонилирование метанол дает метилформиат, который является основным коммерческим источником муравьиная кислота. Реакция катализируется метоксид натрия:
- CH3ОН + СО → СН3О2CH
Присоединение карбоновых кислот к алкенам и алкинам
В присутствии палладий катализаторы на основе этилена, уксусная кислота, и кислород реагировать, чтобы дать винилацетат:
- C2ЧАС4 + CH3CO2H +1⁄2 О2 → С2ЧАС3О2CCH3 + H2О
Прямые маршруты к этому же эфиру невозможны, потому что виниловый спирт нестабильно.
Карбоновые кислоты также добавляются через алкины, чтобы получить те же продукты.
Кремневольфрамовая кислота используется для производства ацетат этила посредством алкилирование из уксусная кислота по этилену:
- C2ЧАС4 + CH3CO2H → CH3CO2C2ЧАС5
Из альдегидов
В Тищенко реакция вовлекать непропорциональность из альдегид в присутствии безводного основания с образованием сложного эфира. Катализаторы представляют собой алкоксиды алюминия или алкоксиды натрия. Бензальдегид реагирует с бензилоксидом натрия (образуется из натрий и бензиловый спирт ) чтобы генерировать бензилбензоат.[16] Метод используется при производстве ацетат этила из ацетальдегид.[12]
Другие методы
- Перестановка Фаворского α-галогенкетонов в присутствии основания
- Окисление Байера-Виллигера кетонов с пероксидами
- Пиннер реакция из нитрилы с алкоголем
- Нуклеофильная абстракция металл-ацильного комплекса
- Гидролиз ортоэфиры в водной кислоте
- Целлюлолиз путем этерификации[17]
- Озонолиз из алкены используя работать в присутствии соляная кислота и различные спирты.[18]
- Анодное окисление из метил кетоны приводит к метиловым эфирам.[19]
Реакции
Сложные эфиры реагируют с нуклеофилами у карбонильного углерода. Карбонил слабо электрофилен, но подвергается атаке сильных нуклеофилов (аминов, алкоксидов, источников гидридов, литийорганических соединений и т. Д.). Связи С – Н, прилегающие к карбонилу, слабо кислые, но подвергаются депротонированию сильными основаниями. Этот процесс обычно инициирует реакции конденсации. Карбонильный кислород в сложных эфирах является слабоосновным, в меньшей степени, чем карбонильный кислород в амидах из-за резонансного пожертвования электронной пары из азота в амидах, но образует аддукты.
Гидролиз и омыление
Этерификация - обратимая реакция. Эфиры подвергаются гидролиз в кислотных и основных условиях. В кислых условиях реакция является обратной реакцией Этерификация Фишера. В базовых условиях гидроксид действует как нуклеофил, а алкоксид - уходящая группа. Эта реакция, омыление, является основой мыловарения.
Алкоксидная группа также может быть замещена более сильными нуклеофилами, такими как аммиак или первичный или вторичный амины давать амиды: (реакция аммонолиза)
- RCO2R ′ + NH2R ″ → RCONHR ″ + R′OH
Эта реакция обычно необратима. Вместо аминов можно использовать гидразины и гидроксиламин. Сложные эфиры можно превратить в изоцианаты через промежуточный гидроксамовые кислоты в Перестановка Лоссена.
Источники углеродных нуклеофилов, например, Реактивы Гриньяра и литийорганические соединения легко присоединяются к карбонилу.
Снижение
По сравнению с кетонами и альдегидами сложные эфиры относительно устойчив к снижению. Введение каталитического гидрирования в начале 20 века было прорывом; сложные эфиры жирных кислот гидрируются до жирные спирты.
- RCO2R ′ + 2 H2 → RCH2ОН + R'OH
Типичный катализатор хромит меди. До разработки каталитическое гидрирование, сложные эфиры были восстановлены в больших масштабах с использованием Редукция Буво – Блана. В этом методе, который в значительной степени устарел, используется натрий в присутствии источников протонов.
Специально для тонкого химического синтеза, литийалюминийгидрид используется для восстановления сложных эфиров до двух первичных спиртов. Соответствующий реагент борогидрид натрия медленен в этой реакции. ДИБА восстанавливает сложные эфиры до альдегидов.[20]
Прямое сокращение для получения соответствующего эфир сложно как промежуточный полуацеталь имеет тенденцию разлагаться с образованием спирта и альдегида (который быстро восстанавливается с образованием второго спирта). Реакция может быть достигнута с помощью триэтилсилан с различными кислотами Льюиса.[21][22]
Что касается альдегиды, атомы водорода на углероде, примыкающем («от α к») к карбоксильной группе в сложных эфирах, достаточно кислые, чтобы подвергаться депротонированию, что, в свою очередь, приводит к множеству полезных реакций. Депротонирование требует относительно сильных оснований, таких как алкоксиды. Депротонирование дает нуклеофильную энолировать, который может дополнительно реагировать, например, Клейзеновская конденсация и его внутримолекулярный эквивалент Конденсация Дикмана. Это преобразование используется в синтез эфира малоновой кислоты, при этом сложный диэфир малоновая кислота реагирует с электрофилом (например, алкилгалогенид ), а затем декарбоксилируется. Другой вариант - Алкилирование Фратера-Зеебаха.
Другие реакции
- Фениловые эфиры реагируют с гидроксиарилкетонами в Перестановка фри.
- Конкретные сложные эфиры функционализированы α-гидроксильной группой в Перестановка Чана.
- Сложные эфиры с β-атомами водорода могут быть превращены в алкены в пиролиз сложного эфира.
- Прямое преобразование сложных эфиров в нитрилы.[23]
Защита групп
Как класс сложные эфиры служат защитные группы за карбоновые кислоты. Защита карбоновой кислоты полезна в синтезе пептидов, чтобы предотвратить самореакцию бифункциональной аминокислоты. Метиловые и этиловые эфиры обычно доступны для многих аминокислот; то т-бутиловый эфир, как правило, дороже. Тем не мение, т-бутиловые эфиры особенно полезны, потому что в сильнокислых условиях т-бутиловые эфиры отщепляются с образованием карбоновой кислоты и изобутилен, упрощая работу.
Список эфирных ароматизаторов
Многие сложные эфиры имеют характерный фруктовый запах, и многие из них естественным образом содержатся в эфирных маслах растений. Это также привело к их обычному использованию в искусственных ароматизаторах и ароматизаторах, имитирующих эти запахи.
Смотрите также
- Список эфиров карбоксилата
- Амид, аналог сложного эфира с заменой кислорода на азот
- Цианатный эфир
- Олигоэстер
- Полиолэфир
- Тиоэстер, аналог сложного эфира с заменой кислорода на серу
- Переэтерификация
- Эфирный липид
Рекомендации
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "сложные эфиры ". Дои:10.1351 / goldbook.E02219
- ^ Кэмерон Райт (1986). Справочник для рабочего по опасностям, связанным с растворителями. Группа. п. 48.
- ^ Э. Ричард Бузер (21 декабря 1993 г.). Справочник CRC по смазке и трибологии, Том III: Мониторинг, материалы, синтетические смазочные материалы и их применение. CRC. п. 237. ISBN 978-1-4200-5045-5.
- ^ Леопольд Гмелин, Handbuch der Chemie, т. 4: Handbuch der Organischen Chemie (том 1) (Гейдельберг, Баден (Германия): Карл Винтер, 1848 г.), стр.182.
Первоначальный текст:
Перевод:б. Ester oder sauerstoffsäure Aetherarten.
Жанр "Эфирная труба".
Viele Mineralische und Organische Sauerstoffsäuren treten mit einer Alkohol-Art unter Ausscheidung von Wasser zu Neutralen flüchtigen ätherischen Verbindungen zusammen, welche man als gepaarte Verbindungen von Alkohol und Säuren-Wasser einer Salon Aether verbunden ist.б. Сложные эфиры или эфиры оксикислот.
Эфиры третьего типа.
Многие минеральные и органические кислоты, содержащие кислород, соединяются со спиртом при удалении воды с образованием нейтральных летучих эфирных соединений, которые можно рассматривать как связанные соединения спирта и кислоты с водой, или, согласно теории радикалов, как соли. в котором кислота связана с эфиром. - ^ а б Марч, Дж. Продвинутая органическая химия 4-е изд. Дж. Вили и сыновья, 1992: Нью-Йорк. ISBN 0-471-60180-2.
- ^ Химия енолов и енолатов - кислотность альфа-водородов
- ^ Дивакар М. Павар; Абдельнасер А. Халил; Дениз Р. Хукс; Кеннет Коллинз; Тихуана Эллиотт; Джеффори Стаффорд; Люсиль Смит; Эрик А. Ноэ (1998). "E и Z Конформации сложных эфиров, сложных эфиров тиолов и амидов ». Варенье. Chem. Soc. 120 (9): 2108–2112. Дои:10.1021 / ja9723848.
- ^ Кристоф Дюгав; Люк Деманж (2003). «Цис-транс-изомеризация органических молекул и биомолекул: последствия и приложения». Chem. Ред. 103 (7): Chem. Ред. Дои:10.1021 / cr0104375.
- ^ А.А. Яковенко, Дж. Х. Гальегос, М.Ю. Антипин, А. Масунов, Т. В. Тимофеева (2011). «Морфология кристаллов как свидетельство супрамолекулярной организации в аддуктах 1,2-бис (хлормеркурио) тетрафторбензола с органическими сложными эфирами». Cryst. Рост Des. 11: 3964. Дои:10.1021 / cg200547k.CS1 maint: использует параметр авторов (связь)
- ^ Выделение триглицеридов из мускатного ореха: G. D. Beal "Trimyristen" Organic Syntheses, Coll. Vol. 1, с. 538 (1941). Связь
- ^ Макги, Гарольд. О еде и кулинарии ». 2003 год, Скрибнер, Нью-Йорк.
- ^ а б c d е Рименшнайдер, Вильгельм; Болт, Герман М. "Сложные органические эфиры". Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a09_565.pub2.
- ^ Уильямс, Роджер Дж .; Габриэль, Альтон; Эндрюс, Рой С. (1928). «Связь между константой гидролизного равновесия сложных эфиров и прочностью соответствующих кислот». Варенье. Chem. Soc. 50 (5): 1267–1271. Дои:10.1021 / ja01392a005.
- ^ Б. Нейзес; В. Стеглич. «Этерификация карбоновых кислот дициклогексилкарбодиимидом / 4-диметиламинопиридином: терт-Бутилэтилфумарат ». Органический синтез.; Коллективный объем, 7, п. 93
- ^ Мацумото, Коити; Симадзаки, Хаято; Миямото, Ю; Шимада, Кадзуаки; Хага, Фуми; Ямада, Юки; Миядзава, Хироцугу; Нишиваки, Кейджи; Кашимура, Сигенори (2014). «Простой и удобный синтез сложных эфиров карбоновых кислот и алкилгалогенидов с использованием фторида тетрабутиламмония». Журнал Oleo Science. 63 (5): 539–544. Дои:10.5650 / jos.ess13199. ISSN 1345-8957.
- ^ Kamm, O .; Камм, В. Ф. (1922). «Бензилбензоат». Органический синтез. 2: 5. Дои:10.15227 / orgsyn.002.0005.; Коллективный объем, 1, п. 104
- ^ Игнатьев, Игорь; Чарли Ван Дорслаер; Паскаль Г. Мертенс; Коэн Биннеманс; Дирк. Э. де Вос (2011). «Синтез сложных эфиров глюкозы из целлюлозы в ионных жидкостях».. Holzforschung. 66 (4): 417–425. Дои:10.1515 / hf.2011.161.
- ^ Ноймейстер, Иоахим; Кеул, Гельмут; Пратап Саксена, Махендра; Грисбаум, Карл (1978). «Озонное расщепление олефинов с образованием сложноэфирных фрагментов». Angewandte Chemie International Edition на английском языке. 17 (12): 939–940. Дои:10.1002 / anie.197809392.
- ^ Махова, Ирина В .; Элинсон, Михаил Н .; Никишин, Геннадий И. (1991). «Электрохимическое окисление кетонов в метаноле в присутствии бромидов щелочных металлов». Тетраэдр. 47 (4–5): 895–905. Дои:10.1016 / S0040-4020 (01) 87078-2.
- ^ W. Reusch. «Реакционная способность производных карбоксила». Виртуальный учебник органической химии. Архивировано из оригинал на 2016-05-16.
- ^ Ято, Мичихиса; Хомма, Коичи; Исида, Акихико (июнь 2001 г.). «Восстановление сложных эфиров карбоновых кислот до простых эфиров с помощью триэтилсилана при совместном использовании тетрахлорида титана и триметилсилилтрифторметансульфоната». Тетраэдр. 57 (25): 5353–5359. Дои:10.1016 / S0040-4020 (01) 00420-3.
- ^ Сакаи, Норио; Мория, Тошимицу; Конакахара, Такео (июль 2007 г.). «Эффективный синтез несимметричных эфиров в одном горшке: прямое восстановление деоксигенации сложных эфиров с использованием каталитической системы InBr3 / Et3SiH». Журнал органической химии. 72 (15): 5920–5922. Дои:10.1021 / jo070814z. PMID 17602594.
- ^ Wood, J. L .; Khatri, N.A .; Вайнреб, С. М. (1979). «Прямое преобразование сложных эфиров в нитрилы». Буквы Тетраэдра. 20 (51): 4907. Дои:10.1016 / S0040-4039 (01) 86746-0.