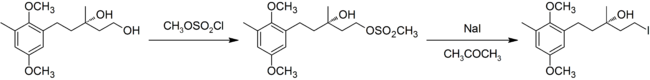Реакция Финкельштейна - Finkelstein reaction
| Реакция Финкельштейна | |
|---|---|
| Названный в честь | Ганс Финкельштейн |
| Тип реакции | Реакция замещения |
| Идентификаторы | |
| Портал органической химии | реакция Финкельштейна |
| RSC ID онтологии | RXNO: 0000155 |
В Реакция Финкельштейна назван в честь немецкого химика Ганс Финкельштейн,[1] является SN2 реакция (Нуклеофильная бимолекулярная реакция замещения), которая включает замену одного галоген атом для другого. Это равновесная реакция, но реакцию можно довести до завершения, используя дифференциальная растворимость галогенидных солей, или с использованием большого избытка галогенидной соли.[2]
- R – X + X ′− ⇌ R – X ′ + X−
Метод
Классическая реакция Финкельштейна влечет за собой превращение алкилхлорид или алкилбромид для алкилйодид обработкой раствором йодид натрия в ацетон. Йодид натрия растворим в ацетоне, а хлорид натрия и бромид натрия не.[3] Реакция направлена на продукты массовое действие из-за осаждения малорастворимого NaCl или NaBr. Пример включает превращение этилового эфира 5-бромавалериановая кислота к йодиду:[4]
- EtO2C (CH2)4Br + NaI → EtO2C (CH2)4I + NaBr
Фторид калия используется для преобразования хлороуглероды в фторуглероды.[5] В таких реакциях обычно используются полярные растворители, такие как диметилформамид, этиленгликоль, и диметилсульфоксид.[6]
Использовать для анализа
Алкилгалогениды сильно различаются по легкости, с которой они подвергаются реакции Финкельштейна. Реакция хорошо работает для первичной (кроме неопентил ) галогенидов, и исключительно хорошо для аллил, бензил, и α-карбонилгалогениды. Вторичные галогениды обладают гораздо меньшей реакционной способностью. Винил, арил и третичные алкилгалогениды неактивны; в результате реакцию NaI в ацетоне можно использовать в качестве качественного теста для определения того, к какому из вышеупомянутых классов принадлежит неизвестный галогенид алкила, за исключением алкилйодидов, поскольку они дают тот же продукт при замещении. Ниже приведены некоторые относительные скорости реакции (NaI в ацетоне при 60 ° C):[7][8]
| Me – Cl | Bu – Cl | я-Pr – Cl | т-БАК2–Cl | CH2= CH – CH2–Cl | PhCH2–Cl | EtOC (O) CH2–Cl | MeC (O) CH2–Cl |
|---|---|---|---|---|---|---|---|
| 179 | 1 | 0.0146 | 0.00003 | 64 | 179 | 1600 | 33000 |
В современном использовании определение реакции было расширено и теперь включает превращение спирты в алкилгалогениды, сначала превратив спирт в сульфонат сложный эфир (тозилаты или же мезилаты обычно используются), а затем выполнить замену. Приведенный ниже пример представляет собой синтез хризохламиновая кислота.[9]
Ароматическая реакция Финкельштейна
Ароматические хлориды и бромиды нелегко заменить йодидом, хотя они могут образоваться при соответствующем катализе. Так называемая «ароматическая реакция Финкельштейна» катализируется йодид меди (I) в сочетании с диаминовыми лигандами.[10] Бромид никеля и три-п-бутилфосфин также оказались подходящими катализаторами.[11]
Смотрите также
- Halex процесс, также солевой метатезис, но для превращения арилхлоридов в арилфториды
Рекомендации
- ^ Финкельштейн, Ганс (1910). "Darstellung organischer Jodide aus den entsprechenden Bromiden und Chloriden". Бер. Dtsch. Chem. Ges. (на немецком). 43 (2): 1528–1532. Дои:10.1002 / cber.19100430257.
- ^ Смит, Майкл Б .; Марш, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Эрвитхаясупорн, В. (2013). «Синтез в одном реакторе галогенсодержащих силсесквиоксанов: октакис (3-бромпропил) октасилсесквиоксана и октакис (3-иодопропил) октасилсесквиоксана». Dalton Trans. 42 (37): 13747–13753. Дои:10.1039 / C3DT51373D. PMID 23907310.
- ^ Б. Х. Липшуц, М. Р. Вуд и Р. Тирадо (1999). «Катализируемое медью конъюгатное добавление функционализированных цинкорганических реагентов к α, β-ненасыщенным кетонам: этил 5- (3-оксоциклогексил) пентаноат». Орг. Синтезатор. 76: 252. Дои:10.15227 / orgsyn.076.0252.CS1 maint: использует параметр авторов (связь)
- ^ Vogel, A. I .; Лестер, Дж .; Мейси, У.А.Т. (1956). «н-гексилфторид». Органический синтез. 36: 40. Дои:10.15227 / orgsyn.036.0040.
- ^ Han, Q .; Ли, Х-Й. «Фторид калия» в Энциклопедии реагентов для органического синтеза, 2001 г., John Wiley & Sons, Нью-Йорк. Дои:10.1002 / 047084289X.rp214
- ^ Штрайтвизер, А. (1956). «Сольволитические реакции вытеснения на насыщенных атомах углерода». Chem. Ред. 56 (4): 571–752. Дои:10.1021 / cr50010a001.
- ^ Bordwell, F.G .; Браннен, В. Т. (1964). «Влияние карбонильных и родственных групп на реакционную способность галогенидов в SN2 Реакции ». Варенье. Chem. Soc. 86 (21): 4645–4650. Дои:10.1021 / ja01075a025.
- ^ Мэлони, Д. Дж .; Хехт, С. М. (2005). "Стереоуправляемый синтез δ-транс-Токотриеноловая кислота ». Орг. Lett. 7 (19): 4297–300. Дои:10.1021 / ol051849t. PMID 16146411.
- ^ Клапарс, А .; Бухвальд, С. Л. (2002). "Катализированный медью галогенный обмен в арилгалогенидах: ароматическая реакция Финкельштейна". Варенье. Chem. Soc. 124 (50): 14844–14845. Дои:10.1021 / ja028865v. PMID 12475315.
- ^ Cant, Alastair A .; Бхалла, Раджив; Пимлотт, Салли Л .; Сазерленд, Эндрю (2012). «Катализируемая никелем ароматическая реакция Финкельштейна арил- и гетероарилбромидов». Chem. Commun. 48 (33): 3993–5. Дои:10.1039 / c2cc30956d. PMID 22422214.