Сложный эфир фосфита - Phosphite ester - Wikipedia
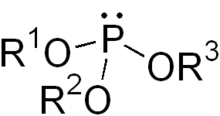
В химии сложный эфир фосфита или же органофосфит обычно относится к фосфорорганический соединение с формулой P (OR)3. Их можно рассматривать как сложные эфиры ненаблюдаемого таутомера фосфористая кислота, H3PO3, с простейшим примером триметилфосфит, P (OCH3)3. Некоторые фосфиты можно рассматривать как сложные эфиры доминирующего таутомера фосфористой кислоты (HP (O) (OH)2). Самый простой представитель - диметилфосфит с формулой HP (O) (OCH3)2. Оба класса фосфитов обычно представляют собой бесцветные жидкости.
Синтез
- С ПК3
Сложные эфиры фосфита обычно получают путем обработки трихлорид фосфора с алкоголь. В зависимости от синтетических деталей этот алкоголиз может дать диорганофосфиты:[1]
- PCl3 + 3 С2ЧАС5ОН → (С2ЧАС5O)2P (O) H + 2 HCl + C2ЧАС5Cl
В качестве альтернативы, когда алкоголиз проводят в присутствии акцепторов протонов, получают C3-симметричные триалкоксипроизводные:[2]
- PCl3 + 3 С2ЧАС5ОН + 3 R3N → (C2ЧАС5O)3P + 3 R3NHCl
Получены многочисленные производные обоих типов фосфитов.
- Путем переэтерификации
Сложные эфиры фосфита также могут быть получены переэтерификация, так как они претерпевают спиртовой обмен при нагревании с другими спиртами.[3] Этот процесс обратим и может использоваться для получения смешанных алкилфосфитов. В качестве альтернативы, если используется фосфит летучего спирта, например триметилфосфит, то побочный продукт (метанол ) можно удалить перегонкой, что позволит довести реакцию до завершения.
Реакции и применение трис (органо) фосфитов
Реакции
 Трис (2,4-ди-трет-бутилфенил) фосфит, широко используемый стабилизатор в полимерах
Трис (2,4-ди-трет-бутилфенил) фосфит, широко используемый стабилизатор в полимерах
Фосфиты окисляются до фосфатных эфиров:
- P (ИЛИ)3 + [O] → OP (ИЛИ)3
Эта реакция лежит в основе коммерческого использования некоторых сложных эфиров фосфита в качестве стабилизаторы в полимерах.[4]
Сложные эфиры алкилфосфита используются в Реакция Перкова для образования винилфосфонатов, а также в Реакция Михаэлиса – Арбузова формировать фосфонаты. Эфиры арилфосфита могут не вступать в эти реакции и поэтому обычно используются в качестве стабилизаторов в галогенсодержащих полимерах, таких как ПВХ.

Сложные эфиры фосфита могут использоваться в качестве восстановители в более специализированных случаях. Например, триэтилфосфит известно, что снижает некоторые гидропероксиды к спиртам, образованным самоокисление[5] (схема). В этом процессе фосфит превращается в фосфорный эфир. Этот тип реакции также используется в Полный синтез таксола Вендера.
Гомогенный катализ
Сложные эфиры фосфита бывают Базы Льюиса и, следовательно, может образовывать координационные комплексы с ионами различных металлов. Типичные фосфитные лиганды включают триметилфосфит ((MeO)3П), триэтилфосфит ((EtO)3П), триметилолпропан фосфит, и трифенилфосфит ((PhO)3П). Фосфиты проявляют меньшую углы конуса лиганда чем структурно связанные семейство фосфиновых лигандов. Фосфитные лиганды являются компонентами промышленных катализаторов для гидроформилирование и гидроцианирование.[6]
Химия HP (O) (OR)2
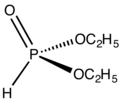 Состав диорганофосфита.
Состав диорганофосфита.
Диорганофосфиты являются производными фосфора (III) и могут рассматриваться как диэфиры фосфористая кислота. Они выставляют таутомерия, однако равновесие в подавляющем большинстве отдает предпочтение правой (фосфонатоподобной) форме:[9]
- (РО)2POH ⇌ (RO)2P (O) H
Связь P-H является участком высокой реакционной способности в этих соединениях (например, в Реакция Атертона – Тодда ), тогда как в триорганофосфитах неподеленная пара на фосфоре является участком с высокой реакционной способностью. Однако диорганофосфиты подвергаются переэтерификации.
Смотрите также
- Фосфинит P (ИЛИ) R2
- Фосфонит P (ИЛИ)2р
- Орто эфир CH (OR)3
- Эфир бората B (ИЛИ)3
Рекомендации
- ^ Малоуэн, Джон Э. (1953). «Диэтилфосфит». Неорганические синтезы. 4: 58–60. Дои:10.1002 / 9780470132357.ch19.
- ^ А. Х. Форд-Мур; Б. Дж. Перри (1963). «Триэтилфосфит». Органический синтез.; Коллективный объем, 4, п. 955
- ^ Hoffmann, Friedrich W .; Эсс, Ричард Дж .; Узингеф, Роберт П. (ноябрь 1956 г.). «Переэтерификация триалкилфосфитов алифатическими спиртами». Журнал Американского химического общества. 78 (22): 5817–5821. Дои:10.1021 / ja01603a026.
- ^ Райнер Вольф; Банси Лал Каул (2000). «Пластмассы, добавки». Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a20_459.
- ^ Дж. Н. Гарднер; Ф. Э. Карлон и О. Гной (1968). «Одностадийная процедура получения третичных α-кетолов из соответствующих кетонов». J. Org. Chem. 33 (8): 3294–3297. Дои:10.1021 / jo01272a055.
- ^ Айтор Гуаль; Кирилл Годар; Вероника де ла Фуэнте; Серхио Кастильон (2012). «Дизайн и синтез фосфитных лигандов для гомогенного катализа». У Пола К. Дж. Камера; Пит В. Н. М. ван Леувен (ред.). Лиганды фосфора (III) в гомогенном катализе: дизайн и синтез. Джон Вили и сыновья. Дои:10.1002 / 9781118299715.ch3.
- ^ Куни, Грегори Д.; Бухвальд, Стивен Л. (1993). «Практическое, высокопроизводительное, региоселективное, катализируемое родием гидроформилирование функционализированных α-олефинов». Журнал Американского химического общества. 115 (5): 2066–2068. Дои:10.1021 / ja00058a079.
- ^ Ван Рой, Аннемик; Kamer, Paul C.J .; Van Leeuwen, Piet W. N. M .; Губиц, Кес; Fraanje, Jan; Вельдман, Нора; Спек, Энтони Л. (1996). "Объемные модифицированные дифосфитом родиевые катализаторы: гидроформилирование и характеристика". Металлоорганические соединения. 15 (2): 835–847. Дои:10.1021 / OM950549K.
- ^ Doak, G.O .; Фридман, Леон Д. (1 февраля 1961 г.). «Структура и свойства диалкилфосфонатов». Химические обзоры. 61 (1): 31–44. Дои:10.1021 / cr60209a002.



