Клейзеновская конденсация - Claisen condensation
| Клейзеновская конденсация | |
|---|---|
| Названный в честь | Райнер Людвиг Клайзен |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | клайзен-конденсация |
| RSC ID онтологии | RXNO: 0000043 |
В Claisen конденсация это углерод-углеродная связь формирование реакция что происходит между двумя сложные эфиры или один эфир и другой карбонил соединение в присутствии сильная база с образованием β-кетоэфира или β-дикетон.[1] Он назван в честь Райнер Людвиг Клайзен, который впервые опубликовал свою работу о реакции в 1887 году.[2][3][4]

Требования
По крайней мере, один из реагенты должно быть энолизируемый (есть α-протон и иметь возможность пройти депротонирование сформировать енолят анион ). Существует ряд различных комбинаций енолизируемых и ненолизуемых карбонильных соединений, которые образуют несколько различных типы Клэйзена.
Используемая основа не должна мешать реакции, подвергаясь нуклеофильное замещение или же добавление с карбонильным углеродом. По этой причине конъюгат натрия алкоксид основание образующегося спирта (например, этоксид натрия если этиловый спирт образуется) часто используется, так как алкоксид регенерируется. В смешанных конденсациях Клайзена a ненуклеофильное основание Такие как диизопропиламид лития или LDA, поскольку только одно соединение является енолизируемым. LDA обычно не используется в классических Claisen или Конденсации Дикмана из-за енолизации электрофильный сложный эфир.
Алкоксильная часть сложного эфира должна быть относительно хорошей. уходящая группа. Метил и этил сложные эфиры, что дает метоксид и этоксид, соответственно.
Типы
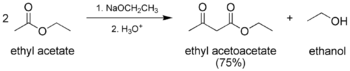
- Классическая конденсация Клайзена, самоконденсация между двумя молекулами соединения, содержащего енолизируемый сложный эфир.
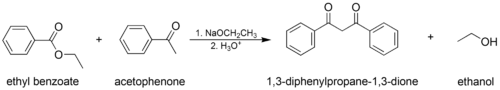
- Смешанная (или «перекрестная») конденсация Клайзена, где используются один енолизируемый сложный эфир или кетон и один ненализуемый сложный эфир.
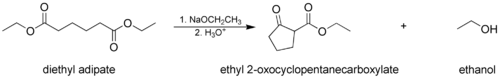
- В Конденсация Дикмана, где молекула с двумя сложноэфирными группами реагирует внутримолекулярно, образуя циклический β-кетоэфир. В этом случае образовавшееся кольцо нельзя напряженный, обычно 5- или 6-членная цепь или кольцо.
Механизм

На первом этапе механизма α-протон удаляется сильным основанием, что приводит к образованию енолят-аниона, который становится относительно стабильным за счет делокализация электронов. Затем карбонильный углерод (другого) сложного эфира подвергается нуклеофильной атаке енолят-анионом. Затем алкоксигруппа удаляется (что приводит к (повторному) образованию алкоксида), и алкоксид удаляет вновь образованный двойной α-протон с образованием нового енолятного аниона с высокой резонансной стабилизацией. Водный кислота (например. серная кислота или же фосфорная кислота ) добавляется на последнем этапе в нейтрализовать енолят и любое основание все еще присутствуют. Затем выделяют вновь образованный β-кетоэфир или β-дикетон. Обратите внимание, что реакция требует стехиометрический количество основания, поскольку удаление двойного α-протона термодинамически приводит к эндергонический реакция. То есть конденсация Клайзена не работает с субстраты имея только один α-водород из-за эффекта движущей силы депротонирования β-кетоэфира на последней стадии.
 |
| анимация |
Конденсация Стоббе
В Конденсация Стоббе[5] является модификацией, специфичной для диэтилового сложный эфир из Янтарная кислота требующие менее сильных оснований.[6] Примером может служить его реакция с бензофенон:[7]
А механизм реакции это объясняет образование как сложноэфирной группы, так и карбоновая кислота группа сосредоточена на лактон средний (5):
Конденсация Стоббе была использована на первом этапе синтеза Райнхарда Сарджеса таметралин[нужна цитата ] а также его можно использовать в синтезе димефадан.[нужна цитата ]
Смотрите также
Рекомендации
- ^ Кэри, Ф.А. (2006). Органическая химия (6-е изд.). Нью-Йорк, штат Нью-Йорк: Макгроу-Хилл. ISBN 0-07-111562-5.
- ^ Claisen, L .; Клапаред, А. (1881). "Condensationen von Ketonen mit Aldehyden". Berichte der Deutschen Chemischen Gesellschaft. 14 (2): 2460–2468. Дои:10.1002 / cber.188101402192.
- ^ Клэйзен, Л. (1887). "Ueber die Einführung von Säureradicalen in Ketone". Berichte der Deutschen Chemischen Gesellschaft. 20 (1): 655–657. Дои:10.1002 / cber.188702001150.
- ^ Hauser, C.R .; Хадсон, Б. Э. младший (1942). «Конденсация ацетоуксусного эфира и некоторые связанные реакции». Органические реакции. 1: 266–302. Дои:10.1002 / 0471264180.or001.09. ISBN 0471264180.
- ^ Стоббе, Х. (1899). "Condensation des Benzophenons mit Bernsteinsäureester". Юстус Либигс Аннален дер Хеми. 308 (1–2): 89–114. Дои:10.1002 / jlac.18993080106.
- ^ Марш, Джерри (1985), Продвинутая органическая химия: реакции, механизмы и структура (3-е изд.), Нью-Йорк: Wiley, ISBN 0-471-85472-7
- ^ Johnson, W. S .; Шнайдер, В. П. (1950). «β-КАРБЕТОКСИ-γ, γ-ДИФЕНИЛВИНИЛЕТИНОВАЯ КИСЛОТА» (PDF). Органический синтез. 30: 18.; Коллективный объем, 4, п. 132
внешняя ссылка
- "Клайзен Конденсация". Портал органической химии.