Охраняющая группа - Protecting group

А защитная группа или же защитная группа вводится в молекулу путем химической модификации функциональная группа чтобы получить хемоселективность в последующей химической реакции. Он играет важную роль в многоступенчатый органический синтез.[1]
Во многих приготовлениях тонких органических соединений некоторые определенные части их молекул не могут выжить в необходимых реагентах или химической среде. Затем эти части или группы должны быть защищенный. Например, литийалюминийгидрид это очень реактивный, но полезный реагент, способный снижать сложные эфиры к спирты. Он всегда будет реагировать карбонил группам, и этому нельзя препятствовать никакими средствами. Когда требуется восстановление сложного эфира в присутствии карбонила, необходимо предотвратить атаку гидрида карбонила. Например, карбонил превращается в ацеталь, который не реагирует с гидридами. Затем ацеталь называют защитная группа для карбонила. После завершения стадии с участием гидрида ацеталь удаляют (путем реакции с водной кислотой), возвращая исходный карбонил. Этот шаг называется снятие защиты.
Защитные группы чаще используются в небольших лабораторных работах и на начальных этапах разработки, чем в процессах промышленного производства, поскольку их использование добавляет дополнительные этапы и затраты на материалы. Однако наличие дешевого хирального строительного блока может преодолеть эти дополнительные затраты (например, шикимовая кислота за осельтамивир ).
Общие защитные группы
Алкогольные защитные группы
Защита спирты:
 Защита спирта тетрагидропираниловым эфиром с последующим снятием защиты. На обоих этапах требуются кислотные катализаторы.
Защита спирта тетрагидропираниловым эфиром с последующим снятием защиты. На обоих этапах требуются кислотные катализаторы.
- Ацетил (Ас) - удаляется кислотой или щелочью (см. Ацетокси группа ).
- Бензоил (Bz) - удаляется кислотой или основанием, более стабильной, чем группа Ac.
- Бензил (Bn) - Удалено гидрогенолиз. Группа Bn широко используется в химии сахаров и нуклеозидов.
- β-метоксиэтоксиметиловый эфир (MEM) - Удаляется кислотой.
- Диметокситритил, [бис- (4-метоксифенил) фенилметил] (DMT) - удаляется слабой кислотой. Группа DMT широко используется для защиты 5'-гидроксильной группы в нуклеозидах, особенно в синтез олигонуклеотидов.
- Метоксиметиловый эфир (МАМА) - Удаляется кислотой.
- Метокситритил [(4-метоксифенил) дифенилметил] (ММТ) - удаляется кислотой и гидрогенолизом.
- п-Метоксибензиловый эфир (PMB) - удаляется кислотой, гидрогенолизом или окислением.
- п-Метоксифениловый эфир (PMP) - удаляется окислением.
- Метилтиометиловый эфир - Удаляется кислотой.
- Пивалойл (Piv) - удаляется кислотой, щелочью или восстановителями. Он значительно более стабилен, чем другие защитные группы ацила.
- Тетрагидропиранил (THP) - Удаляется кислотой.
- Тетрагидрофуран (THF) - удаляется кислотой.
- Тритил (трифенилметил, Tr) - удаляется кислотой и гидрогенолизом.
- Силиловый эфир (самые популярные включают триметилсилил (ТМС), терт-бутилдиметилсилил (TBDMS), три-iso-пропилсилилоксиметиловый (TOM) и триизопропилсилиловый (TIPS) эфиры) - удаляются кислотой или фторид ион. (например, NaF, TBAF (тетра-п-фторид бутиламмония, HF-Py или HF-NEt3)). Группы TBDMS и TOM используются для защиты 2'-гидрокси-функции в нуклеозидах, особенно в синтез олигонуклеотидов.
- Метиловые эфиры - расщепление осуществляется TMSI в дихлорметане, ацетонитриле или хлороформе. Альтернативный метод расщепления метиловых эфиров - BBr.3 в DCM
- Этоксиэтиловые эфиры (EE) - расщепление более тривиально, чем простые эфиры, например 1N соляная кислота[2]
Защитные группы амина
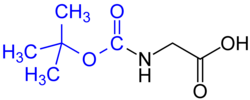
Защита амины:
- Карбобензилокси (Cbz) группа - Удалено гидрогенолиз
- п-Метоксибензилкарбонил (Moz или MeOZ) группа - Удалено гидрогенолиз, более лабильнее, чем Cbz
- терт-Бутилоксикарбонил (BOC) группа (распространена в твердофазный пептидный синтез ) - удаляется концентрированной сильной кислотой (такой как HCl или CF3COOH) или нагреванием до> 80 ° C.
- 9-флуоренилметилоксикарбонил (Fmoc ) группа (общие в твердофазный пептидный синтез ) - Удалено по базе, например пиперидин
- Ацетил (Ас) группа распространена в синтез олигонуклеотидов для защиты N4 в цитозин и N6 в аденин нуклеиновых оснований и удаляется обработкой основанием, чаще всего водным или газообразным аммиак или же метиламин. Ас слишком стабилен, чтобы его можно было легко удалить из алифатических амидов.
- Бензоил (Bz) группа распространена в синтез олигонуклеотидов для защиты N4 в цитозин и N6 в аденин нуклеиновых оснований и удаляется обработкой основанием, чаще всего водным или газообразным аммиаком или метиламином. Bz слишком стабилен, чтобы его можно было легко удалить из алифатических амидов.
- Бензил (Bn) группа - Удалено гидрогенолиз
- Карбамат группа - Удаляется кислотой и мягким нагреванием.
- п-Метоксибензил (PMB) - Удалено гидрогенолиз, более лабильнее, чем бензил
- 3,4-диметоксибензил (DMPM) - Удалено гидрогенолиз, более лабильнее, чем п-метоксибензил
- п-Метоксифенил (PMP) группа - Удалено нитрат аммония церия (IV) (МОЖЕТ)
- Тосыл (Ts) группа - удаляется концентрированной кислотой (HBr, H2ТАК4) и сильные восстановители (натрий в жидкости аммиак или же нафталинид натрия )
- Troc (трихлорэтилхлорформиат) группа - удаляется введением Zn в присутствии уксусной кислоты
- Другие сульфаниламиды (Нозил и Nps) группы - удаляются йодидом самария, гидрид трибутилолова[3]
Карбонильные защитные группы
Защита карбонил группы:
- Ацетали и Кеталы - Удаляется кислотой. Обычно ациклические ацетали расщепляются легче, чем циклические ацетали.
- Ацилалы - Удалено Кислоты Льюиса.
- Дитиан - Удаляется солями металлов или окислителями.
Защитные группы карбоновых кислот
Защита карбоновые кислоты:
- Метил сложные эфиры - Удаляется кислотой или щелочью.
- Бензил сложные эфиры - удаляются гидрогенолизом.
- терт-Бутил сложные эфиры - удаляются кислотой, основанием и некоторыми восстановителями.
- Сложные эфиры 2,6-дизамещенных фенолов (например, 2,6-диметилфенол, 2,6-диизопропилфенол, 2,6-ди-терт-бутилфенол ) - Удаляется при комнатной температуре DBU -катализируемый метанолиз в условиях высокого давления.[4]
- Силил сложные эфиры - удаляются кислотой, щелочью и металлоорганический реагенты.
- Ортоэфиры - Удаляется мягкой водной кислотой с образованием сложного эфира, который удаляется в соответствии со свойствами сложного эфира.
- Оксазолин - Удаляется сильной горячей кислотой (pH <1, T> 100 ° C) или щелочью (pH> 12, T> 100 ° C), но не, например, LiAlH4, литийорганические реагенты или же Реагенты Гриньяра (магнийорганические)
Фосфатные защитные группы
- 2-цианоэтил - снято мягкой базой. Группа широко используется в синтез олигонуклеотидов.
- Метил (Мне) - удаляется сильными нуклеофилами e.c. тиофенол / TEA.
Терминальные защитные группы алкинов
- Пропаргил спирты в Реакция Фаворского,
- Силильные группы, особенно в защите ацетилен сам.[5]
Другой
Ортогональная защита

Ортогональная защита представляет собой стратегию, позволяющую специфическое снятие защиты с одной защитной группы в многократно защищенной структуре, не затрагивая другие. Например, аминокислота тирозин может быть защищен в виде сложного бензилового эфира по карбоксильной группе, флуоренилметиленоксикарбамата по аминогруппе и терт-бутиловый эфир по фенольной группе. Бензиловый эфир можно удалить гидрогенолизом, флуоренилметиленоксигруппу (Fmoc) - основаниями (такими как пиперидин) и фенольными терт-бутиловый эфир, расщепленный кислотами (например, трифторуксусной кислотой).
Типичный пример для этого применения, синтез Fmoc-пептида, в котором пептиды выращивают в растворе и на твердой фазе, очень важен.[6] Защитные группы в твердофазный синтез Что касается условий реакции, таких как время реакции, температура и реагенты, могут быть стандартизированы, чтобы их можно было проводить с помощью машины, при этом выходы могут быть намного выше 99%. В противном случае разделение полученной смеси продуктов реакции практически невозможно.[7]
Техника была внедрена в области пептидный синтез к Роберт Брюс Меррифилд в 1977 г.[8] Как доказательство концепции ортогональное снятие защиты демонстрируется в фотохимический переэтерификация к триметилсилилдиазометан используя кинетический изотопный эффект:[9]
Благодаря этому эффекту квантовый выход для снятия защиты с правой сложноэфирной группы восстанавливается и остается нетронутой. Существенно, что при размещении атомов дейтерия рядом с левой сложноэфирной группой или при изменении длины волны до 254 нм получается другой моноарен.
Критика
Использование защитных групп повсеместно, но не без критики.[10] На практике их использование добавляет к синтезу две стадии (последовательность защиты-снятия защиты), одна или обе из которых могут значительно снизить химический выход. Важно отметить, что дополнительная сложность препятствует использованию полного синтетического синтеза в открытие лекарств. В отличие биомиметический синтез не использует защитные группы. В качестве альтернативы Баран представил новый синтез соединения гапалиндола U без защитных групп. Ранее опубликованный синтез[11][12][13] по словам Барана, содержал 20 шагов с множественными манипуляциями с защитными группами (подтверждено два):
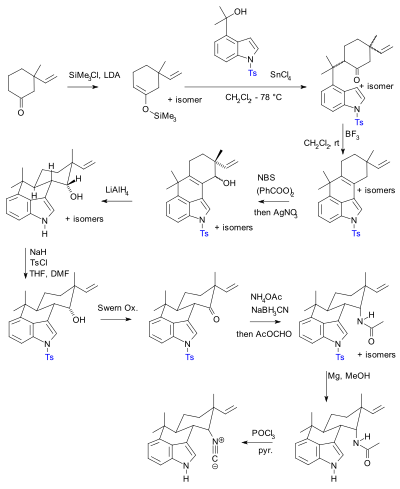 Синтез Хидеаки Муратаке 1990 года с использованием Тосыл защитные группы (показаны синим). | 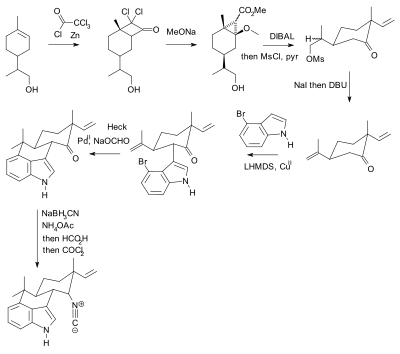 Фил Баран о синтезе без защитных групп, о котором сообщалось в 2007 году. |
Промышленное применение
Хотя использование защитных групп не является предпочтительным в промышленном синтезе, они все же используются в промышленных условиях, например:
- Осельтамивир (Тамифлю, противовирусный препарат) синтез Рош
- Сукралоза (подсластитель)
Рекомендации
- ^ Теодора В. Грин, Питер Г. М. Вутс (1999). Защитные группы в органическом синтезе (3-е изд.). Дж. Вили. ISBN 978-0-471-16019-9.CS1 maint: использует параметр авторов (связь)
- ^ Камая, Ясуши; Т. Хигучи (2006). «Метаболизм 3,4-диметоксициннамилового спирта и производных Coriolus versicolor». Письма о микробиологии FEMS. 24 (2–3): 225–229. Дои:10.1111 / j.1574-6968.1984.tb01309.x.
- ^ Мусса, Зиад; Д. Ромо (2006). «Мягкое снятие защиты с первичных N- (п-толуолсуфонил) амидов с помощью SmI2 после трифторацетилирования ». Synlett. 2006 (19): 3294–3298. Дои:10.1055 / с-2006-951530.
- ^ Romanski, J .; Новак, П .; Kosinski, K .; Юрчак, Дж. (Сентябрь 2012 г.). «Переэтерификация стерически затрудненных сложных эфиров под высоким давлением». Tetrahedron Lett. 53 (39): 5287–5289. Дои:10.1016 / j.tetlet.2012.07.094.
- ^ Клейден, Джонатан; Гривс, Ник; Уоррен, Стюарт; Уотерс, Питер (2000). Органическая химия. Oxford University Press. стр.1291. ISBN 978-0198503460.
- ^ Chan, Weng C .; Белый, Питер Д. (2004). Твердофазный синтез пептидов Fmoc. Oxford University Press. ISBN 978-0-19-963724-9.
- ^ Вен Чан, Питер Д. Уайт: Твердофазный синтез пептидов Fmoc, С. 10–12.
- ^ Merrifield, R. B .; Barany, G .; Cosand, W. L .; Энгельгард, М .; Мойсов, С. (1977). "Труды 5-го Американского симпозиума по пептидам". Биохимическое образование. 7 (4): 93–94. Дои:10.1016/0307-4412(79)90078-5.
- ^ Блан, Орельен; Боше, Кристиан Г. (2007). «Изотопные эффекты в фотохимии: приложение к хроматической ортогональности» (PDF). Орг. Lett. 9 (14): 2649–2651. Дои:10.1021 / ol070820h. PMID 17555322.
- ^ Baran, Phil S .; Маймон, Томас Дж .; Рихтер, Джереми М. (22 марта 2007 г.). «Полный синтез морских природных продуктов без использования защитных групп». Природа. 446 (7134): 404–408. Bibcode:2007Натура.446..404Б. Дои:10.1038 / природа05569. PMID 17377577.
- ^ Синтетические исследования морских алкалоидов гапалиндолов. Часть I Полный синтез (±) -апалиндолов J и M Тетраэдр, Том 46, Выпуск 18, 1990, Страницы 6331–6342 Хидэаки Муратакэ и Мицутака Нацумэ Дои:10.1016 / S0040-4020 (01) 96005-3
- ^ Синтетические исследования морских алкалоидов гапалиндолов. Часть 2. Восстановление алюмогидридным литием богатой электронами двойной связи углерод-углерод, сопряженной с ядром индола. Тетраэдр, Том 46, Выпуск 18, 1990, Страницы 6343–6350 Хидэаки Муратакэ и Мицутака Нацумэ Дои:10.1016 / S0040-4020 (01) 96006-5
- ^ Синтетические исследования морских алкалоидов гапалиндолов. Часть 3 Полный синтез (±) -апалиндолов H и U Тетраэдр, Том 46, Выпуск 18, 1990, Страницы 6351–6360 Хидэаки Муратакэ, Харуми Кумагами и Мицутака Нацумэ Дои:10.1016 / S0040-4020 (01) 96007-7
внешняя ссылка
- Введение защитной группы и механизма снятия защиты
- Заметки по этому предмету для старших курсов бакалавриата от профессора Риццо.
- Дальнейший набор учебных заметок в учебной форме с рекомендациями и комментариями от проф. Гроссман и Каммерс.
- Обзор профессора Коциенского.
- Пользовательский сайт, на котором приводится классический текст Грина и Ватса о стабильности нескольких ключевых групп из обширных таблиц этого справочника.
- Охраняющая группа из organic-reaction.com


