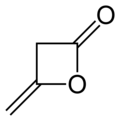
Дикетене - Diketene
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК 4-Метилиденоксетан-2-он | |||
| Другие имена γ-метиленпропиолактон | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ChemSpider | |||
| ECHA InfoCard | 100.010.562 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 2521 | ||
| |||
| |||
| Свойства | |||
| C4ЧАС4О2 | |||
| Молярная масса | 84.074 г · моль−1 | ||
| Плотность | 1,09 г см−3 | ||
| Температура плавления | -7 ° С (19 ° F, 266 К) | ||
| Точка кипения | 127 ° С (261 ° F, 400 К) | ||
| Вязкость | 0,88 мПа.с | ||
| Опасности | |||
| Пиктограммы GHS |     | ||
| Сигнальное слово GHS | Опасность | ||
| H226, H301, H302, H315, H318, H330, H331, H332, H335 | |||
| P210, P233, P240, P241, P242, P243, P260, P261, P264, P270, P271, P280, P284, P301 + 310, P301 + 312, P302 + 352, P303 + 361 + 353, P304 + 312, P304 + 340, P305 + 351 + 338, P310, P311, P312, P320, P321 | |||
| точка возгорания | 33 ° С (91 ° F, 306 К) | ||
| 275 | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Дикетене является органическое соединение с молекулярная формула C4ЧАС4О2, который иногда записывается как (CH2CO)2. Он образован димеризация из кетен, H2С = С = О. Дикетене является членом оксетан семья. Он используется как реагент в органическая химия.[1] Это бесцветная жидкость.
Производство
Кетен образуется путем дегидратации уксусной кислоты при 700–750 ° C в присутствии триэтилфосфат в качестве катализатора или путем термолиза ацетон в 600–700 ° С в присутствии сероуглерод как катализатор.[2]
Димеризация до дикетена протекает самопроизвольно при комнатной температуре:
- 2 ч2С = С = О → С4ЧАС4О2
Реакции
Нагревание или облучение УФ-светом[3] регенерирует кетеновый мономер:
- (C2ЧАС2O)2 ⇌ 2 канала2CO
Алкилированные кетены также легко димеризуются и образуют замещенные дикетены.
Дикетен легко гидролизуется в воде с образованием ацетоуксусная кислота. это период полураспада в воде примерно 45 мин. а 25 ° C при 2 <pH < 7.[4]
Определенные дикетены с двумя алифатические цепи, такие как димеры алкилкетена (AKD), используются в промышленности для улучшения гидрофобность в бумага.
Одно время уксусный ангидрид получали реакцией кетена с уксусной кислотой:[2]
- ЧАС2С = С = О + СН3COOH → (CH3CO)2O ΔЧАС = −63 кДж моль−1
Ацетоацетилирование
Дикетен также реагирует с спирты и амины к соответствующим производным ацетоуксусной кислоты. Иногда этот процесс называют ацетоацетилированием. Примером может служить реакция с 2-аминоиндан:[5]
Дикетен является важным промышленным промежуточным продуктом, используемым для производства ацетоацетатных эфиров и амидов, а также замещенных 1-фенил-3-метилпиразолонов. Последние используются при производстве красителей и пигментов.[6] Типичная реакция:
- ArNH2 + (CH2CO)2 → ArNHC (O) CH2C (O) CH3
Эти ацетоацетамиды являются предшественниками арилид желтый и диарилидные пигменты.[7]
Использовать
Дикетены с двумя алкильными цепями используются при производстве бумаги для калибровка бумаги, чтобы улучшить их печатные возможности ( гидрофобизация ). Помимо канифольных смол, на долю которых приходится около 60% мирового потребления, длинноцепочечные дикетены, называемые димерами алкилкетена (AKD), с долей 16% являются наиболее важными синтетическими размерами бумаги, они обычно используются в концентрациях 0,15%, что означает 1,5 кг твердого AKD /т бумага.
Приготовление AKD осуществляется путем хлорирования длинноцепочечных жирных кислот (таких как стеариновая кислота с использованием хлорирующих агентов, таких как тионилхлорид ) с получением соответствующих хлорангидридов и последующим отщеплением HCl аминами (например, триэтиламин ) в толуол или другие растворители:[8]
Кроме того, дикетены используются как промежуточные звенья в производстве фармацевтические препараты, инсектициды и красители. Например пиразолоны формируются из замещенных фенилгидразины, они использовались как анальгетики но сейчас они в значительной степени устарели. С участием метиламин дикетены реагируют на N,N '-диметилацетоацетамид который хлорирован сульфурилхлорид и отреагировал триметилфосфит к высокотоксичным инсектицидам монокротофос (особенно токсичен для пчел). Дикетены реагируют с замещенными ароматическими аминами с образованием ацетоацетанилиды, которые важны предшественники в основном желтый, оранжевый или красный азокрасители и азопигменты.
Примером синтеза арилидов реакцией дикетенов с ароматическими аминами является:
Сочетание ароматического диазония с арилидами с образованием азокрасителей, таких как Пигмент Желтый 74:
Промышленный синтез подсластителя ацесульфам-К основан на реакции дикетена с сульфаминовой кислотой и циклизации путем триоксид серы (ТАК3).[9]
Безопасность
Несмотря на высокую реакционную способность, как алкилирующий агент, и в отличие от аналогов β-лактонов пропиолактон и β-бутиролактон, дикетен неактивен как канцероген, возможно, из-за нестабильности его Аддукты ДНК.[10]
использованная литература
- ^ Beilstein Е III / IV 17: 4297.
- ^ а б Арпе, Ханс-Юрген (2007), Industrielle Organische Chemie: Bedeutende vor- und Zwischenprodukte (на немецком языке) (6-е изд.), Weinheim: Вайли-ВЧ, стр. 200–1, ISBN 3-527-31540-3
- ^ Сусана Бреда; Игорь Рева; Руи Фаусто (2012). "УФ-индуцированная мономолекулярная фотохимия дикетена, выделенного в криогенных инертных матрицах". J. Phys. Chem. А. 116 (9): 2131–2140. Дои:10.1021 / jp211249k.
- ^ Рафаэль Гомес-Бомбарелли; Марина Гонсалес-Перес; Мария Тереза Перес-Приор; Хосе А. Мансо; Эмилио Калле; Хулио Касадо (2008). "Кинетическое исследование нейтрального и основного гидролиза дикетена". J. Phys. Орг. Chem. 22 (5): 438–442. Дои:10.1002 / poc.1483.
- ^ Киран Кумар Солингапурам Сай; Томас М. Гилберт; Дуглас А. Клумпп (2007). "Циклизации Кнорра и дистонические суперэлектрофилы". J. Org. Chem. 72 (25): 9761–9764. Дои:10.1021 / jo7013092. PMID 17999519.
- ^ Словарь промышленных химикатов Эшфорда, третье издание, 2011 г., стр. 3241-2.
- ^ Голод, К .; Хербст, В. (2012). «Пигменты органические». Энциклопедия промышленной химии Ульмана. Вайнхайм: Вайли-ВЧ. Дои:10.1002 / 14356007.a20_371.
- ^ Вольф С. Шульц: Проклеивающие агенты в тонкой бумаге[постоянная мертвая ссылка ] Abgerufen am 1. März 2012.
- ^ EP 0218076 Способ получения нетоксичных солей 6-метил-3,4-дигидро-1,2,3-оксатиазин-4-он-2,2-диоксида.
- ^ Рафаэль Гомес-Бомбарелли; Марина Гонсалес-Перес; Мария Тереза Перес-Приор; Хосе А. Мансо; Эмилио Калле; Хулио Касадо (2008). «Химическая реакционная способность и биологическая активность дикетена». Chem. Res. Toxicol. 21 (10): 1964–1969. Дои:10.1021 / tx800153j. PMID 18759502.


![{displaystyle {egin {array} {lclrr} {ce {CH3CO2H}} & {ce {-> [{overset {ext {triethyl phosphate}} {ce {(CH3CH2O) 3PO}}}] [{ext {700– 750 ° C}}]}} & {ce {{underset {ketene} {H2C = C = O}} + H2O}} && Delta H = + 147 {ext {kJ mol}} ^ {- 1} {} {ce {CH3COCH3}} & {ce {-> [{overset {ext {сероуглерод}} {ce {CS2}}}] [{ext {600–700 ° C}}]}} и {ce {{H2C = C = O} + CH4}} {} конец {массив}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5e895574e8077850caecc78d024f20ebd56c1e1e)



