Перестановка фри - Fries rearrangement
| Перестановка фри | |
|---|---|
| Названный в честь | Карл Теофил Фрис |
| Тип реакции | Реакция перестановки |
| Идентификаторы | |
| Портал органической химии | фри-перестановка |
| RSC ID онтологии | RXNO: 0000444 |
В Перестановка фри, названный в честь немецкого химика Карл Теофил Фрис, это реакция перегруппировки фенольного эфира до гидрокси арил кетон от катализ из Кислоты Льюиса.[1][2][3][4]
Это предполагает миграцию ацил группа фенол сложный эфир арил кольцо. Реакция орто и пара селективный и один из двух продуктов может быть улучшен путем изменения условий реакции, таких как температура и растворитель.
Механизм
Несмотря на многие усилия, окончательный механизм реакции для перестановки Фриса не определено. Доказательства меж- и внутримолекулярный механизмы были получены кроссоверные эксперименты со смешанными реактивами. Прогресс реакции не зависит от растворитель или субстрат. Широко принятый механизм включает карбокатион промежуточный.

На первом этапе реакции a Кислота Льюиса например хлорид алюминия AlCl
3 координирует карбонил атом кислорода ацил группа. Этот атом кислорода больше электрон богатый, чем фенольный атом кислорода и является предпочтительным База Льюиса. Это взаимодействие поляризует то связь между ацильным остатком и фенольным атомом кислорода, а группа хлорида алюминия перегруппировывается в фенольный атом кислорода. Это создает бесплатный ацилий карбокатион который реагирует на классический электрофильное ароматическое замещение с ароматическим кольцом. Отведенный протон выпускается как соляная кислота где хлор получают из хлорида алюминия. Ориентация реакции замещения зависит от температуры. Низкая температура реакции способствует паразамена а при высоких температурах орто продукт преобладает, это можно рационализировать как демонстрацию классических Сравнение термодинамического и кинетического контроля реакции поскольку орто-продукт может образовывать более стабильный бидентатный комплекс с алюминием.[5] Образование орто-продукта также благоприятно для неполярных растворителей; по мере увеличения полярности растворителя доля пара-продукта также увеличивается.[6]
Объем
Фенолы реагировать на форму сложные эфиры вместо гидроксиарилкетонов при взаимодействии с ацилгалогениды под Ацилирование Фриделя-Крафтса условия. Следовательно, эта реакция имеет промышленное значение для синтеза гидроксиарилкетонов, которые являются важными промежуточными продуктами для некоторых фармацевтических препаратов. Как альтернатива хлорид алюминия, Другой Кислоты Льюиса такие как трифторид бора и висмут тройной или сильные протонные кислоты, такие как фтороводород и метансульфоновая кислота также можно использовать. Во избежание использования этих агрессивных и экологически вредных катализаторы все исследования альтернативных неоднородный катализаторы активно разрабатываются.
Пределы
Только во всех случаях сложные эфиры может использоваться со стабильными ацильными компонентами, которые могут выдерживать жесткие условия перегруппировки Фриса. Если ароматический или ацильный компонент сильно замещен, то химический выход упадет из-за стерический ограничения. Деактивация мета-направляющих групп в бензольной группе также будет иметь неблагоприятный эффект, как и следовало ожидать для Ацилирование Фриделя – Крафтса.
Перестановка фото-фри
В дополнение к обычной реакции термического фенилового эфира a фотохимический возможен вариант. В фото-фри перестановка аналогично может давать [1,3] и [1,5] произведения.[7][8] это включает радикальный механизм реакции. Эта реакция также возможна при отключении заместители по ароматической группе. Поскольку выходы низкие, эта процедура не используется в коммерческом производстве. Однако перегруппировка фото-фри может происходить естественным образом, например, когда пластиковый предмет, сделанный из ароматических поликарбонат, полиэстер или полиуретан, подвергается воздействию солнца (алифатические карбонилы подвергаются Норриш реакции, которые в чем-то похожи). В этом случае фотолиз сложноэфирных групп приведет к выщелачиванию фталата из пластика.[9]
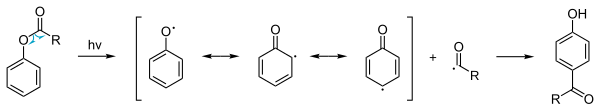
Анионная перегруппировка фри
В анионной перегруппировке Фриса орто-металлирование ариловых эфиров, карбаматы а карбонаты с сильным основанием приводят к перегруппировке с образованием орто-карбонильных соединений.[10]
Смотрите также
- Алкилирование Фриделя – Крафтса -подобные реакции:
- Дафф реакция
использованная литература
- ^ Фрис, К.; Финк, Г. (1908). "Uber Homologe des Cumaranons und ihre Abkömmlinge". Chemische Berichte. 41 (3): 4271–4284. Дои:10.1002 / cber.190804103146.
- ^ Фри, К .; Пфаффендорф, В. (1910). "Über ein Kondensationprodukt des Cumaranons und seine Umwandlung in Oxindirubin". Chemische Berichte. 43 (1): 212–219. Дои:10.1002 / cber.19100430131.
- ^ Марч, Дж. Продвинутая органическая химия, 3-е изд .; Джон Уайли и сыновья: Чичестер, 1985; С. 499ff.
- ^ Блатт, А. Орг. Реагировать. 1942, 1.
- ^ Сейнсбери, Малкольм (1992). Ароматическая химия (Oxford Chemistry Primers). Издательство Оксфордского университета. п. 65. ISBN 0198556748.
- ^ Курти, Ласло; Чако, Барбара (2005). Стратегические применения названных реакций в органическом синтезе: история вопроса и подробные механизмы. Elsevier Academic Press. п. 181. ISBN 0123694833.
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "фото-фри перестановка ". Дои:10.1351 / goldbook.P04614
- ^ Беллуш, Даниэль (5 января 2007 г.). «Фото-Фрай перегруппировка и родственные фотохимические [1, j] -двиги (j = 3, 5, 7) карбонильных и сульфонильных групп». Успехи фотохимии. 8: 109–159. Дои:10.1002 / 9780470133385.ch3. ISBN 9780470133385.
- ^ Сирл, Норма Д. (7 ноября 2004 г.). «Воздействие окружающей среды на полимерные материалы». Пластмассы и окружающая среда. 8: 311–358. Дои:10.1002 / 0471721557.ch8. ISBN 9780471721550.
- ^ Корб, Маркус; Ланг, Генрих (2019). «Анионная перегруппировка Фриса: удобный путь к орто-функционализированным ароматическим соединениям». Обзоры химического общества. 48 (10): 2829–2882. Дои:10.1039 / C8CS00830B. PMID 31066387.
