Ацилгалогенид - Acyl halide
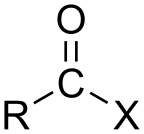
An ацилгалогенид (также известный как галогенид кислоты) это химическое соединение полученный из оксокислота[1] заменив гидроксил группа с галогенид группа.[2]
Если кислота карбоновая кислота, соединение содержит –COX функциональная группа, который состоит из карбонил группа, единолично связанная с галоген атом. Общую формулу такого ацилгалогенида можно записать RCOX, где R может быть, например, алкил группа, CO представляет собой карбонильную группу, и X представляет собой галогенид, такой как хлористый. Ацилхлориды являются наиболее часто встречающимися ацилгалогенидами, но ацетил иодид это тот, который производится (временно) в самых крупных масштабах. Миллиарды килограммов ежегодно генерируются при производстве уксусная кислота.[3]
Гидроксильная группа сульфоновая кислота также может быть заменен галогеном для получения соответствующего сульфонилгалогенида. На практике это почти всегда хлорид, обеспечивающий сульфонилхлорид.
Подготовка
Алифатические ацилгалогениды
В промышленных масштабах реакция уксусный ангидрид с участием хлористый водород производит смесь ацетилхлорида и уксусной кислоты:[4]
- (CH3CO)2O + HCl → CH3COCl + CH3CO2ЧАС
Ключевой промышленный путь к пропионовый ангидрид включает термическое обезвоживание:
- 2 канала3CH2CO2H → (CH3CH2CO)2O + H2О
Другой маршрут - это Реппе карбонилирование из этилен с пропионовой кислотой и карбонил никеля в качестве катализатора:[5]
- CH2= CH2 + CH3CH2CO2H + CO → (CH3CH2CO)2О
Обычные синтезы ацилхлоридов также включают реакцию карбоновые кислоты с участием фосген, тионилхлорид,[6] и трихлорид фосфора[7] Пентабромид фосфора используется для ацилбромидов, которые редко представляют ценность.
Ароматические ацилхлориды
Бензоилхлорид получают из бензотрихлорид с использованием воды или бензойной кислоты:[8]
- C6ЧАС5CCl3 + H2О → С6ЧАС5COCl + 2 HCl
- C6ЧАС5CCl3 + C6ЧАС5CO2H → 2 С6ЧАС5COCl + HCl
Как и в случае с другими ацилхлориды, он может быть получен из исходной кислоты и других хлорирующих агентов. пентахлорид фосфора или тионилхлорид.
Репрезентативные лабораторные маршруты к ароматный ацилгалогениды сравнимы с алифатическими ацилгалогенидами.[9] Например, хлороформилирование, конкретный тип Ацилирование Фриделя-Крафтса который использует формальдегид как реагент[нужна цитата ], или прямое хлорирование из бензальдегид производные.[10]
Ацилфториды
Коммерческий интерес, ацилхлориды реагировать с HF, чтобы дать ацил фториды.[11] Ароматические (а также алифатические) ацилфториды удобно получать непосредственно из карбоновых кислот с использованием стабильных недорогих химических продуктов: PPh3, NBS и Et3N-3HF в настольном протоколе.[12] Циануровый фторид превращает карбоновые кислоты в ацилфториды.
Реакции
Ацилгалогениды представляют собой довольно реакционноспособные соединения, которые часто синтезируют для использования в качестве промежуточных продуктов при синтезе других органических соединений. Например, ацилгалогенид может реагировать с участием:
- воды, чтобы сформировать карбоновая кислота. Этот гидролиз является наиболее часто используемой реакцией ацилгалогенидов, поскольку он происходит в промышленном синтезе уксусная кислота.
- ан алкоголь сформировать сложный эфир
- ан ароматическое соединение, с помощью Кислота Льюиса катализатор, такой как AlCl3, чтобы сформировать ароматический кетон.[7] Увидеть Ацилирование Фриделя-Крафтса.
- карбоновые кислоты с образованием ангидриды органических кислот.[13]
В указанных выше реакциях HX (галогенид водорода или галогеноводородная кислота). Например, если ацилгалогенид представляет собой ацилхлорид, HCl (хлористый водород или соляная кислота ) тоже образуется.
Множественные функциональные группы

Молекула может иметь более одной ацилгалогенидной функциональной группы. Например, «адипоил дихлорид», обычно называемый просто адипоилхлорид, имеет два ацилхлорида функциональные группы; см. структуру справа. Это дихлорид (т.е. двойной хлорид) 6-углеродной дикарбоновой кислоты. адипиновая кислота. Важным применением адипоилхлорида является полимеризация с органическим диамино-соединением с образованием полиамида, называемого нейлон или полимеризация с некоторыми другими органическими соединениями с образованием полиэфиры.
Фосген (карбонилдихлорид, Cl – CO – Cl) - очень токсичный газ, являющийся дихлоридом угольная кислота (HO – CO – OH). Оба хлоридных радикала в фосгене могут вступать в реакции, аналогичные предыдущим реакциям ацилгалогенидов. Фосген используется в качестве реагента при производстве поликарбонат полимеры, среди прочего промышленного применения.
Общие опасности
Летучие ацилгалогениды слезотечение потому что они могут вступать в реакцию с водой на поверхности глаза с образованием галогеноводородных и органических кислот, раздражающих глаза. Подобные проблемы могут возникнуть при вдыхании паров ацилгалогенидов. Как правило, ацилгалогениды (даже нелетучие соединения, такие как тозилхлорид ) находятся раздражители к глазам, коже и слизистые оболочки.
использованная литература
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "ацильные группы ". Дои:10.1351 / goldbook.A00123
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "ацилгалогениды ". Дои:10.1351 / goldbook.A00124
- ^ Осия Чунг, Робин С. Танке, Дж. Пол Торренс «Уксусная кислота» в Энциклопедии промышленной химии Ульмана 2002, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a01_045
- ^ Чунг, Осия; Танке, Робин С .; Торренс, Дж. Пол (2000). "Уксусная кислота". Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a01_045.
- ^ Самель, Ульф-Райнер; Колер, Вальтер; Геймер Армин Отто; Кеузер, Ульрих (2005). «Пропионовая кислота и производные». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a22_223.
- ^ Helferich, B .; Шефер, В. (1929). «н-бутирл хлорид». Органический синтез. 9: 32. Дои:10.15227 / orgsyn.009.0032.
- ^ а б Allen, C.F.H .; Баркер, У. Э. (1932). «Дезоксибензоин». Органический синтез. 12: 16. Дои:10.15227 / orgsyn.012.0016.
- ^ Маки, Такао; Такеда, Кадзуо (2000). «Бензойная кислота и производные». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a03_555.
- ^ Адамс, Роджер (1923). «п-Нитробензоилхлорид». Органический синтез. 3: 75. Дои:10.15227 / orgsyn.003.0075.
- ^ Clarke, H.T .; Тейлор, Э. Р. (1929). «о-Хлорбензоилхлорид». Органический синтез. 9: 34. Дои:10.15227 / orgsyn.009.0034.
- ^ Олах Г., Кун С. (1961). «Получение ацилфторидов с безводным фтористым водородом. Общее использование метода Колсона и Фреденхагена». J. Org. Chem. 26: 237–238. Дои:10.1021 / jo01060a600.
- ^ Munoz, Socrates B .; Данг, Хуонг; Испизуа-Родригес, Ксанат; Мэтью, Томас; Пракаш, Г. К. Сурья (2019-03-15). «Прямой доступ к ацилфторидам из карбоновых кислот с использованием системы реагентов для дезоксифторирования фосфина / фторида». Органические буквы. 21 (6): 1659–1663. Дои:10.1021 / acs.orglett.9b00197. ISSN 1523-7060.
- ^ Allen, C.F.H .; Kibler, C.J .; McLachlin, D.M .; Уилсон, К. В. (1946). «Ангидриды кислот». Органический синтез. 26: 1. Дои:10.15227 / orgsyn.026.0001.



