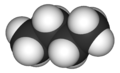
Бутан - Butane
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Бутан[3] | |||
| Систематическое название ИЮПАК Тетракарбан (никогда не рекомендуется[3]) | |||
| Другие имена | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 969129 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.136 | ||
| Номер ЕС |
| ||
| Номер E | E943a (глазурь, ...) | ||
| 1148 | |||
| КЕГГ | |||
| MeSH | бутан | ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1011 | ||
| |||
| |||
| Характеристики | |||
| C4ЧАС10 | |||
| Молярная масса | 58.124 г · моль−1 | ||
| Внешность | Бесцветный газ | ||
| Запах | Как бензин или природный газ[1] | ||
| Плотность | 2,48 кг / м3 (при 15 ° C (59 ° F)) | ||
| Температура плавления | От -140 до -134 ° С; От -220 до -209 ° F; 133–139 К | ||
| Точка кипения | От -1 до 1 ° С; От 30 до 34 ° F; От 272 до 274 К | ||
| 61 мг л−1 (при 20 ° C (68 ° F)) | |||
| бревно п | 2.745 | ||
| Давление газа | ~ 170 кПа при 283 К [4] | ||
Закон Генри постоянный (kЧАС) | 11 нмоль Па−1 кг−1 | ||
| Конъюгированная кислота | Бутан | ||
| -57.4·10−6 см3/ моль | |||
| Термохимия | |||
Теплоемкость (C) | 98,49 Дж К−1 моль−1 | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | −126,3–−124,9 кДж моль−1 | ||
Станд. Энтальпия горение (ΔcЧАС⦵298) | −2,8781–−2,8769 МДж моль−1 | ||
| Опасности[5] | |||
| Паспорт безопасности | Видеть: страница данных | ||
| Пиктограммы GHS |  | ||
| Сигнальное слово GHS | Опасность | ||
| H220 | |||
| P210 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | -60 ° С (-76 ° F, 213 К) | ||
| 405 ° С (761 ° F, 678 К) | |||
| Пределы взрываемости | 1.8–8.4% | ||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | никто[1] | ||
REL (Рекомендуемые) | TWA 800 частей на миллион (1900 мг / м3)[1] | ||
IDLH (Непосредственная опасность) | 1600 частей на миллион[1] | ||
| Родственные соединения | |||
Родственные алканы | |||
Родственные соединения | Перфторбутан | ||
| Страница дополнительных данных | |||
| Показатель преломления (п), Диэлектрическая постоянная (εр), так далее. | |||
Термодинамический данные | Фазовое поведение твердое тело – жидкость – газ | ||
| УФ, ИК, ЯМР, РС | |||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Бутан (/ˈбjuːтeɪп/) или же п-бутан является алкан с формулой C4ЧАС10. Бутан - это газ при комнатной температуре и атмосферном давлении. Бутан легко воспламеняется, бесцветен, легко сжиженный газ который быстро испаряется при комнатной температуре. Название бутан происходит от корней но- (из Масляная кислота, названный в честь греческого слова, обозначающего масло) и -ан. Это было обнаружено химиком Эдвард Франкленд в 1849 г.[6] Он был обнаружен растворенным в сырой нефти в 1864 году. Эдмунд Рональдс, который первым описал его свойства.[7][8]
Изомеры
| Распространенное имя | нормальный бутан неразветвленный бутан п-бутан | изобутан я-бутан |
| Название ИЮПАК | бутан | 2-метилпропан |
| Молекулярный диаграмма | 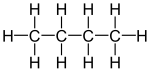 | 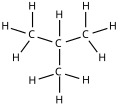 |
| Скелетный диаграмма |  |
Вращение о центральном C − C связь производит два разных конформации (транс и бестактный) за п-бутан.[9]
Реакции

Когда кислорода много, бутан горит с образованием углекислый газ и водяной пар; когда кислород ограничен, углерод (сажа ) или монооксид углерода. Бутан плотнее воздуха.
Когда кислорода достаточно:
- 2 С4ЧАС10 + 13 O2 → 8 СО2 + 10 часов2О
Когда кислород ограничен:
- 2 С4ЧАС10 + 9 O2 → 8 СО + 10 ч2О
Максимум адиабатическое пламя температура бутана с воздуха составляет 2243 К (1970 ° C; 3578 ° F).
п-Бутан - сырье для DuPont каталитический процесс приготовления малеиновый ангидрид:
- 2 канала3CH2CH2CH3 + 7 O2 → 2 С2ЧАС2(CO)2O + 8 H2О
п-Бутан, как и все углеводороды, подвергается свободный радикал хлорирование дает как 1-хлор-, так и 2-хлорбутаны, а также более сильно хлорированные производные. Относительные скорости хлорирования частично объясняются разными энергии диссоциации связи, 425 и 411 кДж / моль для двух типов связей C-H.
Использует
Обычный бутан можно использовать для бензин смешивание в качестве топливного газа растворителя для экстракции ароматизаторов, отдельно или в смеси с пропан, и как сырье для производства этилен и бутадиен, ключевой ингредиент синтетическая резина. Изобутан в основном используется нефтеперерабатывающие заводы для усиления (увеличения) октан количество автомобильного бензина.[10][11][12][13]
При смешивании с пропан и других углеводородов, он может называться коммерчески СУГ, для сжиженного углеводородного газа. Используется как компонент бензина, как сырье для производства базовых нефтехимия в паровой крекинг, как топливо для сигарет зажигалки и как пропеллент в аэрозоли Такие как дезодоранты.[14]
Очень чистые формы бутана, особенно изобутана, могут использоваться в качестве хладагенты и в значительной степени заменили разрушающий озоновый слой галометаны, например, в бытовых холодильниках и морозильниках. Рабочее давление системы для бутана ниже, чем для галометанов, таких как R-12 Таким образом, системы с R-12, такие как автомобильные системы кондиционирования воздуха, при преобразовании в чистый бутан не будут работать оптимально, и поэтому используется смесь изобутана и пропана для обеспечения производительности системы охлаждения, сравнимой с R-12.
Бутан также используется как более легкий топливо для обычной зажигалки или бутановая горелка и продается в бутылках в качестве топлива для приготовления пищи, барбекю и походных печей. На мировом рынке канистр с бутаном доминируют южнокорейский производители.[15]
В качестве топлива его часто смешивают с небольшими количествами сероводород и меркаптаны что придаст несгоревшему газу неприятный запах, который легко уловить человеческим носом. Таким образом можно легко определить утечку бутана. Хотя сероводород и меркаптаны токсичны, они присутствуют в таких низких количествах, что опасность удушья и возгорания бутаном становится проблемой задолго до токсичности.[нужна цитата ] Наиболее коммерчески доступный бутан также содержит определенное количество загрязняющего масла, которое можно удалить путем фильтрации, но которое в противном случае оставит отложение в точке воспламенения и может в конечном итоге заблокировать равномерный поток газа.[16] Загрязняющие вещества не используются при экстракции ароматизаторов.[уточнить ] и бутановые газы могут вызвать взрыв газа в плохо вентилируемых помещениях, если утечки остаются незамеченными и воспламеняются от искры или пламени.[нужна цитата ]
 |  |  |  |
| Канистры бутанового топлива для использования в походных печах. | Бутановая зажигалка с резервуаром для жидкого бутана | Аэрозольный баллончик, в котором в качестве пропеллента может использоваться бутан. | Баллон с бутаном, используемый для приготовления пищи |
Последствия и проблемы со здоровьем
Вдыхание бутана может вызвать: эйфория, сонливость, бессознательное состояние, асфиксия, аритмия сердца, колебания артериального давления и временная потеря памяти при злоупотреблении непосредственно из контейнера под высоким давлением и могут привести к смерти от удушье и мерцание желудочков. Он попадает в кровоток и в течение нескольких секунд вызывает интоксикацию.[17] Бутан является наиболее распространенным летучим веществом в Великобритании и стал причиной 52% смертей, связанных с растворителями, в 2000 году.[18] Распыляя бутан непосредственно в горло, струя жидкости может быстро охладиться до -20 ° C (-4 ° F) за счет расширения, вызывая длительное ларингоспазм.[19] "Внезапная смерть сниффера синдром, впервые описанный Бассом в 1970 г.,[20] является наиболее частой причиной смерти, связанной с растворителями, вызывая 55% известных смертельных случаев.[19]
Смотрите также
- Изобутан
- Циклобутан
- Диметиловый эфир
- Злоупотребление летучими веществами
- Бутан (страница данных)
- Бутанон
- п-Бутанол
- Сжиженный газ
- Промышленный газ
- Бутановая горелка
- Взрывы газа
Рекомендации
- ^ а б c d е Карманный справочник NIOSH по химической опасности. "#0068". Национальный институт охраны труда и здоровья (NIOSH).
- ^ Хофманн, Август Вильгельм Фон (1 января 1867 г.). «I. О действии трихлорида фосфора на соли ароматических монаминов». Труды Лондонского королевского общества. 15: 54–62. Дои:10.1098 / rspl.1866.0018. S2CID 98496840.
- ^ а б «Переднее дело». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 4. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
Точно так же сохраненные названия «этан», «пропан» и «бутан» никогда не заменялись систематическими названиями «дикарбан», «трикарбан» и «тетракарбан», как рекомендовалось для аналогов силана, «дисилан»; фосфан, «трифосфан»; и сульфан, «тетрасульфан».
- ^ В. Б. Кей (1940). "Соотношение давление-объем-температура для н-бутана". Промышленная и инженерная химия. 32 (3): 358–360. Дои:10.1021 / ie50363a016.
- ^ «Паспорт безопасности, название материала: н-бутан» (PDF). США: Matheson Tri-Gas Incorporated. 5 февраля 2011. Архивировано с оригинал (PDF) 1 октября 2011 г.. Получено 11 декабря 2011.
- ^ "Ок бумаги" (PDF). www.chem.qmul.ac.uk.
- ^ Уоттс, Х. (1868). Словарь по химии. 4. п. 385.
- ^ Maybery, C.F. (1896 г.). «О составе серных нефтей Огайо и Канады». Труды Американской академии искусств и наук. 31: 1–66. Дои:10.2307/20020618. JSTOR 20020618.
- ^ Роман Михайлович Балабин (2009). "Разница в энтальпии между конформациями нормальных алканов: исследование методом рамановской спектроскопии п-Пентан и п-Бутан". J. Phys. Chem. А. 113 (6): 1012–9. Дои:10.1021 / jp809639s. PMID 19152252.
- ^ MarkWest Energy Partners, L.P. Форма 10-K. Sec.gov
- ^ Copano Energy, L.L.C. Форма 10-К. Sec.gov. Проверено 12 декабря 2012.
- ^ Targa Resources Partners LP Form10-k. Sec.gov. Проверено 12 декабря 2012.
- ^ Crosstex Energy, L.P. FORM 10-K. Sec.gov
- ^ Праймер по смешиванию бензина. Информационный меморандум EPRINC
- ^ «Предприниматель преодолел тяготы китайской тюрьмы». houstonchronicle.com. 21 июня 2016 г.. Получено 20 сентября 2018.
- ^ "BHO Mystery Oil". Сканк Фарм Исследования. 2013-08-26. Получено 2019-12-05.
- ^ «Нейротоксические эффекты от бутанового газа». thcfarmer.com. 19 декабря 2009 г.. Получено 3 октября 2016.
- ^ Филд-Смит М., Бланд Дж. М., Тейлор Дж. С. и др. "Тенденции смертности, связанной со злоупотреблением летучими веществами, 1971–2004 гг." (PDF). Департамент наук об общественном здоровье. Лондон: Медицинская школа Святого Георгия. Архивировано из оригинал (PDF) 27 марта 2007 г.
- ^ а б Рэмси Дж., Андерсон Х.Р., Блур К. и др. (1989). «Введение в практику, распространенность и химическую токсикологию злоупотребления летучими веществами». Hum Toxicol. 8 (4): 261–269. Дои:10.1177/096032718900800403. PMID 2777265. S2CID 19617950.
- ^ Басс М. (1970). «Внезапная нюхательная смерть». JAMA. 212 (12): 2075–2079. Дои:10.1001 / jama.1970.03170250031004. PMID 5467774.