Пирамидальный алкен - Pyramidal alkene
Пирамидальные алкены находятся алкены в котором два углерод атомы составляя двойная связь не копланарный с их четырьмя заместители. Эта деформация от тригонально плоский геометрия в тетраэдрическая молекулярная геометрия это результат угловая деформация индуцируется в молекуле из-за геометрических ограничений. Пирамидальные алкены существуют только в лабораторных условиях, но представляют интерес, поскольку из них можно многое узнать о природе химическая связь.[1]
В циклогептен (1.1) СНГ изомер представляет собой обычную ненапряженную молекулу, но гептановое кольцо слишком мало для размещения транс-конфигурированная алкеновая группа, приводящая к деформации и скручиванию двойной связи. Несоосность р-орбиты сводится к минимуму пирамидизация. В связанных молекулы анти-Бредта. преобладает не пиримидизация, а скручивание.
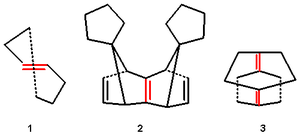 Рисунок 1. Пирамидальные алкены
Рисунок 1. Пирамидальные алкены
Пирамидализированные клеточные алкены также существуют там, где преобладает симметричный изгиб заместителей без несоосности р-орбиталей.
 Фигура 2. Определения углов
Фигура 2. Определения углов
В угол пирамидализации φ (б) определяется как угол между плоскостью, определяемой одним из атомов углерода с двойной связью и двумя его заместителями, и протяженностью двойной связи, и рассчитывается как:
в угол изгиба бабочки или же угол складывания ψ (c) определяется как угол между двумя плоскостями и может быть получен путем усреднения двух крутильные углы р1C = CR3 и R2C = CR4.
В алкенах 1.2 и 1.3 эти углы определяются с помощью Рентгеновская кристаллография соответственно 32,4 ° / 22,7 ° и 27,3 ° / 35,6 °. Хотя эти алкены стабильны, они очень реакционноспособны по сравнению с обычными алкенами. Они склонны к димеризации до циклобутадиен соединений или реагируют с кислородом с образованием эпоксиды.
Соединение тетрадегидродиантрацен, также с углом пирамидализации 35 °, синтезируется в фотохимический циклоприсоединение из бромантрацен с последующим устранение из бромистый водород.
 Рисунок 3. Синтез тетрадегидродиантрацена
Рисунок 3. Синтез тетрадегидродиантрацена
Это соединение очень реактивно в Реакции Дильса – Альдера из-за космические взаимодействия между двумя алкеновыми группами. Эта повышенная реактивность, в свою очередь, позволила синтезировать первый в мире Мебиус аромат.
В одном исследовании[2] напряженный алкен 4.4 был синтезирован с самыми высокими углами пирамидализации, 33,5 ° и 34,3 °. Это соединение является двойным Дильс – Альдер аддукт дийодоциклофан 4.1 и антрацен 4.3 по реакции в присутствии трет-бутоксид калия в рефлюкс дибутиловый эфир через диАрина средний 4.2. Это стабильное соединение, но оно медленно реагирует с кислородом с образованием эпоксид когда оставил стоять как хлороформ решение.
 Рисунок 4. Циклофан-антраценовый аддукт
Рисунок 4. Циклофан-антраценовый аддукт
В одном исследовании[3] выделение пирамидного алкена невозможно даже с помощью матричная изоляция при очень низких температурах, если не стабилизируется координация металла:
 Рисунок 5. (Ph3П)2Pt-комплекс 3,7-диметилтрицикло [3.3.0.03,7] окт-1 (5) -ен
Рисунок 5. (Ph3П)2Pt-комплекс 3,7-диметилтрицикло [3.3.0.03,7] окт-1 (5) -ен
Реакция дийодид 5.1 на рисунке 5 с амальгама натрия в присутствии этиленбис (трифенилфосфин) платина (0) не дает промежуточного алкен 5.2 но платина стабилизировалась 5.3. Сигма-связь в этом соединении разрушается при реакции с этиловый спирт.
Рекомендации
- ^ Васкес, Сантьяго; Лагеря, Пелайо (2005). «Химия пирамидализированных алкенов». Тетраэдр. 61 (22): 5147–5208. Дои:10.1016 / j.tet.2005.03.055.
- ^ Dolbier, W. R., Jr; Zhai, Y.-A .; Battiste, M.A .; Abboud, K. A .; Гивирига, И. (2005). "Высокопирамидализированный клеточный алкен, образованный двойным циклоприсоединением Дильса-Альдера син-4,5,13,14-бис (дегидро) октафторпарациклофан до антрацена ». J. Org. Chem. 70 (25): 10336–10341. Дои:10.1021 / jo051488v.
- ^ Феофан, Фаница А .; Tasiopoulos, Anastasios J .; Николаид, Афанасий; Чжоу, Синь; Джонсон, Уильям Т. Дж .; Борден, Уэстон Тэтчер (2006). "Свидетельства образования (Ph3П)2Pt Комплекс 3,7-Диметилтрицикло [3.3.0.03,7] oct-1 (5) -ен, алкен с наиболее высокой пирамидизацией в гомологичном ряду. Выделение и рентгеноструктура продукта добавления этанола в комплекс ». Орг. Lett. 8 (14): 3001–3004. Дои:10.1021 / ol060994j.






