Реакция Гаттермана - Gattermann reaction
| Формилирование Гаттермана | |
|---|---|
| Названный в честь | Людвиг Гаттерманн |
| Тип реакции | Реакция замещения |
| Идентификаторы | |
| RSC ID онтологии | RXNO: 0000139 |
В Реакция Гаттермана, (также известный как Формилирование Гаттермана и Синтез салицилальдегида Гаттерманна) представляет собой химическую реакцию, в которой ароматические соединения формилированный смесью цианистый водород (HCN) и хлористый водород (HCl) в присутствии Кислота Льюиса катализатор Такие как AlCl3. Назван в честь немецкого химика. Людвиг Гаттерманн[1] и похож на Реакция Фриделя – Крафтса.
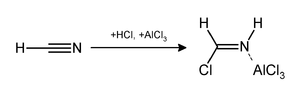

Реакцию можно упростить, заменив HCN / AlCl3 сочетание с цианид цинка.[2] Хотя он также очень токсичен, Zn (CN)2 является твердым веществом, поэтому работать с ним безопаснее, чем с газообразным HCN.[3] Zn (CN)2 реагирует с HCl с образованием основного реагента HCN и Zn (CN)2 который служит катализатором кислоты Льюиса на месте. Пример Zn (CN)2 метод - синтез мезитальдегид из мезитилен.[4]
Реакция Гаттермана – Коха
| Формилирование Гаттермана – Коха | |
|---|---|
| Названный в честь | Людвиг Гаттерманн Юлиус Арнольд Кох |
| Тип реакции | Реакция замещения |
В Реакция Гаттермана – Коха, названный в честь немецких химиков Людвига Гаттермана и Юлиус Арнольд Кох,[5] является вариантом реакции Гаттермана, в которой монооксид углерода (CO) используется вместо цианистого водорода.[6]

В отличие от реакции Гаттермана, эта реакция не применима к фенол и фенол эфир субстраты.[3] Хотя крайне нестабильный формилхлорид изначально предполагался как промежуточное соединение, формил-катион (т.е. протонированный монооксид углерода), [HCO]+, теперь считается, что он непосредственно реагирует с ареном без начального образования формилхлорида.[7] Кроме того, когда хлорид цинка используется в качестве кислоты Льюиса вместо, например, хлорида алюминия, или когда монооксид углерода не используется при высоком давлении, наличие следов хлорид меди (I) или хлорид никеля (II) сокатализатор часто необходим. Сокатализатор на основе переходного металла может выступать в качестве «носителя», сначала вступая в реакцию с CO с образованием карбонильного комплекса, который затем превращается в активного электрофила.[8]
Смотрите также
Рекомендации
- ^ Gattermann, L .; Берхельманн, В. (1898). «Синтезированный ароматический оксальдегид». Berichte der deutschen chemischen Gesellschaft. 31 (2): 1765–1769. Дои:10.1002 / cber.18980310281.
- ^ Адамс Р.; Левин, И. (1923). «Упрощение синтеза гидроксиальдегидов по Гаттерману». Варенье. Chem. Soc. 45 (10): 2373–77. Дои:10.1021 / ja01663a020.
- ^ а б Адамс, Роджер (1957). Органические реакции, Том 9. Нью-Йорк: John Wiley & Sons, Inc., стр. 38 и 53–54. Дои:10.1002 / 0471264180.or009.02. ISBN 9780471007265.
- ^ Fuson, R.C .; Хорнинг, Э. С .; Rowland, S.P .; Уорд, М. Л. (1955). «Мезитальдегид». Органический синтез. Дои:10.15227 / orgsyn.023.0057.; Коллективный объем, 3, п. 549
- ^ Gattermann, L .; Кох, Дж. А. (1897). "Ароматический альдегид Eine Synthese". Chemische Berichte. 30 (2): 1622–1624. Дои:10.1002 / cber.18970300288.
- ^ Ли, Джи Джек (2003). Назовите реакции: сборник подробных механизмов реакции (доступен на Google Книги ) (2-е изд.). Springer. п. 157. ISBN 3-540-40203-9.
- ^ Курти, Ласло. (2005). Стратегические применения названных реакций в органическом синтезе: история вопроса и подробные механизмы. Чако, Барбара. Берлингтон: Elsevier Science. ISBN 978-0-08-057541-4. OCLC 850164343.
- ^ Dilke, M. H .; Элей, Д. Д. (1949). «550. Реакция Гаттермана – Коха. Часть II. Кинетика реакции». J. Chem. Soc. 0: 2613–2620. Дои:10.1039 / JR9490002613. ISSN 0368-1769.
