Пиридазин - Pyridazine
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Пиридазин[1] | |||
| Систематическое название ИЮПАК 1,2-диазабензол | |||
| Другие имена 1,2-диазин Ортодиазин Oizine | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.005.478 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C4ЧАС4N2 | |||
| Молярная масса | 80.090 г · моль−1 | ||
| Внешность | Бесцветная жидкость | ||
| Плотность | 1,107 г / см3 | ||
| Температура плавления | -8 ° С (18 ° F, 265 К) | ||
| Точка кипения | 208 ° С (406 ° F, 481 К) | ||
| смешивающийся | |||
| Растворимость | смешивается в диоксан, этиловый спирт растворим в бензол, диэтиловый эфир незначительный в циклогексан, лигроин | ||
| 1,52311 (23,5 ° С) | |||
| Термохимия | |||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | 224,9 кДж / моль | ||
| Опасности | |||
| точка возгорания | 85 ° С (185 ° F, 358 К) | ||
| Родственные соединения | |||
Родственные соединения | пиридин, пиримидин, пиразин | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
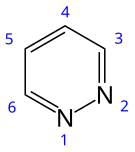
Пиридазин является гетероциклическим органическое соединение с молекулярной формулой (CH)4N2. Он содержит шестичленное кольцо с двумя соседними атомами азота и является ароматическим.[2] Это бесцветная жидкость с температурой кипения 208 ° C. Он изомерный с двумя другими (CH)4N2 кольца пиримидин и пиразин.
Вхождение
Пиридазины встречаются редко, что, возможно, отражает дефицит встречающихся в природе гидразины, общие строительные блоки для синтеза этих гетероциклов. Структура пиридазина является популярной фармакофор который содержится в ряде гербицидов, таких как кредитазин, пиридафол и пиридат. Он также входит в состав некоторых лекарств, таких как цефозопран, кадралазин, минаприн, пипофезин, и гидралазин.
Синтез
В ходе его классического исследования Синтез индола по Фишеру Эмиль Фишер получил первый пиридазин конденсацией фенилгидразин и левулиновая кислота.[3] Исходный гетероцикл впервые был получен окислением бензоциннолин к пиридазинтетракарбоновой кислоте с последующим декарбоксилирование. Лучший путь к этому эзотерическому соединению начинается с малеинового гидразида. Эти гетероциклы часто получают конденсацией 1,4-дикетоны или 4-кетокислоты с гидразины.[4]
Рекомендации
- ^ «Переднее дело». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 141. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Гумус, С. (2011). «Вычислительное исследование замещенных диазабензолов» (PDF). Turk J Chem. 35: 803–808. Архивировано из оригинал (PDF) на 2016-03-03. Получено 2014-04-10.
- ^ Фишер, Э. (1886). "Индол аус фенилгидразин". Юстус Либигс Аннален дер Хеми. 236 (1–2): 126–151. Дои:10.1002 / jlac.18862360107.
- ^ Тишлер, М .; Становник, Б. (1968). «Пиридазины». Успехи химии гетероциклов. 9: 211–320. Дои:10.1016 / S0065-2725 (08) 60374-8. ISBN 9780120206094.