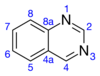
Хиназолин - Quinazoline
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Хиназолин | |||
| Другие имена 1,3-диазанафталин бензопиримидин фенмиазин бензо-1,3-диазин | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.005.424 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C8ЧАС6N2 | |||
| Молярная масса | 130.150 г · моль−1 | ||
| Внешность | светло-желтые кристаллы | ||
| Плотность | 1,351 г / см3, твердый | ||
| Температура плавления | 48 ° С (118 ° F, 321 К) | ||
| Точка кипения | 243 ° С (469 ° F, 516 К) | ||
| Растворимый | |||
| Кислотность (пKа) | 3.51[1] | ||
| Структура | |||
| 2.2 D[2] | |||
| Опасности | |||
| Главный опасности | Раздражающий | ||
| Паспорт безопасности | Внешний паспорт безопасности материалов | ||
| S-фразы (устарело) | S24 S25 | ||
| точка возгорания | 106 ° С (223 ° F, 379 К) | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Хиназолин является органическое соединение с формулой C8ЧАС6N2. Это ароматный гетероцикл с бициклической структурой, состоящей из двух конденсированных шестичленных ароматических колец, бензол кольцо и пиримидин звенеть. Это светло-желтое кристаллическое твердое вещество, растворимое в воде. Также известный как 1,3-диазанафталин, хиназолин получил свое название от аза производная от хинолин. Хотя исходная молекула хиназолина редко упоминается сама по себе в технической литературе, замещенные производные были синтезированы для медицинских целей, таких как противомалярийные и противораковые средства. Хиназолин - это плоская молекула. это изомерный с другими диазанафталинами бензодиазин подгруппа: циннолин, хиноксалин, и фталазин. Более 200 биологически активных хиназолинов и хинолиновые алкалоиды определены.[3][4]
Синтез
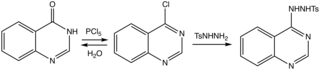 Получение 4-хлорхиназолина и его тозилгидразида.
Получение 4-хлорхиназолина и его тозилгидразида.
Впервые о синтезе хиназолина сообщил в 1895 г. Август Бишлер и Ланг через декарбоксилирование 2-карбоксипроизводного (хиназолин-2-карбоновая кислота).[5] В 1903 г. Зигмунд Габриэль сообщили о синтезе исходного хиназолина из о-нитробензиламин, который был восстановлен йодистым водородом и красным фосфором до 2-аминобензиламин. Восстановленный промежуточный продукт конденсируется с муравьиной кислотой с образованием дигидрохиназолина, который окисляется до хиназолина.[6]
Пересмотрены методы.[7] Эффективный путь к родительскому гетероциклу проходит через 4-хлорпроизводное к тозилгидразиду, который удаляется основанием.[8]
Реакции
Реакции гидратации и присоединения
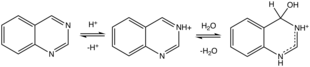 Гидратация хиназолиния.
Гидратация хиназолиния.
Протонаты (и метилиты) хиназолина по N3. Протонирование вызывает гидратацию. Многие слабокислые субстраты добавляются через связь C = N3, к ним относятся цианистый водород, бисульфит натрия, и метилкетоны.[9]
Гидролиз
В теплом растворе хиназолин гидролизуется в кислых и щелочных условиях до 2-аминобензальдегид (или продукты его самоконденсации) и муравьиная кислота и аммиак / аммоний.[2]
Электрофильное и нуклеофильное замещение
Пиримидиновое кольцо сопротивляется электрофильному замещению, хотя положение 4 является более реактивным, чем положение 2. Для сравнения, бензольное кольцо более восприимчиво к электрофильному замещению. Порядок реакционной способности по положению кольца: 8> 6> 5> 7. 2- и 4-галогенпроизводные хиназолина подвергаются замещению нуклеофилами, такими как пиперидин.[2]
Биологическое и фармакологическое значение
Гефитиниб
В мае 2003 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило хиназолин. гефитиниб. Препарат, выпускаемый АстраЗенека, является ингибитором протеинкиназа из рецептор эпидермального фактора роста (EGFR). Он связывается с АТФ-связывающим сайтом EGFR, таким образом инактивируя каскад передачи антиапоптотического сигнала Ras предотвращение дальнейшего роста раковых клеток.[10][11][12]
Лапатиниб
В марте 2007 г. GlaxoSmithKline наркотик лапатиниб был одобрен FDA США для лечения запущенных стадий или метастатического рака груди в сочетании с Рош с капецитабин. Лапатиниб предотвращает рост стволовых клеток рака груди, вызывающих рост опухоли. Связывание лапатиниба с сайтом связывания АТФ в EGFR и рецептор 2 эпидермального фактора роста человека (HER2) домены протеинкиназы подавляют активацию сигнального механизма (посредством обратимого конкурентного ингибирования).[13][14][15][16]
Эрлотиниб
В мае 2013 г. эрлотиниб, препарат, производимый Астеллас, был одобрен FDA США для лечения пациентов с НМРЛ с опухолями, вызванными мутациями EGFR. Связывание эрлотиниба с АТФ-связывающими сайтами рецепторов EGFR не позволяет EGFR продуцировать остатки фосфотирозина (из-за конкурентного ингибирования), что делает рецептор неспособным генерировать сигнальные каскады, способствующие росту клеток.[17][18]
Афатиниб
В июле 2013 года FDA США одобрило афатиниб, препарат, разработанный Boehringer Ingelheim, как необратимый конкурентный ингибитор киназ HER2 и EGFR. В то время как афатиниб демонстрирует механизм, аналогичный лаптинибу, в котором он действует как необратимый ингибитор HER2 и EGFR, афатиниб также показал активность против тирозинкиназ, которые стали устойчивыми к гефинитибу и эрлотинибу.[19]
- Хиназолинсодержащие препараты

Гефитиниб для лечения немелкоклеточный рак легкого.

Лапатиниб для лечения запущенной стадии или метастатического рака груди.

Эрлотиниб, противоопухолевый агент.

Афатиниб для лечения рака, резистентного к гефинитибу и эрлотинибу.
Смотрите также
Рекомендации
- ^ Армарего, У. Л. Ф. (1963). «Хиназолины». Успехи гетероциклической химии Том 1. Достижения в химии гетероциклов. 1. С. 253–309. Дои:10.1016 / S0065-2725 (08) 60527-9. ISBN 9780120206018. PMID 14087221.
- ^ а б c Бюхель, К. Х., изд. Методы органической химии (Хубен-Вейля): Дополнительные и дополнительные тома к 4-му изданию. Нью-Йорк: Георг Тиме Верлаг Штутгарт, 2001.
- ^ Шан, XF; Моррис-Натшке, SL; Лю, YQ; Guo, X; Сюй, XS; Гото, М; Li, JC; Ян, GZ; Ли, К. Х. (май 2018 г.). «Биологически активные хинолиновые и хиназолиновые алкалоиды часть I.» Обзоры медицинских исследований. 38 (3): 775–828. Дои:10.1002 / мед.21466. ЧВК 6421866. PMID 28902434.
- ^ Шан, Сяо-Фэй; Morris-Natschke, Susan L .; Ян, Гуань-Чжоу; Лю Инь-Цянь; Го, Сяо; Сюй, Сяо-Шань; Гото, Масуо; Ли, Цзюнь-Цай; Чжан, Цзи-Ю; Ли, Куо-Сюн (сентябрь 2018 г.). «Биологически активные хинолиновые и хиназолиновые алкалоиды часть II». Обзоры медицинских исследований. 38 (5): 1614–1660. Дои:10.1002 / med.21492. ISSN 0198-6325. ЧВК 6105521. PMID 29485730.
- ^ Асиф, М. Химические характеристики, методы синтеза и биологический потенциал хиназолина и производных хиназолинона, Международный журнал медицинской химии, ID статьи 395637, 2014 г. Дои:10.1155/2014/395637
- ^ Морган, Г.Т., изд. Резюме статей. Журнал химического общества. Лондон: Герни и Джексон, 1904. Печать.
- ^ Коннолли, Дэвид Дж .; Кьюсак, Деклан; О'Салливан, Тимоти П .; Гири, Патрик Дж. (2005). «Синтез хиназолинонов и хиназолинов». Тетраэдр. 61 (43): 10153–10202. Дои:10.1016 / j.tet.2005.07.010.
- ^ У. Л. Ф. Армарего (1967). «Галогенохиназолины». В У. Л. Ф. Армарего (ред.). Химия гетероциклических соединений. С. 11–38. Дои:10.1002 / 9780470186916.ch7. ISBN 9780470186916.
- ^ У. Л. Ф. Армарего (1967). «Хиназолин». В У. Л. Ф. Армарего (ред.). Химия гетероциклических соединений. С. 11–38. Дои:10.1002 / 9780470186916.ch2. ISBN 9780470186916.
- ^ «Иресса (Гефитиниб)» (PDF). Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 2 мая 2003 г.
- ^ Линч, Томас Дж .; Белл, Дафна В .; Сорделла, Рафаэлла; Гурубхагаватула, Сарада; Окимото, Росс А .; Brannigan, Brain W .; Харрис, Патрисия Л .; Хазерлат, Сара М .; Супко, Джеффри Дж .; Haluska, Франк G .; Луи, Дэвид Н .; Кристиани, Дэвид С .; Сеттлман, Джефф; Хабер, Даниэль А. (20 мая 2004 г.). «Активация мутаций в рецепторе эпидермального фактора роста, лежащая в основе реакции немелкоклеточного рака легкого на гефитиниб» (PDF). NEJM. 350 (21): 2129–39. Дои:10.1056 / nejmoa040938. PMID 15118073.
- ^ Такимото СН, Кальво Э. «Принципы онкологической фармакотерапии» in Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (ред.) Лечение рака: мультидисциплинарный подход. 11 изд. 2008 г.
- ^ «Лапатиниб». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 13 марта 2007 г.
- ^ Wood ER, Truesdale AT, McDonald OB, Yuan D, Hassell A, Dickerson SH, Ellis B, Pennisi C и др. (2004). «Уникальная структура рецептора эпидермального фактора роста, связанного с GW572016 (лапатиниб): взаимосвязь между конформацией белка, выходом ингибитора и активностью рецептора в опухолевых клетках». Исследования рака. 64 (18): 6652–9. Дои:10.1158 / 0008-5472.CAN-04-1168. PMID 15374980.
- ^ Родригес, А. (Апрель 2008 г.). Новый тип лекарств значительно уменьшает количество первичных опухолей рака груди всего за шесть недель; исследования приводят к новой цели в лечении рака - раковой стволовой клетке.. Архивировано из оригинал на 2008-11-26.
- ^ Нельсон MH, Долдер CR (февраль 2006 г.). «Лапатиниб: новый двойной ингибитор тирозинкиназы с активностью в отношении солидных опухолей». Энн Фармакотер. 40 (2): 261–9. Дои:10.1345 / aph.1G387. PMID 16418322. S2CID 21622641.
- ^ «Эрлотиниб». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 14 мая 2013 г.
- ^ Раймонд Э, Фэвр С., Арман Дж. (2000). «Тирозинкиназа рецептора эпидермального фактора роста в качестве мишени для противоопухолевой терапии». Наркотики. 60 Дополнение 1: 15–23, обсуждение 41–2. Дои:10.2165/00003495-200060001-00002. PMID 11129168. S2CID 10555942.
- ^ «Афатиниб». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 12 июля 2013 г.








