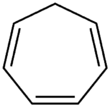
Циклогептатриен - Cycloheptatriene
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Циклогепта-1,3,5-триен[1] | |||
| Другие имена 1,3,5-Cycloheptatriene 1ЧАС- [7] Аннулен CHT Тропилиден | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 506066 | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.008.061 | ||
| Номер ЕС |
| ||
| 1943 | |||
PubChem CID | |||
| UNII | |||
| Номер ООН | 2603 | ||
| |||
| |||
| Характеристики | |||
| C7ЧАС8 | |||
| Молярная масса | 92.141 г · моль−1 | ||
| Плотность | 0,888 г / мл при 25 ° C | ||
| Температура плавления | -80 ° С (-112 ° F, 193 К) | ||
| Точка кипения | 116 ° С (241 ° F, 389 К) | ||
| Не растворим в воде | |||
| Кислотность (пKа) | 36 | ||
| Опасности | |||
| Пиктограммы GHS |     | ||
| Сигнальное слово GHS | Опасность | ||
| H225, H301, H304, H311, H315, H319, H335 | |||
| P210, P233, P240, P241, P242, P243, P261, P264, P270, P271, P280, P301 + 310, P302 + 352, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P312, P321, P322, P330, P331, P332 + 313, P337 + 313, P361, P362 | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Циклогептатриен (CHT) - это органическое соединение с формула C7ЧАС8. Это замкнутое кольцо из семи атомов углерода, соединенных тремя двойными связями (как следует из названия) и четырьмя одинарными связями. Эта бесцветная жидкость неоднократно вызывала теоретический интерес в органическая химия. Это лиганд в металлоорганическая химия и строительный блок в органический синтез. Циклогептатриен не является ароматный, что отражается в непланарности метиленовый мостик (-CH2-) по отношению к другим атомам; однако связанные катион тропилия является.
Синтез
Альберт Ладенбург впервые образовал циклогептатриен в 1881 году при разложении тропин.[2][3] Окончательно структура была подтверждена синтезом Ричард Вильштеттер в 1901 году. Этот синтез начался с циклогептанон и установил семичленную кольцевую структуру соединения.[4]
Циклогептатриен можно получить в лаборатории путем фотохимическая реакция из бензол с диазометан или пиролиз аддукта циклогексен и дихлоркарбен.[5] Родственный классический синтез производных циклогептатриена, Увеличение кольца Бюхнера, начинается с реакции бензол с этилдиазоацетат дать соответствующие Norcaradiene этиловый эфир, который затем подвергается термически разрешенной электроциклической расширение кольца с получением этилового эфира 1,3,5-циклогептатриен-7-карбоновой кислоты.[6][7]

Реакции
Удаление гидрид ион из метиленовый мостик дает плоский и ароматический катион циклогептатриена, также называемый тропилий ион. Практический путь к этому катиону включает PCl5 как окислитель.[8] CHT ведет себя как диен в Реакции Дильса – Альдера. Много металлические комплексы циклогептатриенов, включая Cr (CO)3(C7ЧАС8)[9] и циклогептатриенмолибден трикарбонил.[10]

Циклооктатетраен и циклогептатриен используются в качестве триплет тушитель для родамин 6G лазеры на красителях.[11][12]
Смотрите также
Рекомендации
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 223. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ А. Ладенбург (1883). "Смерть Конституции Атропинов". Annalen der Chemie Юстуса Либиха. 217 (1): 74–149. Дои:10.1002 / jlac.18832170107.
- ^ А. Ладенбург (1881). "Die Zerlegung des Tropines". Berichte der Deutschen Chemischen Gesellschaft. 14 (2): 2126–2131. Дои:10.1002 / cber.188101402127.
- ^ Р. Вильштеттер (1901). "Synthesen in der Tropingruppe. I. Synthese des Tropilidens". Annalen der Chemie Юстуса Либиха. 317 (2): 204–265. Дои:10.1002 / jlac.19013170206.
- ^ ОН. Винберг (1959). «Синтез циклогептатриена». Журнал органической химии. 24 (2): 264–265. Дои:10.1021 / jo01084a635.
- ^ Buchner, et al., Ber., 18, 2377 (1885);
- ^ Для вариации: Ирвин Смит Ли; Тоуни Плиний О. (1934). «Исследования полиметилбензолов. IX. Добавление этилдиазоацетата к дурену». Варенье. Chem. Soc. 56 (10): 2167–2169. Дои:10.1021 / ja01325a054.
- ^ Конроу, К. (1973). «Фторборат тропилия» (PDF). Органический синтез, собранный объем. 5: 1138.
- ^ Джеймс Х. Ригби, Кевин Р. Фалес (2004). «7α-АЦЕТОКСИ- (1Hβ, 6Hβ) -БИЦИКЛО [4.4.1] UNDECA-2,4,8-ТРИЕН ЧЕРЕЗ ХРОМ-СОДЕРЖИВАЕМЫЙ ЦИКЛООДИТАНИЕМ ВЫСШЕГО ПОРЯДКА». Органический синтез.; Коллективный объем, 10, п. 1
- ^ Green, Malcolm L.H .; Нг, Деннис К. П. (1995). «Циклогептатриеновые и -енильные комплексы ранних переходных металлов». Химические обзоры. 95 (2): 439–473. Дои:10.1021 / cr00034a006.
- ^ Томи Натх Дас; К. Индира Приядарсини (1994). «Триплет циклооктатетраена: реакционная способность и свойства». Журнал химического общества, транзакции Фарадея. 90 (7): 963–968. Дои:10.1039 / фут 9949000963.
- ^ Р. Паппалардо; Х. Самельсон; А. Лемпицки (1970). «Излучение длинноимпульсного лазера из родамина 6G с использованием циклооктатетраена». Письма по прикладной физике. 16 (7): 267–269. Bibcode:1970АпФЛ..16..267П. Дои:10.1063/1.1653190.