Закон Гесса - Hesss law - Wikipedia
Закон Гесса суммирования постоянной теплоты, также известный как Закон Гесса (или закон Гесса), это отношения в физическая химия названный в честь Жермен Хесс, а Швейцария -родившийся русский химик и врач кто опубликовал его в 1840 году. Закон гласит, что общая энтальпия изменение в течение всего курса химическая реакция одинаково вне зависимости от того, проводится ли реакция в один этап или в несколько этапов.[1][2]
Закон Гесса теперь понимается как выражение принцип сохранения энергии, также выраженное в первый закон термодинамики, и тот факт, что энтальпия химического процесса не зависит от пути, пройденного от начального до конечного состояния (т. е. энтальпия - это государственная функция ). Изменения энтальпии реакции можно определить по формуле калориметрия для многих реакций. Значения обычно указываются для процессов с одинаковыми начальными и конечными температурами и давлениями, хотя условия могут изменяться во время реакции. Закон Гесса можно использовать для определения общей энергии, необходимой для химической реакции, когда ее можно разделить на синтетические этапы, которые легче охарактеризовать по отдельности. Это позволяет составить сборник стандартные энтальпии образования, что может быть использовано в качестве основы для разработки сложных синтезов.
Теория
Закон Гесса гласит, что изменение энтальпии в химической реакции (т.е. тепло реакции при постоянном давлении) не зависит от пути между начальным и конечным состояниями.
Другими словами, если химическое изменение происходит несколькими разными путями, общее изменение энтальпии одинаково, независимо от пути, по которому происходит химическое изменение (при условии, что начальные и конечные условия одинаковы).
Закон Гесса позволяет энтальпия изменение (ΔH) для расчета реакции, даже если ее нельзя измерить напрямую. Это достигается путем выполнения основных алгебраических операций на основе химические уравнения реакций с использованием ранее определенных значений энтальпий образования.
Добавление химических уравнений приводит к чистому или общему уравнению. Если изменение энтальпии известно для каждого уравнения, результатом будет изменение энтальпии для итогового уравнения. Если чистое изменение энтальпии отрицательное (ΔHсеть <0) реакция экзотермическая и, скорее всего, спонтанная; положительные значения ΔH соответствуют эндотермический реакции. Энтропия также играет важную роль в определении спонтанности, поскольку некоторые реакции с положительным изменением энтальпии, тем не менее, являются спонтанными.
Закон Гесса гласит, что изменения энтальпии аддитивны. Таким образом, ΔH для одиночной реакции
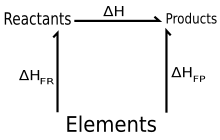
куда является энтальпия образования, а о надстрочный индекс указывает стандартное состояние значения. Это можно рассматривать как сумму двух (реальных или фиктивных) реакций:
- Реагенты → Элементы
и элементы → Продукты
Примеры
1) Учитывая:
- B2О3 (s) + 3H2O (г) → 3O2 (г) + В2ЧАС6 (г) (ΔH = 2035 кДж / моль)
- ЧАС2O (l) → H2O (г) (ΔH = 44 кДж / моль)
- ЧАС2 (г) + (1/2) O2 (г) → H2O (l) (ΔH = -286 кДж / моль)
- 2B (с) + 3H2 (г) → B2ЧАС6 (г) (ΔH = 36 кДж / моль)
Найдите ΔHж из:
- 2Б (с) + (3/2) О2 (г) → B2О3 (s)
После перемножения и обращения уравнений (и изменения их энтальпии) результат будет следующим:
- B2ЧАС6 (г) + 3O2 (г) → B2О3 (s) + 3H2O (г) (ΔH = -2035 кДж / моль)
- 3H2О (г) → 3Н2O (l) (ΔH = -132 кДж / моль)
- 3H2О (л) → 3Н2 (г) + (3/2) О2 (г) (ΔH = 858 кДж / моль)
- 2B (с) + 3H2 (г) → B2ЧАС6 (г) (ΔH = 36 кДж / моль)
Складывая эти уравнения и отбрасывая общие члены с обеих сторон, получаем
- 2Б (с) + (3/2) О2 (г) → B2О3 (с) (ΔH = -1273 кДж / моль)
2) а) Вграфит+ O2 → CO2 (г); (ΔH = -393,5 кДж / моль) (прямой шаг)
- до н.эграфит+1/2 O2 → CO (г); (ΔH = -110,5 кДж / моль)
- в) CO (г) +1/2 O2 → CO2 (грамм); (ΔH = - 283,02 кДж / моль)
→ В реакциях b) и c) общее ΔH = -393,5 кДж / моль, что равно ΔH в a)
Разница в величине ΔH составляет 0,02 кДж / моль, что связано с ошибками измерения.
Расширение свободной энергии и энтропии
Понятия закона Гесса можно расширить, включив в него изменения в энтропия И в Свободная энергия Гиббса, которые также государственные функции. В Термодинамический цикл Бордвелла является примером такого расширения, которое использует легко измеряемые равновесие и окислительно-восстановительные потенциалы определить экспериментально недоступные Свободная энергия Гиббса значения. Объединение ΔGо значения из термодинамических циклов Бордвелла и ΔHо значения, найденные с помощью закона Гесса, могут быть полезны при определении значений энтропии, которые не измеряются напрямую, и поэтому должны быть рассчитаны альтернативными способами.
За бесплатную энергию:
За энтропия, ситуация немного иная. Поскольку энтропия может быть измерена как абсолютная величина, а не относительно энтропии элементов в их эталонных состояниях (как в случае ΔHо и ΔGо) нет необходимости использовать энтропию образования; просто используются абсолютные энтропии для продуктов и реагентов:
Приложения
Закон Гесса о суммировании постоянной теплоты полезен при определении энтальпий следующих элементов:[1]
- Теплоты образования нестабильных промежуточных продуктов, таких как CO(грамм) и нет(грамм).
- Тепловые изменения при фазовых переходах и аллотропный переходы.
- Энергии решетки ионных веществ путем построения Циклы Борна-Габера если электронное сродство образовывать анион, как известно, или
- Сродство к электрону с использованием цикла Борна-Габера с теоретической энергия решетки
Смотрите также
Рекомендации
- ^ а б Маннам Кришнамурти; Субба Рао Найду (2012). «7». В Локешвара Гупта (ред.). Химия для ISEET - Том 1, Часть A (Изд. 2012 г.). Хайдарабад, Индия: Varsity Education Management Limited. п. 244.
- ^ «Закон Гесса - сохранение энергии». Университет Ватерлоо. Архивировано из оригинал 9 января 2015 г.. Получено 12 января 2014.
- Чакрабарти, Д. (2001). Введение в физическую химию. Мумбаи: Альфа-наука. С. 34–37. ISBN 1-84265-059-9.
дальнейшее чтение
- Лестер, Генри М. (1951). «Жермен Анри Гесс и основы термохимии». Журнал химического образования. 28 (11): 581–583. Bibcode:1951JChEd..28..581L. Дои:10.1021 / ed028p581.
внешняя ссылка
- Работа Гесса (1840 г.), на которой основан его закон (на сайте ChemTeam)
- эксперимент закона Гесса






