Цвиттерион - Zwitterion
В химия, а цвиттерион (/ˈтsvɪтəˌраɪəп/ ЦВИТ-ə-рожь-ən; из Немецкий Цвиттер [ˈTsvɪtɐ] 'гермафродит '), также называемый внутренняя соль, это молекула который содержит равное количество положительно и отрицательно заряженных функциональные группы.[1] С аминокислоты, например, в растворе a химическое равновесие будет устанавливаться между «родительской» молекулой и цвиттерионом.
Бетаины цвиттерионы, которые не могут изомеризовать в полностью нейтральную форму, например, когда положительный заряд находится на четвертичный аммоний группа. Точно так же молекула, содержащая фосфоний группа и карбоксилат группа не может изомеризоваться.
Аминокислоты

Равновесие устанавливается в два этапа. На одной стадии протон передается от карбоксильной группы к молекуле воды.
- ЧАС
2N (R) CO
2ЧАС + ЧАС
2О ⇌ ЧАС
2N (R) CO−
2 + ЧАС
3О+
На другом этапе протон переносится из гидроксоний ион к аминогруппе
- ЧАС
2N (R) CO−
2 + ЧАС
3О+
⇌ ЧАС
3N+
(R) CO−
2 + ЧАС
2О
В целом реакция изомеризация реакция
- ЧАС
2N (R) CO
2ЧАС ⇌ ЧАС
3N+
(R) CO−
2
Соотношение концентраций двух веществ в растворе не зависит от pH так как он равен значению константы равновесия K для реакции изомеризации.
[X] означает концентрацию химического вещества X в состоянии равновесия. Обычно предполагается, что K > 1, то есть цвиттерион является преобладающим изомером аминокислоты в водном растворе. На основе теоретического анализа было высказано предположение, что цвиттерион стабилизируется в водном растворе посредством водородная связь с молекулами растворителя воды.[2] Анализ нейтронография данные для глицин показали, что он находится в цвиттерионной форме в твердом состоянии, и подтвердили наличие водородных связей.[3] Теоретические расчеты были использованы, чтобы показать, что цвиттерионы также могут присутствовать в газовой фазе в некоторых случаях, отличных от простого переноса карбоновой кислоты на амин.[4]
В пKа значения для депротонирования обычных аминокислот охватывают приблизительный диапазон 2.15±0.2. Это также согласуется с тем, что цвиттерион является преобладающим изомером, присутствующим в водном растворе. Для сравнения, простая карбоновая кислота пропионовая кислота (CH
3CH
2CO
2ЧАС) имеет pKа значение 4,88.
Другие соединения

Сульфаминовая кислота изомеры, с цвиттерионом (справа)

Структура ЧАС4EDTA
Сульфаминовая кислота кристаллизуется в форме цвиттериона.[5]
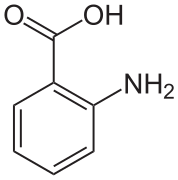
В кристаллах антраниловая кислота есть две молекулы в ячейка. Одна молекула находится в форме цвиттериона, другая - нет.[6]
В твердом состоянии ЧАС4EDTA представляет собой цвиттер-ион с двумя протонами, перенесенными с групп карбоновой кислоты на атомы азота.[7]
Теоретические исследования

Хотя равновесие в растворе между соединением и его цвиттер-ионным изомером не может быть изучено экспериментально, некоторое понимание может быть получено из результатов теоретических расчетов. Хороший пример - пиридоксальфосфат, форма витамин B6. Было предсказано достижение таутомерного равновесия в водном растворе этого соединения, благоприятствующего цвиттериону, в котором протон передается от фенольной -ОН-группы к атому азота.[8]
Бетаины и аналогичные соединения
Состав триметилглицин, который был изолирован от сахарная свекла, был назван «бетаин». Позже были обнаружены другие соединения, содержащие такой же структурный мотив, a четвертичный атом азота с карбоксилат группа, прикрепленная к нему через –CH2– связь. В настоящее время все соединения, в структуру которых входит этот мотив, известны как бетаины. Бетаины не изомеризуются, потому что химические группы, присоединенные к атому азота, не являются лабильный. Эти соединения можно классифицировать как постоянные цвиттерионы, поскольку изомеризация в молекулу без электрических зарядов не происходит или происходит очень медленно.[9]
Другие примеры постоянных цвиттерионов включают: фосфатидилхолины и псилоцибин, которые также содержат четвертичный атом азота, но с отрицательно заряженной фосфатной группой вместо карбоксилатной группы; и легочные сурфактанты Такие как дипальмитоилфосфатидилхолин.

Триметилглицин (банальное название бетаин)

Пример фосфатидилхолин
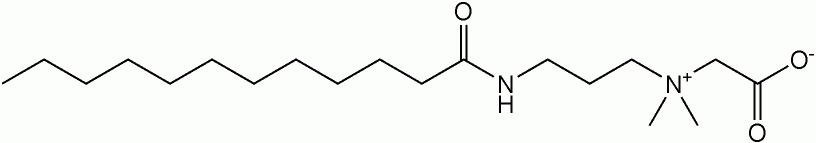
Лаурамидопропилбетаин, основной компонент кокамидопропилбетаин
Смотрите также
Рекомендации
- ^ Скуг, Дуглас, А .; West, Donald M .; Холлер, Ф. Джеймс; Крауч, Стэнли Р. (2004). Основы аналитической химии (8-е изд.). Томсон / Брукс / Коул. С. 231, 385, 419, 460. ISBN 0-03-035523-0.
- — (2013). Основы аналитической химии (9-е изд.). С. 415–416. ISBN 978-1-285-60719-1.CS1 maint: числовые имена: список авторов (связь)
- ^ Дженсен, Ян Х .; Гордон, Марк С. (1995). «О количестве молекул воды, необходимых для стабилизации цвиттериона глицина». Журнал Американского химического общества. 117 (31): 8159–8170. Дои:10.1021 / ja00136a013.
- ^ Jönsson, P.-G .; Квик, Å. (1972). «Прецизионное определение структуры белков и нуклеиновых кислот с помощью дифракции нейтронов. III. Кристаллическая и молекулярная структура аминокислоты α-глицина» (PDF). Acta Crystallographica Раздел B. 28 (6): 1827–1833. Дои:10.1107 / S0567740872005096.
- ^ Прайс, Уильям Д.; Jockusch, Rebecca A .; Уильямс, Эван Р. (1997). «Является ли аргинин цвиттерионом в газовой фазе?». Журнал Американского химического общества. 119 (49): 11988–11989. Дои:10.1021 / ja9711627. ЧВК 1364450. PMID 16479267.
- ^ Сасс, Р. Л. (1960). «Нейтронографическое исследование кристаллической структуры сульфаминовой кислоты». Acta Crystallographica. 13 (4): 320–324. Дои:10.1107 / S0365110X60000789.
- ^ Brown, C.J .; Эренберг, М. (1985). «Антраниловая кислота, C7ЧАС7НЕТ2, методом нейтронографии ». Acta Crystallographica C. 41 (3): 441–443. Дои:10.1107 / S0108270185004206.
- ^ Cotrait, Пар Мишель (1972). "La структура кристаллин де л'ацид этилендиамин тетраацетик, ЭДТА" [Кристаллическая структура этилендиаминтетрауксусной кислоты, ЭДТА]. Acta Crystallographica B. 28 (3): 781–785. Дои:10.1107 / S056774087200319X.
- ^ Кируба, Г. С. М .; Мин, Ва Вонг (2003). «Таутомерные равновесия производных пиридоксаль-5'-фосфата и 3-гидроксипиридина: теоретическое исследование эффектов сольватации». Журнал органической химии. 68 (7): 2874–2881. Дои:10.1021 / jo0266792. PMID 12662064.
- ^ Nelson, D. L .; Кокс, М. М. (2000). Ленингер, Принципы биохимии (3-е изд.). Нью-Йорк: стоит публикации. ISBN 1-57259-153-6.

![{displaystyle K = mathrm {frac {[H_ {3} N ^ {+} (R) CO_ {2} ^ {-}]} {[H_ {2} N (R) CO_ {2} H]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb3b1f175dd0458c9c2643ed5f88241423250f16)