Аминокислота с разветвленной цепью - Branched-chain amino acid
Эта статья нужно больше медицинские справки за проверка или слишком сильно полагается на основные источники. (Ноябрь 2018) |
А аминокислота с разветвленной цепью (BCAA) является аминокислота имея алифатический боковая цепь с веткой (центральная углерод атом, связанный с тремя или более атомами углерода). Среди протеиногенные аминокислоты, существует три BCAA: лейцин, изолейцин, и валин.[1] К непротеиногенным BCAA относятся: 2-аминоизомасляная кислота.
Три протеиногенных BCAA входят в число девяти незаменимые аминокислоты для человека - 35% незаменимых аминокислот в мышечных белках и 40% предварительно сформированных аминокислот, необходимых для млекопитающих.[2] Синтез BCAA происходит на всех участках растений в пределах пластиды клетки, что определяется наличием мРНК, кодирующих ферменты метаболического пути.[3]
BCAA выполняют несколько метаболических и физиологических ролей. Метаболически BCAA способствуют синтезу и обмену белка, сигнальным путям и метаболизму глюкозы.[4][5] Окисление BCAA может усилить окисление жирных кислот и сыграть роль в ожирении. Физиологически BCAA берут на себя роль в иммунной системе и функции мозга. BCAA эффективно расщепляются ферментами дегидрогеназы и декарбоксилазы, экспрессируемыми иммунными клетками, и необходимы для роста и пролиферации лимфоцитов и активности цитотоксических Т-лимфоцитов.[4] Наконец, BCAA разделяют один и тот же транспортный белок в мозг с ароматическими аминокислотами (Trp, Tyr и Phe). Попадая в мозг, BCAA могут играть роль в синтезе белка, синтезе нейромедиаторов и выработке энергии.[4]
Требования
Совет по пищевым продуктам и питанию (FNB) Института медицины США установил Рекомендуемые диетические нормы (RDA) для незаменимые аминокислоты в 2002 г. Для лейцина для взрослых от 19 лет и старше 42 мг / кг массы тела / день; для изолейцина 19 мг / кг массы тела / сутки; для валина 24 мг / кг массы тела / сут.[6] Для человека весом 70 кг (154 фунта) это соответствует 2,9, 1,3 и 1,7 г / день. Рационы, которые соответствуют или превышают рекомендованные суточные нормы общего белка (0,8 г / кг / день; 56 граммов для человека весом 70 кг), соответствуют или превышают рекомендованные суточные нормы для аминокислот с разветвленной цепью.
Исследование
Диетические BCAA использовались для лечения некоторых случаев печеночная энцефалопатия.[7] Они могут иметь эффект облегчения симптомов печеночной энцефалофатии, но нет доказательств того, что они улучшают показатели смертности, питания или общего качества жизни, поскольку необходимы дальнейшие исследования.[8]
Некоторые исследования предполагают возможную связь между высокой частотой боковой амиотрофический склероз (ALS) среди профессиональных игроков в американский футбол и итальянских футболистов, а также некоторые спортивные добавки, включая BCAA.[9] В исследованиях на мышах было показано, что BCAA вызывают повышенную возбудимость клеток, аналогичную той, которая обычно наблюдается у пациентов с БАС. Предлагаемый основной механизм состоит в том, что повышенная возбудимость клеток приводит к увеличению поглощения кальция клеткой и, таким образом, вызывает гибель клеток, особенно нейронных клеток, которые обладают особенно низкой способностью к буферизации кальция.[9]Тем не менее, какая-либо связь между BCAA и ALS еще предстоит полностью установить. В то время как BCAA могут вызывать гипервозбудимость, аналогичную той, которая наблюдается у мышей с ALS, текущие исследования не показывают, действительно ли диета, обогащенная BCAA, принимаемая в течение длительного периода, действительно вызывает симптомы, подобные ALS.[9]
Уровни BCAA в крови повышены у людей с ожирением и инсулинорезистентностью, а также у мышей и крыс с моделями диабета, индуцированного диетой, что предполагает возможность того, что BCAA вносят вклад в патогенез ожирения и диабета.[10][11] Диеты с ограничением BCAA улучшают толерантность к глюкозе и способствуют похуданию у мышей с нормальным весом,[12] восстанавливает чувствительность к инсулину и нормальную массу тела мышей с ожирением[13] и способствует чувствительности к инсулину у тучных крыс.[14]
Синтез
Пять ферментов играют важную роль в параллельных путях синтеза изолейцина, валина и лейцина: треониндегидрогеназа, ацетогидроксикислотсинтаза, кетокислотредуктоизомераза, дигидроксикислотдегигрогеназа и аминотрансфераза.[3] Треониндегидрогеназа катализирует дезаминирование и дегидратацию треонина до 2-кетобутирата и аммиака. Изолейцин образует петлю отрицательной обратной связи с треониндегидрогеназой. Синтаза ацетогидроксикислот является первым ферментом параллельного пути, осуществляющим реакцию конденсации на обеих стадиях - конденсация пирувата до ацетоацетата в валиновом пути и конденсация пирувата и 2-кетобутирата с образованием ацетогидроксибтилрата в изолейциновом пути. Следующая кетокислотредуктисомераза восстанавливает ацетогидроксикислоты из предыдущего этапа с образованием дигидроксикислот как валинового, так и изолейцинового путей. Дегидрогеназа дигидроксикислот превращает дигидроксикислоты на следующем этапе. Заключительный этап параллельного пути осуществляется аминотрансферазой, которая дает конечные продукты валин и изолейцин.[3] Еще четыре фермента - изопропилмалатсинтаза, изопропилмалат-изомераза, изопропилмалатдегидрогеназа и аминотрансфераза - необходимы для образования лейцина из 2-оксолсовалерата.[3]
Деградация
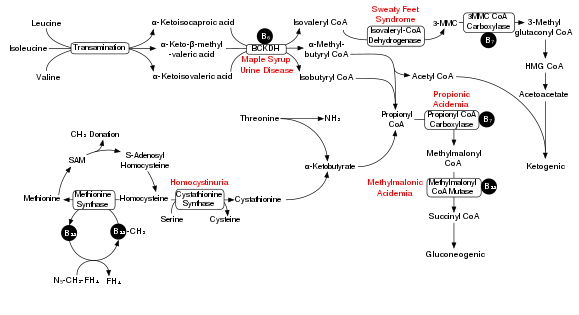
Разложение аминокислот с разветвленной цепью включает комплекс дегидрогеназы альфа-кетокислот с разветвленной цепью (BCKDH). Дефицит этого комплекса приводит к накоплению аминокислот с разветвленной цепью (лейцин, изолейцин, и валин ) и их токсичные побочные продукты в крови и моче, что дало этому условию название кленовый сироп болезнь мочи.
Комплекс BCKDH превращает аминокислоты с разветвленной цепью в ацил-КоА производные, которые после последующих реакций превращаются либо в ацетил-КоА или же сукцинил-КоА которые входят в цикл лимонной кислоты.[15]
Участвующие ферменты: аминотрансфераза с разветвленной цепью и 3-метил-2-оксобутаноатдегидрогеназа.
Передача сигналов клетки
В то время как большинство аминокислот окисляется в печени, BCAA в основном окисляются в скелетные мышцы и другие периферические ткани.[4] Эффекты введения BCAA на рост мышц в диафрагме крысы были протестированы и пришли к выводу, что не только смесь BCAA по отдельности оказывает такое же влияние на рост, как и полная смесь аминокислот, но и смесь аминокислот со всеми, кроме BCAA, не имеет влияние на рост мышц диафрагмы крысы.[16] Прием только изолейцина или валина не оказал никакого влияния на рост мышц, хотя введение одного лейцина оказалось почти таким же эффективным, как и полная смесь BCAA. Лейцин косвенно активирует p70 S6 киназа а также стимулирует сборку eIF4F комплекс, которые необходимы для связывания мРНК при инициации трансляции.[16] Киназа P70 S6 является частью мишень рапамицинового комплекса (mTOR) у млекопитающих сигнальный путь, и было показано, что он обеспечивает адаптивную гипертрофию и восстановление мышц крысы.[17] Инфузия протеина в состоянии покоя стимулирует синтез протеина через 30 минут после начала инфузии, и синтез протеина остается повышенным еще в течение 90 минут.[18] Инфузия лейцина в состоянии покоя дает шестичасовой стимулирующий эффект и увеличивает синтез белка за счет фосфорилирования киназы p70 S6 в скелетных мышцах.[18] После упражнений с отягощениями, без введения BCAA, сеанс упражнений с отягощениями не влияет на фосфорилирование mTOR и даже вызывает снижение фосфорилирования Akt. Обнаружено некоторое фосфорилирование киназы p70 S6. Когда BCAA вводили после тренировки, достаточное фосфорилирование киназы p70 S6 и S6 указывало на активацию сигнального каскада.[18]
Роль при сахарном диабете 2 типа
В дополнение к клеточной передаче сигналов, путь mTOR также играет роль в росте бета-клеток, приводя к инсулин секреция.[19] Высокий уровень глюкозы в крови запускает процесс сигнального пути mTOR, в котором лейцин играет косвенную роль.[17][20] Комбинация глюкозы, лейцина и других активаторов заставляет mTOR запускать передачу сигналов для пролиферации бета-клеток и секреции инсулина. Более высокие концентрации лейцина вызывают гиперактивность в пути mTOR, а киназа S6 активируется, что приводит к ингибированию субстрата рецептора инсулина через фосфорилирование серина.[19][20] В клетке повышенная активность комплекса mTOR вызывает в конечном итоге неспособность бета-клеток выделять инсулин, а ингибирующий эффект киназы S6 приводит к инсулинорезистентности в клетках, что способствует развитию инсулина. диабет 2 типа.[19]
Метформин способен активировать киназу AMP, которая фосфорилирует белки, участвующие в пути mTOR, а также приводит к прогрессированию комплекса mTOR из неактивного состояния в активное состояние.[19] Предполагается, что метформин действует как конкурентный ингибитор аминокислоты лейцина в пути mTOR.
Влияние добавок BCAA на упражнения
BCAA оказывают инсулиноподобное действие на глюкоза, вызывая снижение уровня глюкозы. BCAA, которые потребляются перед тренировкой, могут окисляться скелетные мышцы и используется в качестве энергии во время упражнения, уменьшая потребность в печень повысить уровень гликогенолиз. Во время анаэробных упражнений пируват молекулы, образующиеся в результате метаболизма глюкозы, превращаются в молочная кислота, накопление которых может привести к Метаболический ацидоз с уровнем pH всего 6,4.[21] Высокий уровень молочной кислоты вызывает остановку метаболизма глюкозы, чтобы снизить дальнейшее снижение pH. Было показано, что добавка BCAA снижает уровень молочной кислоты в мышцах, позволяя метаболизму глюкозы продолжаться.[22] Это приводит к снижению скорости гликогенолиза в печени и, как следствие, снижению уровня глюкозы в плазме. Однако исследования, проведенные в отношении долгосрочного воздействия BCAA на уровень глюкозы, показали, что постоянный прием BCAA не оказывает заметного влияния на уровень глюкозы в крови вне упражнений.[22]
Недавние исследования также показали, что BCAA снижают уровень циркулирующих свободные жирные кислоты (FFA) в крови.[22] FFAs конкурируют за сайты связывания на альбумин с триптофан и когда уровни FFAs в крови снижаются, уровни свободного триптофана также снижаются, поскольку большее количество связывается альбумином. Во время физических упражнений уровень свободного триптофана, поступающего в мозг, увеличивается, что приводит к увеличению 5-гидрокситриптамин (5-HT), способствующий возникновению чувства усталости. За счет снижения уровня свободных жирных кислот в крови BCAA могут помочь снизить уровень свободного триптофана, поступающего в мозг, и помочь уменьшить ощущение усталости в результате нагрузки.[23]
Также обнаружено, что BCAA снижают повышение сывороточных уровней аммиак что происходит во время тренировки. Это достигается за счет увеличения количества аммиака, используемого в глутамин синтез, предотвращающий чрезмерное накопление аммиака в крови.[22] Повышенный уровень аммиака в головном мозге приводит к снижению уровня ГАМК и глутамат, вызывая увеличение центральная утомляемость. Повышенный уровень аммиака в мышечной ткани также увеличивается. фосфофруктокиназа активность (PFK), приводящая к увеличению молочной кислоты, которая является основным фактором мышечной усталости.[24]
Кроме того, было показано, что добавка BCAA снижает уровень креатинкиназа в мышечных клетках после тренировки. Креатинкиназа является индикатором повреждения мышц и отвечает за перенос фосфатной группы из АТФ создать фосфокреатин молекула.[25] Было показано, что добавка BCAA снижает уровень креатинкиназы, что приводит к повышению уровня внутриклеточного АТФ и уменьшению чувства усталости.[26] Смотрите также ДОМС.
Смотрите также
Рекомендации
- ^ Сауэрс С. «Праймер по аминокислотам с разветвленной цепью» (PDF). Хантингтонский колледж медицинских наук. Получено 22 марта 2011.
- ^ Шимомура Ю., Мураками Т., Накай Н., Нагасаки М., Харрис Р.А. (июнь 2004 г.). «Упражнения способствуют катаболизму BCAA: влияние добавок BCAA на скелетные мышцы во время упражнений». Журнал питания. 134 (6 Прил.): 1583S – 1587S. Дои:10.1093 / jn / 134.6.1583S. PMID 15173434.
- ^ а б c d Сингх Б.К., Шанер Д.Л. (июль 1995 г.). «Биосинтез аминокислот с разветвленной цепью: от пробирки до поля». Растительная клетка. 7 (7): 935–944. Дои:10.1105 / tpc.7.7.935. ЧВК 160890. PMID 12242394.
- ^ а б c d Monirujjaman M (2014). «Метаболическая и физиологическая роль аминокислот с разветвленной цепью». Достижения молекулярной биологии. 2014: 1–6. Дои:10.1155/2014/364976.
- ^ Babchia N, Calipel A, Mouriaux F, Faussat AM, Mascarelli F (январь 2010 г.). «Пути передачи сигналов PI3K / Akt и mTOR / P70S6K в клетках увеальной меланомы человека: взаимодействие с B-Raf / ERK». Исследовательская офтальмология и визуализация. 51 (1): 421–9. Дои:10.1167 / iovs.09-3974. PMID 19661225.
- ^ Институт медицины (2002). «Белок и аминокислоты». Нормы потребления энергии, углеводов, клетчатки, жиров, жирных кислот, холестерина, белков и аминокислот с пищей. Вашингтон, округ Колумбия: The National Academies Press. С. 589–768.
- ^ Чадалавада Р., Саппати Бийяни Р.С., Максвелл Дж., Маллен К. (июнь 2010 г.). «Питание при печеночной энцефалопатии». Питание в клинической практике. 25 (3): 257–64. Дои:10.1177/0884533610368712. PMID 20581319.
- ^ Глууд, Лиз Лотте; Dam, Gitte; Лес, Иньиго; Марчезини, Джулио; Борре, Метте; Аагаард, Нильс Кристиан; Вилструп, Хендрик (18 мая 2017 г.). «Аминокислоты с разветвленной цепью для людей с печеночной энцефалопатией». Кокрановская база данных систематических обзоров. 5: CD001939. Дои:10.1002 / 14651858.cd001939.pub4. ISSN 1465-1858. ЧВК 6481897. PMID 28518283.
- ^ а б c Мануэль М., Хекман CJ (март 2011 г.). «Сильнее не всегда лучше: может ли пищевая добавка для бодибилдинга привести к БАС?». Экспериментальная неврология. 228 (1): 5–8. Дои:10.1016 / j.expneurol.2010.12.007. ЧВК 3049458. PMID 21167830.
- ^ Линч CJ, Адамс SH (декабрь 2014 г.). «Аминокислоты с разветвленной цепью в метаболической передаче сигналов и резистентности к инсулину». Обзоры природы. Эндокринология. 10 (12): 723–36. Дои:10.1038 / nrendo.2014.171. ЧВК 4424797. PMID 25287287.
- ^ Newgard CB, An J, Bain JR, Muehlbauer MJ, Stevens RD, Lien LF, Haqq AM, Shah SH, Arlotto M, Slentz CA, Rochon J, Gallup D, Ilkayeva O, Wenner BR, Yancy WS, Eisenson H, Musante G , Surwit RS, Millington DS, Butler MD, Svetkey LP (апрель 2009 г.). «Метаболическая характеристика, связанная с аминокислотами с разветвленной цепью, которая отличает людей с ожирением и худощавым телом и способствует развитию инсулинорезистентности». Клеточный метаболизм. 9 (4): 311–26. Дои:10.1016 / j.cmet.2009.02.002. ЧВК 3640280. PMID 19356713.
- ^ Фонтана Л., Каммингс Н. Э., Арриола Апело С. И., Нойман Дж. К., Каса И., Шмидт Б. А., Кава Э, Спелта Ф, Тости В., Сайед Ф. А., Баар Е. Л., Веронезе Н., Коттрелл С. Е., Фенске Р. Дж., Бертоцци Б., Брар Г. К., Пьетка Т, Буллок А.Д., Фигеншау Р.С., Андриоль Г.Л., Мерринс М.Дж., Александр С.М., Кимпл М.Э., Ламминг Д.В. (июль 2016 г.). «Снижение потребления аминокислот с разветвленной цепью улучшает метаболическое здоровье». Отчеты по ячейкам. 16 (2): 520–530. Дои:10.1016 / j.celrep.2016.05.092. ЧВК 4947548. PMID 27346343.
- ^ Каммингс Н. Э., Уильямс Э. М., Каса И., Конон Э. Н., Шайд М. Д., Шмидт Б. А., Пудель С., Шерман Д. С., Ю. Д., Арриола Апело С. И., Коттрелл С. Е., Гейгер Г., Барнс М. Е., Висински Д. А., Фенске Р. Дж., Матковский К. А., Кимпл ME, Александр CM, Merrins MJ, Lamming DW (декабрь 2017 г.). «Восстановление метаболического здоровья за счет снижения потребления аминокислот с разветвленной цепью». Журнал физиологии. 596 (4): 623–645. Дои:10.1113 / JP275075. ЧВК 5813603. PMID 29266268.
- ^ White PJ, Lapworth AL, An J, Wang L, McGarrah RW, Stevens RD, Ilkayeva O, George T., Muehlbauer MJ, Bain JR, Trimmer JK, Brosnan MJ, Rolph TP, Newgard CB (июль 2016 г.). «Ограничение аминокислот с разветвленной цепью у крыс Zucker-fatty улучшает мышечную чувствительность к инсулину за счет повышения эффективности окисления жирных кислот и экспорта ацил-глицина». Молекулярный метаболизм. 5 (7): 538–51. Дои:10.1016 / j.molmet.2016.04.006. ЧВК 4921791. PMID 27408778.
- ^ Sears DD, Hsiao G, Hsiao A, Yu JG, Courtney CH, Ofrecio JM, Chapman J, Subramaniam S (ноябрь 2009 г.). «Механизмы инсулинорезистентности человека и тиазолидиндион-опосредованная сенсибилизация к инсулину». Труды Национальной академии наук Соединенных Штатов Америки. 106 (44): 18745–50. Дои:10.1073 / pnas.0903032106. ЧВК 2763882. PMID 19841271.
- ^ а б Кимбалл С.Р., Джефферсон Л.С. (январь 2006 г.). «Сигнальные пути и молекулярные механизмы, посредством которых аминокислоты с разветвленной цепью опосредуют трансляционный контроль синтеза белка». Журнал питания. 136 (1 приложение): 227С – 31С. Дои:10.1093 / jn / 136.1.227S. PMID 16365087.
- ^ а б Bodine SC, Stitt TN, Gonzalez M, Kline WO, Stover GL, Bauerlein R, Zlotchenko E, Scrimgeour A, Lawrence JC, Glass DJ, Yancopoulos GD (ноябрь 2001 г.). «Путь Akt / mTOR является важным регулятором гипертрофии скелетных мышц и может предотвращать атрофию мышц in vivo». Природа клеточной биологии. 3 (11): 1014–9. Дои:10.1038 / ncb1101-1014. PMID 11715023. S2CID 16284975.
- ^ а б c Бломстранд Э., Элиассон Дж., Карлссон Х.К., Кёнке Р. (январь 2006 г.). «Аминокислоты с разветвленной цепью активируют ключевые ферменты в синтезе белка после физических упражнений». Журнал питания. 136 (1 приложение): 269S – 73S. Дои:10.1093 / jn / 136.1.269S. PMID 16365096.
- ^ а б c d БЦ Мельник (март 2012 г.). «Сигнализация лейцина в патогенезе диабета 2 типа и ожирения». Всемирный журнал диабета. 3 (3): 38–53. Дои:10.4239 / WJD.v3.i3.38. ЧВК 3310004. PMID 22442749.
- ^ а б Бальказар Моралес Н., Агилар де Плата С. (июль 2012 г.). «Роль пути AKT / mTORC1 в пролиферации β-клеток поджелудочной железы». Колумбия Медика. 43 (3): 235–43. Дои:10.25100 / см. V43i3.783. ЧВК 4001958. PMID 24893199.
- ^ Сахлин, Кент (1986). «Мышечная усталость и накопление молочной кислоты». Acta Physiologica Scandinavica Supplementum. 556: 83–91. PMID 3471061.
- ^ а б c d Hormoznejad, Razie; Заре Джавид, Ахмад; Мансури, Анахита (август 2019 г.). «Название записи: Влияние добавок BCAA на центральную утомляемость, субстрат энергетического метаболизма и повреждение мышц при выполнении упражнений: систематический обзор с метаанализом». Спортивные науки для здоровья. 15 (2): 265–279. Дои:10.1007 / s11332-019-00542-4. S2CID 78093727.
- ^ Уотсон, Филипп; Shirreffs, Susan M .; Моэн, Рональд Дж. (Декабрь 2004 г.). «Влияние острого приема добавок с аминокислотами с разветвленной цепью на длительную физическую нагрузку в теплой среде». Европейский журнал прикладной физиологии. 93 (3): 306–314. Дои:10.1007 / s00421-004-1206-2. PMID 15349784. S2CID 20597074.
- ^ Mutch, B.J.C .; Банистер, Э. У. (1983). «Обмен аммиака при упражнениях и усталости: обзор». Медицина и наука в спорте и физических упражнениях. 15 (1983): 41–50. Дои:10.1249/00005768-198315010-00009. PMID 6341752.
- ^ Maughan, RJ; Глисон, М (2010). Биохимические основы спортивных результатов (2-е изд.). Издательство Оксфордского университета. С. 81–82. ISBN 978-0-19-920828-9. Дата обращения 06.12.2019. Проверить значения даты в:
| accessdate =(помощь) - ^ Мохаммад Хоссейн, Рахими; Шаб-Бидар, Сакине; Моллахоссейни, Мехди; Джафарян, Курош (октябрь 2017 г.). «Добавление аминокислот с разветвленной цепью и повреждение мышц, вызванное физической нагрузкой, при восстановлении после упражнений: метаанализ рандомизированных клинических испытаний». Питание. 42: 30–36. Дои:10.1016 / j.nut.2017.05.005. PMID 28870476.
внешняя ссылка
- Разветвленная цепь + аминокислоты + кислоты в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Путь разложения аминокислот с разветвленной цепью
- Синтетический путь в дрожжах (WikiPathways)