Электрон-переносящая флавопротеиндегидрогеназа - Electron-transferring-flavoprotein dehydrogenase
| Электрон-переносящая флавопротеиндегидрогеназа | |||||||
|---|---|---|---|---|---|---|---|
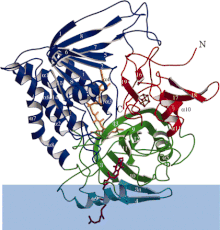 Ленточная диаграмма электрон-переносящей флавопротеиндегидрогеназы, где каждый функциональный домен окрашен по-разному. Синяя полоса - это область мембраны. | |||||||
| Идентификаторы | |||||||
| Символ | ETFD | ||||||
| Альт. символы | ETF-QO | ||||||
| Ген NCBI | 2110 | ||||||
| HGNC | 3483 | ||||||
| OMIM | 231675 | ||||||
| PDB | 2GMH | ||||||
| RefSeq | NM_004453 | ||||||
| UniProt | Q16134 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 1.5.5.1 | ||||||
| Locus | Chr. 4 q4q32.1 | ||||||
| |||||||
Электрон-переносящая флавопротеиндегидрогеназа (ETF дегидрогеназа или же электронный перенос флавопротеин-убихинон оксидоредуктаза, EC 1.5.5.1 ) - фермент, переносящий электроны от электрон-переносящий флавопротеин в митохондриальный матрикс, в убихинон бассейн в внутренняя митохондриальная мембрана.[1][2] Это часть электронная транспортная цепь. Фермент обнаружен как у прокариот, так и у эукариот и содержит флавин и Кластер FE-S.[3] У человека он кодируется ETFDH ген. Дефицит дегидрогеназы ETF вызывает у человека генетическое заболевание множественный дефицит ацил-КоА-дегидрогеназы.[4]
Функция
ETQ-QO связывает окисление жирные кислоты и немного аминокислоты на окислительное фосфорилирование в митохондриях. В частности, он катализирует перенос электронов из электрон-переносящий флавопротеин (ETF) в убихинон, восстанавливая его до убихинола. Вся последовательность реакций переноса следующая:[5]
Ацил-КоА → Ацил-КоА дегидрогеназа → ETF → ETF-QO → UQ → Комплекс III.
Катализированная реакция
Общая реакция, катализируемая ETF-QO, выглядит следующим образом:[6]
ETF-QO (красный) + убихинон ↔ ETF-QO (ox) + убихинол
Ферментативная активность обычно оценивается спектрофотометрически по реакции с октаноил-КоА как донор электронов и убихинон-1 как акцептор электронов. Фермент также можно определить с помощью непропорциональность семихинона ETF. Обе реакции приведены ниже:[7][8]
Октаноил-КоА + Q1 ↔ Q1ЧАС2 + Окт-2-еноил-КоА
2 ETF1- ↔ ETFбык + ETF2-
Структура
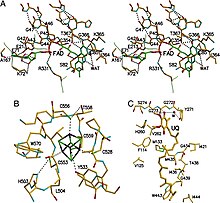
ETF-QO состоит из одного структурного домена с тремя функциональными доменами, упакованными в непосредственной близости: домен FAD, кластерный домен 4Fe4S и UQ-связывающий домен.[5] FAD находится в расширенной конформации и глубоко похоронен в своей функциональной области. Множественные водородные связи и диполь с положительной спиралью модулировать окислительно-восстановительный потенциал FAD и, возможно, стабилизировать анионный семихинон средний. Кластер 4Fe4S также стабилизирован обширными водородными связями вокруг кластера и его цистеин составные части. Связывание убихинона достигается за счет глубокого гидрофобного связывающего кармана, который отличается от других UQ-связывающих белков, таких как сукцинат-Q оксидоредуктаза. Хотя ETF-QO является интегральным мембранным белком, он не проходит через всю мембрану в отличие от других UQ-связывающих белков.[5]
Механизм
Точный механизм снижения неизвестен, хотя есть два предполагаемых пути. Первый путь - это перенос электронов от одноэлектронно восстановленного ETF по одному к центру FAD с более низким потенциалом. Один электрон передается от восстановленного FAD к кластеру железа, что приводит к двухэлектронному восстановленному состоянию с одним электроном на каждом FAD и кластерном доменах. Затем связанный убихинон восстанавливается до убихинола, по крайней мере временно, с образованием однократно восстановленного семиубихинона. Второй путь включает передачу электронов от ETF кластеру железа с последующими внутренними переходами между двумя электронными центрами. После уравновешивания остальная часть пути будет описана выше.[5]
Клиническое значение
Дефицит ETF-QO приводит к расстройству, известному как глутаровая ацидемия II типа (также известный как MADD для множественного дефицита ацил-CoA-дегидрогеназы), при котором происходит неправильное накопление жиров и белков в организме.[9] Осложнения могут включать ацидоз или же гипогликемия, с другими симптомами, такими как общая слабость, увеличение печени, усиление сердечной недостаточности и карнитин дефицит. Более тяжелые случаи связаны с врожденными дефектами и полным метаболическим кризисом.[10][11][12] Генетически это аутосомно-рецессивное заболевание, поэтому оно встречается довольно редко. Большинство пораженных пациентов являются результатом одноточечных мутаций в области интерфейса убихинона FAD.[13][14] Более легкие формы расстройства поддаются лечению: рибофлавин терапии и придуманы реагирующим на рибофлавин MADD (RR-MADD), хотя из-за различных мутаций, вызывающих заболевание, лечение и симптомы могут значительно различаться.[15][16]
Смотрите также
Рекомендации
- ^ Гисла С., Торп С. (февраль 2004 г.). «Ацил-КоА дегидрогеназы. Обзор механизма». Европейский журнал биохимии / FEBS. 271 (3): 494–508. Дои:10.1046 / j.1432-1033.2003.03946.x. PMID 14728676.
- ^ Хе М., Ратледж С.Л., Келли Д.Р., Палмер К.А., Мердок Дж., Маджумдер Н., Николлс Р.Д., Пей З., Уоткинс П.А., Фокли Дж. (Июль 2007 г.). «Новое генетическое нарушение бета-окисления митохондриальных жирных кислот: дефицит ACAD9». Американский журнал генетики человека. 81 (1): 87–103. Дои:10.1086/519219. ЧВК 1950923. PMID 17564966.
- ^ Watmough NJ, Frerman FE (декабрь 2010 г.). «Флавопротеин электронного переноса: убихинон оксидоредуктазы». Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 1797 (12): 1910–6. Дои:10.1016 / j.bbabio.2010.10.007. PMID 20937244.
- ^ Виани-Ляуд С., Диври П., Грегерсен Н., Матье М. (1987). «Врожденные ошибки митохондриального окисления жирных кислот». Журнал наследственных метаболических заболеваний. 10 Дополнение 1: 159–200. Дои:10.1007 / bf01812855. PMID 3119938. S2CID 9771779.
- ^ а б c d Чжан Дж., Фрерман Ф. Э., Ким Дж. Дж. (Октябрь 2006 г.). «Структура переноса электронов флавопротеин-убихинон оксидоредуктазы и перенос электронов в митохондриальный пул убихинона». Труды Национальной академии наук Соединенных Штатов Америки. 103 (44): 16212–7. Дои:10.1073 / pnas.0604567103. ЧВК 1637562. PMID 17050691.
- ^ Рамзи Р.Р., Стинкамп DJ, Хусейн М. (февраль 1987 г.). «Реакции флавопротеина с переносом электрона и флавопротеина с переносом электрона: убихинон оксидоредуктаза». Биохимический журнал. 241 (3): 883–92. Дои:10.1042 / bj2410883. ЧВК 1147643. PMID 3593226.
- ^ Beckmann JD, Frerman FE (июль 1985 г.). «Реакция флавопротеина с переносом электрона и флавопротеин-убихинон оксидоредуктаза с переносом электрона». Биохимия. 24 (15): 3922–5. Дои:10.1021 / bi00336a017. PMID 2996585.
- ^ Watmough NJ, Loehr JP, Drake SK, Frerman FE (февраль 1991 г.). «Флуоресценция триптофана в флавопротеине с электронным переносом: убихинон оксидоредуктаза: тушение флуоресценции бромированным псевдосубстратом». Биохимия. 30 (5): 1317–23. Дои:10.1021 / bi00219a023. PMID 1991113.
- ^ Frerman, F.E .; Гудман, С. И. (1985). «Дефицит флавопротеина электронного переноса или флавопротеина переноса электронов: убихинон оксидоредуктаза в фибробластах глутаровой ацидемии II типа». Труды Национальной академии наук. 82 (13): 4517–4520. Дои:10.1073 / pnas.82.13.4517. ЧВК 391133. PMID 2989828.
- ^ Галлоуэй Дж. Х., Картрайт И. Дж., Беннетт М. Дж. (Март 1987 г.). «Аномальный липидный состав миокарда у младенца с глутаровой ацидурией II типа». Журнал липидных исследований. 28 (3): 279–84. PMID 3572253.
- ^ Singla M, Guzman G, Griffin AJ, Bharati S (март 2008 г.). «Кардиомиопатия при недостаточности множественной ацил-КоА дегидрогеназы: клинико-патологическая корреляция и обзор литературы». Детская кардиология. 29 (2): 446–51. Дои:10.1007 / s00246-007-9119-6. PMID 17912479. S2CID 370626.
- ^ Тернбулл Д.М., Бартлетт К., Эйр Дж. А., Гарднер-Медвин Д., Джонсон М. А., Фишер Дж., Уотмоу, штат Нью-Джерси (октябрь 1988 г.). «Миопатия накопления липидов из-за глутаровой ацидурии типа II: лечение потенциально фатальной миопатии». Медицина развития и детская неврология. 30 (5): 667–72. Дои:10.1111 / j.1469-8749.1988.tb04806.x. PMID 3229565. S2CID 33989343.
- ^ Лян В.К., Окума А., Хаяси Ю.К., Лопес Л.К., Хирано М., Нонака И., Ногучи С., Чен Л.Х., Йонг Й.Дж., Нишино И. (март 2009 г.). «Мутации ETFDH, уровни CoQ10 и активность дыхательной цепи у пациентов с недостаточностью множественной ацил-CoA дегидрогеназы, чувствительной к рибофлавину». Нервно-мышечные расстройства. 19 (3): 212–6. Дои:10.1016 / j.nmd.2009.01.008. PMID 19249206. S2CID 28328495.
- ^ Гудман С.И., Бинард Р.Дж., Вунтнер М.Р., Фрерман Ф.Е. (2002). «Глутаровая ацидемия типа II: структура гена и мутации гена флавопротеина переноса электронов: убихинон оксидоредуктазы (ETF: QO)». Молекулярная генетика и метаболизм. 77 (1–2): 86–90. Дои:10.1016 / S1096-7192 (02) 00138-5. PMID 12359134.
- ^ Olsen RK, Olpin SE, Андресен BS, Miedzybrodzka ZH, Pourfarzam M, Merinero B, Frerman FE, Beresford MW, Dean JC, Cornelius N, Andersen O, Oldfors A, Holme E, Gregersen N, Turnbull DM, Morris AA (август 2007 г.) ). «Мутации ETFDH как основная причина дефицита множественного дегидрирования ацил-КоА, чувствительного к рибофлавину». Мозг. 130 (Pt 8): 2045–54. Дои:10.1093 / мозг / awm135. PMID 17584774.
- ^ Rhead W, Roettger V, Marshall T, поправка B (февраль 1993 г.). «Множественное нарушение дегидрирования ацил-кофермента А, реагирующее на рибофлавин: окисление субстрата, метаболизм флавина и активность флавоэнзима в фибробластах». Педиатрические исследования. 33 (2): 129–35. Дои:10.1203/00006450-199302000-00008. PMID 8433888.
