Пуриновый метаболизм - Purine metabolism
Эта статья включает в себя список общих Рекомендации, но он остается в основном непроверенным, потому что ему не хватает соответствующих встроенные цитаты. (Июль 2014 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Пуриновый метаболизм относится к метаболические пути синтезировать и разрушить пурины которые присутствуют во многих организмах.
Биосинтез
Пурины синтезируются биологически как нуклеотиды и, в частности, как риботиды, т.е. основания, прикрепленные к рибозо-5-фосфат. Обе аденин и гуанин происходят от нуклеотида монофосфат инозина (IMP), которое является первым соединением на пути, которое имеет полностью сформированную пуриновую кольцевую систему.
IMP
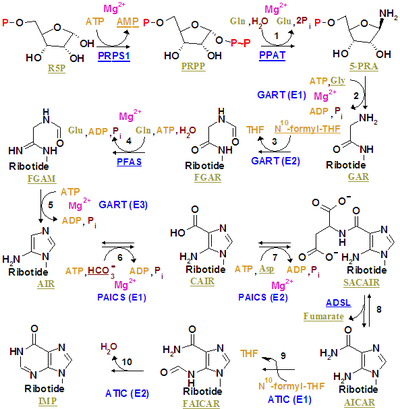
Монофосфат инозина синтезируется на уже существующем рибозофосфате сложным путем (как показано на рисунке справа). Источник углерод и азот атомы пуринового кольца, 5 и 4 соответственно, происходят из нескольких источников. Аминокислота глицин вносит все свои атомы углерода (2) и азота (1) с дополнительными атомами азота из глутамина (2) и аспарагиновая кислота (1), и дополнительные атомы углерода из формильные группы (2), которые перенесены из кофермент тетрагидрофолат в качестве 10-формилтетрагидрофолат, и атом углерода из бикарбонат (1). Формильные группы образуют углерод-2 и углерод-8 в пуриновой кольцевой системе, которые действуют как мосты между двумя атомами азота.
Ключевым этапом регулирования является производство 5-фосфо-α-D-рибозил-1-пирофосфат (PRPP ) рибозофосфатпирофосфокиназой, которая активируется неорганический фосфат и инактивирован пуриновыми рибонуклеотидами. Это не обязательная стадия синтеза пурина, поскольку PRPP также используется в синтезе пиримидина и в путях восстановления.
Первый совершенный шаг - это реакция ПРПП, глутамин и вода 5'-фосфорибозиламин (PRA), глутамат, и пирофосфат - катализируется амидофосфорибозилтрансфераза, который активируется PRPP и ингибируется AMP, GMP и IMP.
PRPP + L-глутамин + H2O → PRA + L-глутамат + PPi
На втором этапе реагируйте PRA, глицин и СПС для создания GAR, АДФ и пирофосфат - катализируются фосфорибозиламин — глицинлигаза (ГАР синтетаза). Из-за химической лабильности PRA, период полураспада которого составляет 38 секунд при pH 7,5 и 37 ° C, исследователи предположили, что соединение передается от амидофосфорибозилтрансферазы к GAR-синтетазе. in vivo.[1]
PRA + глицин + ATP → GAR + ADP + Pi
Третий катализируется фосфорибозилглицинамид формилтрансфераза.
Четвертый катализируется фосфорибозилформилглицинамидинсинтаза.
fGAR + L-глутамин + АТФ → fGAM + L-глутамат + АДФ + Pi
Пятый катализируется Синтетаза AIR (циклаза FGAM).
fGAM + АТФ → ВОЗДУХА + ADP + Pi + H2О
Шестой катализируется фосфорибозиламиноимидазолкарбоксилаза.
Седьмой катализируется фосфорибозиламиноимидазолесукцинокарбоксамидсинтаза.
CAIR + L-аспартат + АТФ → SAICAR + ADP + Pi
Восьмерка катализируется аденилосукцинатлиаза.
Продукты AICAR и фумарат идут двумя разными путями. AICAR служит реагентом на девятой стадии, в то время как фумарат транспортируется в цикл лимонной кислоты, который затем может пропускать стадии выделения диоксида углерода для получения малата. Превращение фумарата в малат катализируется фумаразой. Таким образом, фумарат связывает синтез пурина с циклом лимонной кислоты.[2]
Девятый катализируется фосфорибозиламиноимидазолкарбоксамидформилтрансфераза.
AICAR + fTHF → FAICAR + THF
Последний шаг катализируется Инозинмонофосфатсинтаза.
FAICAR → IMP + H2О
В эукариоты второй, третий и пятый этапы катализируются трифункциональный пуриновый биосинтетический белок аденозин-3, который кодируется геном GART.
И девятый, и десятый этапы выполняются с помощью одного белка, называемого бифункциональным белком биосинтеза пуринов PURH, кодируемого геном ATIC.
GMP
- IMP дегидрогеназа (IMPDH) конвертирует IMP в XMP
- GMP-синтаза конвертирует XMP в GMP
- GMP редуктаза конвертирует GMP обратно в IMP
AMP
- аденилосукцинатсинтаза конвертирует IMP в аденилосукцинат
- аденилосукцинатлиаза превращает аденилосукцинат в AMP
- AMP дезаминаза конвертирует AMP обратно в IMP
Деградация
Пурины метаболизируются несколькими ферменты:
Гуанин
- А нуклеаза освобождает нуклеотид
- А нуклеотидаза создает гуанозин
- Пуриновая нуклеозид фосфорилаза обращает гуанозин к гуанин
- Гуанасе превращает гуанин в ксантин
- Ксантиноксидаза (форма ксантин оксидоредуктазы) катализирует окисление ксантина на мочевая кислота
Аденин
- А нуклеаза освобождает нуклеотид
- А нуклеотидаза создает аденозин, тогда аденозиндезаминаза создает инозин
- В качестве альтернативы, AMP дезаминаза создает инозиновая кислота, затем нуклеотидаза создает инозин
- Пуриновая нуклеозид фосфорилаза действует на инозин, создавая гипоксантин
- Ксантиноксидаза катализирует биотрансформацию гипоксантина в ксантин
- Ксантиноксидаза действует на ксантин, создавая мочевая кислота
Регламенты биосинтеза пуриновых нуклеотидов
Образование 5'-фосфорибозиаламина из глутамина и PRPP, катализируемое PRPP-аминотрансферазой, является точкой регуляции синтеза пурина. Фермент является аллостерическим ферментом, поэтому он может быть преобразован из IMP, GMP и AMP в высокой концентрации, связывает фермент и оказывает ингибирование, в то время как PRPP в большом количестве связывается с ферментом, вызывающим активацию. Итак, IMP, GMP и AMP являются ингибиторами, а PRPP - активатором. Между образованием 5'-фосфорибозила, аминоимидазола и ИМФ нет известной стадии регуляции.
Спасение
Пурины из оборота клеточных нуклеиновых кислот (или из пищи) также могут быть спасены и повторно использованы в новых нуклеотидах.
- Фермент аденинфосфорибозилтрансфераза (APRT) спасения аденин.
- Фермент гипоксантин-гуанинфосфорибозилтрансфераза (HGPRT) спасает гуанин и гипоксантин.[3] (Генетический дефицит HGPRT вызывает Синдром Леша – Найхана.)
Расстройства
Когда дефектный ген вызывает появление пробелов в метаболическом процессе рециркуляции пуринов и пиримидинов, эти химические вещества не метаболизируются должным образом, и взрослые или дети могут страдать от одного из двадцати восьми наследственных заболеваний, некоторые из которых, возможно, еще неизвестны. Симптомы могут включать: подагра, анемия, эпилепсия, задержка развития, глухота, компульсивное укусывание, почечная недостаточность или камни или потеря иммунитета.
Метаболизм пуринов может иметь дисбаланс, который может возникать из-за включения вредных нуклеотидных трифосфатов в ДНК и РНК, что в дальнейшем приводит к генетическим нарушениям и мутациям и, как следствие, вызывает несколько типов заболеваний. Некоторые из болезней:
- Тяжелый иммунодефицит из-за потери аденозиндезаминазы.
- Гиперурикемия и синдром Леша – Найхана из-за потери гипоксантин-гуанинфосфорибозилтрансферазы.
- Различные виды рака из-за увеличения активности ферментов, таких как дегидрогеназа IMP.[4]
Фармакотерапия
Модуляция пуринового обмена имеет фармакотерапевтическое значение.
Ингибиторы синтеза пурина подавляют разрастание клеток, особенно лейкоциты. Эти ингибиторы включают: азатиоприн, иммунодепрессант, используемый в трансплантация органов, аутоиммунное заболевание Такие как ревматоидный артрит или воспалительное заболевание кишечника, такое как болезнь Крона и язвенный колит.
Микофенолят мофетил иммунодепрессант, используемый для предотвращения отторжения при трансплантации органов; он подавляет синтез пурина, блокируя инозитолмонофосфатдегидрогеназу. Метотрексат косвенно подавляет синтез пурина, блокируя метаболизм фолиевая кислота (это ингибитор дигидрофолатредуктаза ).
Аллопуринол представляет собой препарат, который ингибирует фермент ксантин оксидоредуктазу и, таким образом, снижает уровень мочевой кислоты в организме. Это может быть полезно при лечении подагры, заболевания, вызванного избытком мочевой кислоты, образующей кристаллы в суставах.
Смотрите также
Рекомендации
- ^ Антл В.Д., Лю Д., МакКеллар Б.Р., Каперелли, Калифорния, Хуа М., Винс Р. (апрель 1996 г.). «Субстратная специфичность глицинамидрибонуклеотидсинтетазы из куриной печени». Журнал биологической химии. 271 (14): 8192–5. Дои:10.1074 / jbc.271.14.8192. PMID 8626510.
- ^ Гарретт Р.Х., Гришэм К.М. (11.02.2016). Биохимия (Шестое изд.). Бостон, Массачусетс. С. 666 и 934. ISBN 9781305577206. OCLC 914290655.
- ^ Ансари М.Ю., Экбал А., Дикхит М.Р., Мансури Р., Рана С., Али В. и др. (Февраль 2016). «Установление корреляции между тестовым анализом in-silico и in-vitro против Leishmania HGPRT к ингибиторам». Международный журнал биологических макромолекул. 83: 78–96. Дои:10.1016 / j.ijbiomac.2015.11.051. PMID 26616453.
- ^ Панг Б., Макфалин Дж. Л., Берджис Н. Э., Донг М., Тагизаде К., Салливан М. Р. и др. (Февраль 2012 г.). «Дефекты метаболизма пуриновых нуклеотидов приводят к существенному включению ксантина и гипоксантина в ДНК и РНК». Труды Национальной академии наук Соединенных Штатов Америки. 109 (7): 2319–24. Bibcode:2012PNAS..109.2319P. Дои:10.1073 / pnas.1118455109. JSTOR 41477470. ЧВК 3289290. PMID 22308425.
