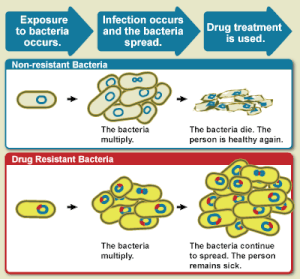
Устойчивость к противомикробным препаратам - Antimicrobial resistance

Устойчивость к противомикробным препаратам (AMR или же AR) происходит, когда микробы развивать механизмы, которые защищают их от воздействия противомикробные препараты.[2] Период, термин устойчивость к антибиотикам (AR или же ABR) является подмножеством AMR, поскольку он применяется к бактерии которые становятся устойчивыми к антибиотики.[2] Устойчивые микробы труднее лечить, требуя более высоких доз или альтернативных лекарств, которые могут оказаться более токсичный. Эти подходы также могут быть более дорогими. Микробы, устойчивые к нескольким антимикробным препаратам, называются множественная лекарственная устойчивость (MDR).
Все классы микробов могут развить устойчивость. Грибы эволюционировать противогрибковый сопротивление. Вирусы эволюционировать противовирусное средство сопротивление. Простейшие эволюционировать противопротозойный сопротивление, и бактерии эволюционировать антибиотик сопротивление. Те бактерии, которые считаются широко устойчивыми к лекарствам (XDR) или полностью устойчивыми к лекарствам (TDR), иногда называют «супербактериями».[3] Устойчивость бактерий может возникнуть естественным путем: генетическая мутация, или один вид приобретает сопротивление от другого.[4] Устойчивость может возникать спонтанно из-за случайных мутаций. Однако расширенное использование противомикробных препаратов, по-видимому, способствует отбору мутаций, которые могут сделать противомикробные препараты неэффективными.
Предупреждение злоупотребление антибиотиками которая может привести к устойчивости к антибиотикам, включая назначение или использование антибиотиков только тогда, когда они необходимы.[5][6] Антибиотики узкого спектра действия предпочтительнее, чем антибиотики широкого спектра действия, когда это возможно, поскольку эффективное и точное поражение конкретных организмов с меньшей вероятностью вызовет резистентность, а также побочные эффекты.[7][8] Людям, которые принимают эти лекарства дома, важно знать, как правильно их использовать. Поставщики медицинских услуг могут свести к минимуму распространение устойчивых инфекций, используя надлежащие санитария и гигиена, включая мытье рук дезинфекция между пациентами и должна поощрять то же самое в отношении пациента, посетителей и членов семьи.[9]
Рост устойчивости к лекарственным препаратам вызван, главным образом, применением противомикробных препаратов у людей и других животных и распространением устойчивых штаммов между ними.[5] Растущее сопротивление также связано со сбросом неочищенных сточных вод фармацевтической промышленности, особенно в странах, где производятся лекарственные средства в больших объемах.[10] Увеличение количества антибиотиков селективное давление в бактериальных популяциях, вызывая гибель уязвимых бактерий; это увеличивает процент устойчивых бактерий, которые продолжают расти. Даже при очень низких уровнях антибиотика устойчивые бактерии могут иметь преимущество в росте и расти быстрее, чем уязвимые бактерии.[11] Поскольку устойчивость к антибиотикам становится все более распространенной, возрастает потребность в альтернативных методах лечения. Раздаются призывы к применению новых методов лечения антибиотиками, но разработка новых лекарств становится все реже.[12]
Устойчивость к противомикробным препаратам растет во всем мире из-за более широкого доступа к антибиотическим препаратам в развивающиеся страны.[13] По оценкам, ежегодно в результате умирает от 700 000 до нескольких миллионов человек, которые по-прежнему представляют серьезную угрозу общественному здоровью во всем мире.[14][15][16] Каждый год в Соединенных Штатах не менее 2,8 миллиона человек заражаются бактериями, устойчивыми к антибиотикам, и в результате не менее 35 000 человек умирают.[17] В соответствии с Всемирная организация здоровья По оценкам ВОЗ, к 2050 году УПП может вызвать триста пятьдесят миллионов смертей.[18]
Раздаются публичные призывы к глобальным коллективным действиям по устранению угрозы, которые включают предложения по международные договоры по устойчивости к противомикробным препаратам.[19] Устойчивость к антибиотикам в мире полностью не идентифицирована, но более бедные страны с более слабыми системами здравоохранения страдают от этого.[6]
Определение
ВОЗ определяет устойчивость к противомикробным препаратам как микроорганизм устойчивость к противомикробным препаратам который когда-то был способен лечить инфекцию, вызванную этим микроорганизмом.[2] Человек не может стать устойчивым к антибиотикам. Устойчивость - это свойство микроба, а не человека или другого организма, инфицированного микробом.[21]
Устойчивость к антибиотикам - это разновидность устойчивости к противомикробным препаратам. Эта более конкретная устойчивость связана с патогенными бактериями и, таким образом, разбита на две дополнительные подгруппы, микробиологические и клинические. Связанная микробиологически резистентность является наиболее распространенной и происходит от генов, мутировавших или унаследованных, что позволяет бактериям сопротивляться механизму, связанному с определенными антибиотиками. Клиническая резистентность проявляется в неэффективности многих терапевтических методов, когда бактерии, которые обычно восприимчивы к лечению, становятся устойчивыми после того, как пережили исход лечения. В обоих случаях приобретенной устойчивости бактерии могут передавать генетический катализатор устойчивости посредством конъюгации, трансдукции или трансформации. Это позволяет устойчивости распространяться на один и тот же патоген или даже на похожие бактериальные патогены.[22]
Обзор
В отчете ВОЗ, опубликованном в апреле 2014 года, говорится: «Эта серьезная угроза больше не является предсказанием на будущее, она происходит прямо сейчас во всех регионах мира и может затронуть любого человека любого возраста и в любой стране. Устойчивость к антибиотикам— когда бактерии меняются, поэтому антибиотики больше не работают у людей, которым они нужны для лечения инфекций, - теперь это серьезная угроза общественному здоровью ».[23] В 2018 году ВОЗ считала устойчивость к антибиотикам одной из самых серьезных угроз для глобального здоровья, продовольственной безопасности и развития.[24] В Европейский центр профилактики и контроля заболеваний подсчитали, что в 2015 году в ЕС и Европейской экономической зоне было 671 689 случаев инфицирования, вызванных устойчивыми к антибиотикам бактериями, что привело к 33 110 случаям смерти. Большинство из них было приобретено в медицинских учреждениях.[25]
Причины
Устойчивость к противомикробным препаратам в основном вызвана чрезмерным использованием противомикробных препаратов. Это приводит к тому, что микробы либо вырабатывают защиту от лекарств, используемых для их лечения, либо определенные штаммы микробов, обладающие естественной устойчивостью к противомикробным препаратам, становятся гораздо более распространенными, чем те, которые легко победить с помощью лекарств.[26] В то время как устойчивость к противомикробным препаратам действительно возникает естественным образом с течением времени, использование противомикробных агентов в различных условиях как в сфере здравоохранения, так и за ее пределами привело к тому, что устойчивость к противомикробным препаратам становится все более распространенной.[27]
Естественное явление

Устойчивость к противомикробным препаратам может развиваться естественным путем из-за постоянного воздействия противомикробных препаратов. Естественный отбор означает, что организмы, способные адаптироваться к окружающей среде, выживают и продолжают производить потомство.[28] В результате типы микроорганизмов, которые способны выжить в течение долгого времени при продолжающемся воздействии определенных противомикробных агентов, естественным образом станут более распространенными в окружающей среде, а те, которые не обладают такой устойчивостью, станут устаревшими.[27] Со временем большинство имеющихся штаммов бактерий и инфекций станут устойчивыми к антимикробному агенту, используемому для их лечения, что делает этот агент теперь неэффективным для поражения большинства микробов. С увеличением использования противомикробных средств этот естественный процесс ускоряется.[29]
Самолечение
Самолечение потребителями определяется как «прием лекарств по собственной инициативе или по предложению другого человека, который не является сертифицированным медицинским работником», и это было определено как одна из основных причин развития устойчивости к противомикробным препаратам.[30] Пытаясь справиться со своей болезнью, пациенты следуют советам ложных источников в СМИ, друзьям и семье, заставляя их принимать противомикробные препараты без необходимости или в избытке. Многие люди прибегают к этому по необходимости, когда у них ограниченная сумма денег для посещения врача или во многих развивающихся странах слаборазвитая экономика и отсутствие врачей являются причиной самолечения. В этих развивающихся странах правительства разрешают продажу противомикробных препаратов в качестве безрецептурных лекарств, чтобы люди могли получить к ним доступ без необходимости искать или платить за посещение медицинского работника.[31] Такой расширенный доступ делает чрезвычайно простым получение противомикробных препаратов без консультации врача, в результате чего многие противомикробные препараты принимаются неправильно, что приводит к появлению устойчивых штаммов микробов. Одним из основных примеров страны, которая сталкивается с этими проблемами, является Индия, где в штате Пенджаб 73% населения прибегали к лечению своих незначительных проблем со здоровьем и хронических заболеваний с помощью самолечения.[30]
Основная проблема самолечения - это незнание общественности об опасных последствиях устойчивости к противомикробным препаратам и о том, как они могут способствовать этому, неправильно обращаясь или ставя себе неправильный диагноз. Чтобы определить общественные знания и предвзятые представления об устойчивости к антибиотикам, как об основном типе устойчивости к противомикробным препаратам, был проведен скрининг 3537 статей, опубликованных в Европе, Азии и Северной Америке. Из 55 225 опрошенных людей 70% слышали об устойчивости к антибиотикам ранее, но 88% из них думали, что это относится к физическим изменениям в организме.[30] Поскольку так много людей во всем мире имеют возможность заниматься самолечением с помощью антибиотиков, а подавляющее большинство не знают, что такое устойчивость к противомикробным препаратам, это делает повышение устойчивости к противомикробным препаратам гораздо более вероятным.
Клиническое неправильное использование
Неправильное клиническое использование со стороны медицинских работников - еще одна причина повышенной устойчивости к противомикробным препаратам. Исследования, проведенные CDC показывают, что показания к лечению антибиотиками, выбор используемого средства и продолжительность терапии были неправильными в 50% исследованных случаев. В другом исследовании, проведенном в отделении интенсивной терапии в крупной больнице Франции, было показано, что от 30% до 60% назначенных антибиотиков не нужны.[32] Такое ненадлежащее использование противомикробных агентов способствует развитию устойчивости к противомикробным препаратам, поддерживая бактерии в развитии генетических изменений, которые приводят к устойчивости.[33] В исследовании, проведенном Американским журналом инфекционного контроля, направленном на оценку отношения и знаний врачей об устойчивости к противомикробным препаратам в амбулаторных условиях, только 63% опрошенных указали, что устойчивость к антибиотикам является проблемой в их местной практике, в то время как 23% сообщили о агрессивном назначении. антибиотиков по мере необходимости, чтобы избежать неспособности оказать адекватную помощь.[34] Это демонстрирует, как большинство врачей недооценивают влияние их собственных привычек на устойчивость к противомикробным препаратам в целом. Это также подтверждает, что некоторые врачи могут быть чрезмерно осторожными, когда дело доходит до назначения антибиотиков как по медицинским, так и по юридическим причинам, даже если показания к применению этих препаратов не всегда подтверждаются. Это может привести к ненужному применению противомикробных препаратов.
Загрязнение окружающей среды
Неочищенные стоки фармацевтических производств,[35] больницы и клиники, а также неправильная утилизация неиспользованных или просроченных лекарств может подвергнуть микробы в окружающей среде воздействию антибиотиков и вызвать развитие резистентности.
Производство продуктов питания
Домашний скот

Кризис устойчивости к противомикробным препаратам распространяется и на пищевую промышленность, особенно на животных, производящих продукты питания. Антибиотики скармливают скоту, чтобы они действовали как добавки для роста и профилактическая мера для снижения вероятности инфекций. Это приводит к переносу устойчивых штаммов бактерий в пищу, которую едят люди, вызывая потенциально смертельную передачу болезни. Хотя такая практика действительно приводит к повышению урожайности и увеличению мясных продуктов, это серьезная проблема с точки зрения предотвращения устойчивости к противомикробным препаратам.[36] Хотя данные, связывающие использование противомикробных препаратов в животноводстве с устойчивостью к противомикробным препаратам, ограничены, Консультативная группа Всемирной организации здравоохранения по комплексному надзору за устойчивостью к противомикробным препаратам настоятельно рекомендовала сократить использование важных с медицинской точки зрения противомикробных препаратов в животноводстве. Кроме того, Консультативная группа заявила, что такие противомикробные препараты должны быть прямо запрещены как для стимуляции роста, так и для профилактики заболеваний.[37]
В исследовании, опубликованном Национальная Академия Наук картирование потребления противомикробных препаратов животноводством во всем мире прогнозировалось, что в 228 изученных странах к 2030 году общее потребление антибиотиков животноводством увеличится на 67%. В некоторых странах, таких как Бразилия, Россия, Индия, Китай и Южная Африка прогнозируется увеличение на 99%.[29] Несколько стран ограничили использование антибиотиков в животноводстве, включая Канаду, Китай, Японию и США. Эти ограничения иногда связаны с уменьшением распространенность устойчивости к противомикробным препаратам у людей.[37]
Пестициды
Большинство пестицидов защищают посевы от насекомых и растений, но в некоторых случаях антимикробные пестициды используются для защиты от различных микроорганизмов, таких как бактерии, вирусы, грибки, водоросли и простейшие. Чрезмерное использование многих пестицидов в попытке получить более высокий урожай сельскохозяйственных культур привело к тому, что многие из этих микробов выработали толерантность к этим антимикробным агентам. В настоящее время зарегистрировано более 4000 противомикробных пестицидов. EPA и проданы на рынок, показывая широкое использование этих агентов.[38] Подсчитано, что на каждый прием пищи, потребляемый человеком, используется 0,3 г пестицидов, поскольку 90% всех используемых пестицидов используется в сельском хозяйстве. Большинство этих продуктов используются для защиты от распространения инфекционных заболеваний и, надеюсь, для защиты здоровья населения. Но из большого количества используемых пестицидов, по оценкам, менее 0,1% этих противомикробных агентов действительно достигают своих целей. Это оставляет более 99% всех пестицидов, используемых для заражения других ресурсов.[39] В почве, воздухе и воде эти противомикробные агенты могут распространяться, вступая в контакт с большим количеством микроорганизмов и приводя к развитию у этих микробов механизмов, позволяющих переносить пестициды и в дальнейшем сопротивляться им.
Профилактика

В обществе все чаще звучат призывы к глобальным коллективным действиям по борьбе с угрозой, в том числе предложение о заключении международного договора о противомикробной устойчивости. Дальнейшие детали и внимание по-прежнему необходимы, чтобы распознавать и измерять тенденции сопротивления на международном уровне; была предложена идея глобальной системы отслеживания, но ее реализация еще не реализована. Система такого рода обеспечит понимание областей с высокой устойчивостью, а также информацию, необходимую для оценки программ и других изменений, внесенных для борьбы или обращения вспять устойчивости к антибиотикам.
Продолжительность приема антибиотиков
Продолжительность лечения антибиотиками должна зависеть от инфекции и других проблем со здоровьем, которые могут быть у человека.[7] В отношении многих инфекций после выздоровления мало доказательств того, что прекращение лечения вызывает усиление сопротивления.[7] Поэтому некоторые считают, что в некоторых случаях может быть разумным досрочное прекращение работы.[7] Однако другие инфекции требуют длительных курсов независимо от того, чувствует ли человек лучше.[7]
Мониторинг и картография
Существует множество национальных и международных программ мониторинга лекарственно-устойчивых угроз, в том числе: метициллин-устойчивый Золотистый стафилококк (MRSA), устойчивый к ванкомицину S. aureus (VRSA), бета-лактамаза расширенного спектра (ESBL), устойчивый к ванкомицину Энтерококк (VRE), множественная лекарственная устойчивость Acinetobacter baumannii (MRAB).[40]
ResistanceOpen - это глобальная онлайн-карта устойчивости к противомикробным препаратам, разработанная HealthMap который отображает агрегированные данные об устойчивости к противомикробным препаратам из общедоступных и предоставленных пользователями данных.[41][42] Веб-сайт может отображать данные для радиуса 25 миль от местоположения. Пользователи могут отправлять данные из антибиотики для отдельных больниц или лабораторий. Европейские данные взяты из EARS-Net (Европейская сеть наблюдения за устойчивостью к противомикробным препаратам), входящей в ECDC.
ResistanceMap - это сайт Центр динамики, экономики и политики заболеваний и предоставляет данные об устойчивости к противомикробным препаратам на глобальном уровне.[43]
Ограничение использования антибиотиков
Программы рационального использования антибиотиков оказались полезными для снижения уровня устойчивости к антибиотикам.[44] Программа управления антибиотиками также предоставит фармацевтам знания, чтобы научить пациентов, что антибиотики не действуют против вируса.[45]
Чрезмерное употребление антибиотиков стало одним из главных факторов развития устойчивости к антибиотикам. С начала эры антибиотиков антибиотики использовались для лечения широкого спектра заболеваний.[46] Чрезмерное употребление антибиотиков стало основной причиной повышения уровня устойчивости к антибиотикам. Основная проблема заключается в том, что врачи готовы прописывать антибиотики неосведомленным людям, которые считают, что антибиотики могут вылечить почти все болезни, включая вирусные инфекции, такие как простуда. При анализе рецептов на лекарства 36% людей с простудой или инфекцией верхних дыхательных путей (обе вирусные по происхождению) получали рецепты на антибиотики.[47] Эти предписания не привели ни к чему иному, кроме увеличения риска дальнейшей эволюции устойчивых к антибиотикам бактерий.[48]
На уровне больницы
Антимикробное управление бригады в больницах поощряют оптимальное использование противомикробных препаратов.[49] Цели управления антимикробными препаратами - помочь практикующим врачам выбрать правильное лекарство с правильной дозой и продолжительностью терапии, предотвращая неправильное использование и минимизируя развитие резистентности. Управление может сократить продолжительность пребывания в среднем чуть более чем на 1 день, не увеличивая при этом риск смерти.[50]
На уровне фермерства
Установлено, что использование антибиотиков в животноводстве может вызвать у бактерий, содержащихся в пищевых продуктах, устойчивость к антибиотикам (путем инъекций или лечебных кормов).[51] По этой причине в этой практике используются только противомикробные препараты, которые считаются «не имеющими клинического значения».
Недавние исследования показали, что профилактическое использование «неприоритетных» или «не клинически значимых» противомикробных препаратов в кормах потенциально может, при определенных условиях, привести к совместному отбору бактерий AMR из окружающей среды с устойчивостью к важным с медицинской точки зрения антибиотикам.[52] Возможность совместного отбора резистентностей к УПП в пищевой цепи может иметь далеко идущие последствия для здоровья человека.[52][53]
На уровне GP
Учитывая объем медицинской помощи, оказываемой в первичном звене (общая практика), недавние стратегии были сосредоточены на сокращении ненужного назначения антибиотиков в этой обстановке. Было показано, что простые меры, такие как письменная информация, объясняющая бесполезность антибиотиков для лечения распространенных инфекций, таких как инфекции верхних дыхательных путей, сокращают количество выписываемых антибиотиков.[54]
Лицо, выписывающее рецепт, должно строго придерживаться пяти прав приема лекарств: правильный пациент, правильный препарат, правильная доза, правильный путь и правильное время.[55]
По показаниям перед лечением следует проводить посевы, а лечение может быть изменено на основании отчета о чувствительности.[9][56]
Около трети рецептов на антибиотики, выписанные на амбулаторные учреждения в Соединенных Штатах были неприемлемыми в 2010 и 2011 годах. Врачи в США выписали 506 ежегодных сценариев приема антибиотиков на каждую 1000 человек, из которых 353 были необходимы по медицинским показаниям.[57]
Медицинские работники и фармацевты могут помочь в борьбе с сопротивляемостью путем: усиления профилактики инфекций и борьбы с ними; назначать и отпускать антибиотики только тогда, когда они действительно необходимы; назначение и выдача подходящих антибиотиков для лечения болезни.[23]
На индивидуальном уровне
Люди могут помочь справиться с резистентностью, используя антибиотики только по назначению врача; выполнение полного рецепта, даже если они чувствуют себя лучше; никогда не делитесь антибиотиками с другими и не пользуйтесь оставшимися рецептами.[23]
Примеры стран
- В Нидерланды имеет самый низкий уровень назначения антибиотиков в ОЭСР, из расчета 11,4 установленных суточных доз (DDD) на 1000 человек в день в 2011 году.
- Германия и Швеция также имеют более низкие показатели выписывания лекарств, причем в Швеции их количество снижается с 2007 года.
- Греция, Франция и Бельгия имеют высокий процент выписывания более 28 DDD.[58]
Вода, санитария, гигиена
Борьба с инфекционными заболеваниями за счет улучшения вода, санитария и гигиена (WASH) инфраструктуру необходимо включить в повестку дня по устойчивости к противомикробным препаратам (УПП). «Межведомственная координационная группа по устойчивости к противомикробным препаратам» заявила в 2018 году, что «распространение патогенов через небезопасную воду приводит к высокому бремени желудочно-кишечных заболеваний, что еще больше увеличивает потребность в лечении антибиотиками».[59] Это особенно проблема в развивающиеся страны где распространение инфекционных заболеваний, вызванных неадекватными стандартами WASH, является основным фактором спроса на антибиотики.[60] Растущее использование антибиотиков вместе с устойчивыми уровнями инфекционных заболеваний привело к опасному циклу, в котором зависимость от противомикробных препаратов возрастает, а их эффективность снижается.[60] Правильное использование инфраструктуры водоснабжения, санитарии и гигиены (WASH) может привести к снижению на 47–72% случаев диареи, леченных антибиотиками, в зависимости от типа вмешательства и его эффективности.[60] Снижение бремени диареи за счет улучшения инфраструктуры привело бы к значительному сокращению числа случаев диареи, леченных антибиотиками. По оценкам, к 2030 году этот показатель составит от 5 миллионов в Бразилии до 590 миллионов в Индии.[60] Сильная связь между повышенным потреблением и сопротивлением указывает на то, что это напрямую смягчит ускоряющееся распространение УПП.[60] Санитария и водоснабжение для всех к 2030 г. Цель номер 6 из Цели устойчивого развития.
Увеличение мытье рук соблюдение требований персоналом больницы приводит к снижению уровня резистентных организмов.[61]
Инфраструктура водоснабжения и санитарии в медицинских учреждениях предлагает значительные сопутствующие выгоды в борьбе с УПП, и необходимо увеличить инвестиции.[59] Есть много возможностей для улучшения: по оценкам ВОЗ и ЮНИСЕФ в 2015 году, в мире 38% медицинских учреждений не имели источника воды, почти 19% не имели туалетов и 35% не имели воды и мыла или средств для дезинфекции рук на спиртовой основе для мытья рук. .[62]
Очистка промышленных сточных вод
Производителям противомикробных препаратов необходимо улучшить очистку сточных вод (используя очистка промышленных сточных вод процессы), чтобы уменьшить выброс остатков в окружающую среду.[59]
Управление использованием животных
Европа
В 1997 году министры здравоохранения Европейского союза проголосовали за запрет авопарцин и четыре дополнительных антибиотика, использованных для стимуляции роста животных в 1999 году.[63] В 2006 году вступил в силу запрет на использование антибиотиков в европейских кормах, за исключением двух антибиотиков в кормах для домашней птицы.[64] В Скандинавии есть свидетельства того, что запрет привел к более низкой распространенности устойчивости к антибиотикам в (неопасных) популяциях бактерий животных.[65] По состоянию на 2004 год в нескольких европейских странах наблюдалось снижение устойчивости человека к противомикробным препаратам за счет ограничения использования противомикробных препаратов в сельском хозяйстве и пищевой промышленности без ущерба для здоровья животных или экономических затрат.[66]
Соединенные Штаты
В Министерство сельского хозяйства США (USDA) и Управление по контролю за продуктами и лекарствами (FDA) собирают данные об использовании антибиотиков у людей и, в более ограниченном виде, у животных.[67] FDA впервые установило в 1977 году, что есть доказательства появления устойчивых к антибиотикам бактериальных штаммов у домашнего скота. Давно установившаяся практика разрешать безрецептурную продажу антибиотиков (включая пенициллин и другие препараты) животноводам-непрофессионалам для введения их собственным животным, тем не менее, продолжалась во всех штатах. В 2000 году FDA объявило о своем намерении отозвать одобрение фторхинолон использование в птицеводстве из-за наличия серьезных доказательств, связывающих его с появлением резистентных к фторхинолонам Campylobacter инфекции у людей. Юридические проблемы со стороны пищевой животноводческой и фармацевтической промышленности отложили принятие окончательного решения до 2006 года.[68] Флурохинолоны были запрещены к использованию в пищевых продуктах в США с 2007 года. Однако они по-прежнему широко используются у домашних и экзотических животных.
Глобальные планы действий и осведомленность
Растущая взаимосвязанность мира и тот факт, что новые классы антибиотиков не разрабатывались и не утверждались более 25 лет, подчеркивают, в какой степени устойчивость к противомикробным препаратам является глобальной проблемой здравоохранения.[69] Глобальный план действий по решению растущей проблемы устойчивости к антибиотикам и другим противомикробным препаратам был одобрен на Шестьдесят восьмой конференции. Всемирная ассамблея здравоохранения в мае 2015 года.[70] Одна из ключевых целей плана - повысить осведомленность и понимание устойчивости к противомикробным препаратам посредством эффективного общения, образования и обучения. Этот глобальный план действий, разработанный Всемирной организацией здравоохранения, был создан для борьбы с проблемой устойчивости к противомикробным препаратам и основывался на рекомендациях стран и основных заинтересованных сторон. Глобальный план действий ВОЗ состоит из пяти ключевых целей, которые могут быть решены с помощью различных средств, и представляет собой объединение стран для решения серьезной проблемы, которая может иметь последствия для здоровья в будущем.[29] Эти цели заключаются в следующем:
- повысить осведомленность и понимание устойчивости к противомикробным препаратам посредством эффективного общения, образования и обучения.
- укреплять базу знаний и фактических данных посредством наблюдения и исследований.
- снизить заболеваемость за счет эффективных мер санитарии, гигиены и профилактики инфекций.
- оптимизировать использование противомикробных препаратов для защиты здоровья человека и животных.
- разработать экономическое обоснование для устойчивых инвестиций, учитывающих потребности всех стран, и увеличить инвестиции в новые лекарства, диагностические инструменты, вакцины и другие меры.
Шаги к прогрессу
- Компания React, базирующаяся в Швеции, выпустила информативные материалы по AMR для широкой публики.[71]
- Видео создаются для широкой публики, чтобы вызвать интерес и осведомленность.[72][73]
- Министерство здравоохранения Ирландии опубликовало Национальный план действий по устойчивости к противомикробным препаратам в октябре 2017 года.[74] В рамках Стратегии борьбы с устойчивостью к противомикробным препаратам в Ирландии (ТОРИ), запущенной в 2001 г., были разработаны Руководства по рациональному использованию противомикробных препаратов в больницах Ирландии.[75] совместно с Центром надзора за охраной здоровья они были опубликованы в 2009 году. После их публикации была проведена кампания общественной информации «Действия в отношении антибиотиков».[76]'был запущен, чтобы подчеркнуть необходимость изменения назначения антибиотиков. Несмотря на это, количество прописываемых антибиотиков остается высоким, а соблюдение рекомендаций отличается.[77]
Неделя знаний об антибиотиках
Всемирная организация здравоохранения организовала первую Всемирную неделю осведомленности об антибиотиках, которая пройдет с 16 по 22 ноября 2015 года. Цель недели - повысить глобальную осведомленность об устойчивости к антибиотикам. Он также хочет способствовать правильному использованию антибиотиков во всех областях, чтобы предотвратить дальнейшие случаи устойчивости к антибиотикам.[78]
Всемирная неделя осведомленности об антибиотиках проводится каждый ноябрь с 2015 года. В 2017 году Продовольственная и сельскохозяйственная организация Объединенных Наций (ФАО), Всемирная организация здравоохранения (ВОЗ) и Всемирная организация здоровья животных (МЭБ) вместе призывают к ответственному использованию антибиотиков у людей и животных, чтобы уменьшить возникновение устойчивости к антибиотикам.[79]
Объединенные Нации
В 2016 году Генеральный секретарь Объединенные Нации созвал Межучрежденческую координационную группу (IACG) по устойчивости к противомикробным препаратам.[80] IACG работала с международными организациями и экспертами в области здоровья человека, животных и растений, чтобы разработать план борьбы с устойчивостью к противомикробным препаратам.[80] Их отчет, опубликованный в апреле 2019 года, подчеркивает серьезность устойчивости к противомикробным препаратам и угрозу, которую она представляет для здоровья мира. В нем предлагается пять рекомендаций, которым государства-члены должны следовать, чтобы противостоять этой растущей угрозе. Рекомендации IACG следующие:
- Ускорение прогресса в странах
- Внедряйте инновации, чтобы обеспечить будущее
- Сотрудничайте для более эффективных действий
- Инвестируйте в устойчивый ответ
- Усиление подотчетности и глобального управления
Механизмы и организмы
Бактерии

Четыре основных механизма устойчивости бактерий к антибиотикам:
- Инактивация или модификация лекарственного средства: например, ферментативная дезактивация пенициллин G у некоторых устойчивых к пенициллину бактерий за счет производства β-лактамазы. Чаще всего защитные ферменты, продуцируемые бактериальной клеткой, добавляют ацетильную или фосфатную группу к определенному участку антибиотика, что снижает его способность связываться с бактериальными рибосомами и нарушает синтез белка.[81]
- Изменение сайта-мишени или сайта связывания: например, изменение PBP - целевой сайт связывания пенициллинов - в MRSA и другие устойчивые к пенициллину бактерии. Другой защитный механизм, обнаруженный среди видов бактерий, - это белки защиты рибосом. Эти белки защищают бактериальную клетку от антибиотиков, которые нацелены на рибосомы клетки, чтобы ингибировать синтез белка. Этот механизм включает связывание белков защиты рибосом с рибосомами бактериальной клетки, что, в свою очередь, изменяет ее конформационную форму. Это позволяет рибосомам продолжать синтез белков, необходимых для клетки, предотвращая связывание антибиотиков с рибосомой и подавление синтеза белка.[82]
- Нарушение метаболического пути: например, некоторые сульфонамид -резистентные бактерии не требуют парааминобензойная кислота (ПАБК), важный прекурсор для синтеза фолиевая кислота и нуклеиновые кислоты у бактерий, ингибируемых сульфаниламидами, вместо этого, как и в клетках млекопитающих, они обращаются к использованию предварительно образованной фолиевой кислоты.[83]
- Уменьшение накопления лекарства: за счет уменьшения количества лекарства проницаемость или увеличение активности отток (откачивание) лекарств через поверхность клетки[84] Эти насосы внутри клеточной мембраны определенных видов бактерий используются для выкачивания антибиотиков из клетки, прежде чем они смогут нанести какой-либо ущерб. Они часто активируются определенным субстратом, связанным с антибиотиком.[85] как в фторхинолон сопротивление.[86]
- Расщепление и рециклинг рибосом: например, задержка рибосомы с помощью лекарств линкомицин и эритромицин не установлен белком теплового шока, обнаруженным в Listeria monocytogenes, который является гомологом HflX из других бактерий. Освобождение рибосомы от лекарственного средства делает возможной дальнейшую трансляцию и, как следствие, устойчивость к лекарству.[87]
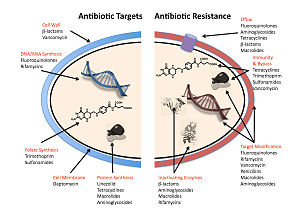
У грамотрицательных бактерий гены устойчивости, опосредованные плазмидами, продуцируют белки, которые могут связываться с ДНК-гираза, защищая его от действия хинолонов. Наконец, мутации в ключевых сайтах ДНК-гиразы или топоизомераза IV могут снизить их аффинность связывания с хинолонами, снижая эффективность препарата.[88]
Некоторые бактерии обладают естественной устойчивостью к определенным антибиотикам; например, грамотрицательные бактерии устойчивы к большинству β-лактамные антибиотики из-за наличия β-лактамаза. Устойчивость к антибиотикам также может быть приобретена в результате генетической мутации или горизонтальный перенос генов.[89] Хотя мутации редки, спонтанные мутации в возбудитель геном происходит примерно в 1 из 105 до 1 из 108 на хромосомную репликацию,[90] тот факт, что бактерии размножаются с высокой скоростью, позволяет добиться значительного эффекта. Учитывая, что продолжительность жизни и производство новых поколений может составлять всего несколько часов, новая (de novo) мутация в родительской клетке может быстро стать унаследованный широко распространенная мутация, приводящая к микроэволюция полностью устойчивой колонии. Однако хромосомные мутации также приводят к снижению приспособленности. Например, рибосомная мутация может защищать бактериальную клетку, изменяя сайт связывания антибиотика, но также замедляет синтез белка.[81] проявляясь в более медленном росте.[91] Более того, некоторые адаптивные мутации могут передаваться не только через наследование, но и через горизонтальный перенос генов. Самый распространенный механизм горизонтального переноса генов - это перенос плазмиды перенос генов устойчивости к антибиотикам между бактериями одного или разных видов через спряжение. Однако бактерии также могут приобретать устойчивость через трансформация, как в Пневмококк захват обнаженных фрагментов внеклеточной ДНК, которые содержат гены устойчивости к антибиотикам к стрептомицину,[92] через трансдукция, как при опосредованном бактериофагом переносе генов устойчивости к тетрациклину между штаммами S. pyogenes,[93] или через агенты переноса генов, которые представляют собой частицы, продуцируемые клеткой-хозяином, напоминающие структуры бактериофага и способные переносить ДНК.[94]
Устойчивость к антибиотикам может быть искусственно привнесена в микроорганизм с помощью лабораторных протоколов, иногда используемых в качестве выбираемый маркер изучить механизмы переноса генов или идентифицировать людей, которые поглотили фрагмент ДНК, включающий ген устойчивости и другой интересующий ген.[95]
Недавние открытия показывают, что для появления устойчивости к антибиотикам нет необходимости в больших популяциях бактерий. Небольшие популяции кишечная палочка в градиенте антибиотика может стать устойчивым. Любая гетерогенная среда в отношении градиентов питательных веществ и антибиотиков может способствовать устойчивости к антибиотикам в небольших популяциях бактерий. Исследователи предполагают, что механизм эволюции устойчивости основан на четырех мутациях SNP в геноме Кишечная палочка продуцируется градиентом антибиотика.[96]
В одном исследовании, которое имеет значение для космической микробиологии, непатогенный штамм Кишечная палочка MG1655 подвергался воздействию следовых количеств антибиотика широкого спектра действия. хлорамфеникол, в условиях моделируемой микрогравитации (LSMMG или Low Shear Modeled Microgravity) более 1000 поколений. Адаптированный штамм приобрел устойчивость не только к хлорамфениколу, но и перекрестную устойчивость к другим антибиотикам;[97] это контрастировало с наблюдением за тем же штаммом, который был адаптирован к более чем 1000 поколениям под LSMMG, но без какого-либо воздействия антибиотиков; деформация в этом случае не приобрела такого сопротивления.[98] Таким образом, независимо от того, где они используются, использование антибиотика, вероятно, приведет к стойкой устойчивости к этому антибиотику, а также перекрестной устойчивости к другим противомикробным препаратам.
В последние годы появление и распространение β-лактамазы называется карбапенемазы стал серьезным кризисом в области здравоохранения.[99] Одна из таких карбапенемаз - Нью-Дели металло-бета-лактамаза 1 (НДМ-1),[100] ан фермент что делает бактерии стойкий широкому кругу бета-лактамные антибиотики. Наиболее распространенные бактерии, вырабатывающие этот фермент: грамотрицательный Такие как Кишечная палочка и Клебсиелла пневмонии, но ген NDM-1 может передаваться от одного штамма бактерий к другому путем горизонтальный перенос генов.[101]
Вирусы
Специфический противовирусные препараты используются для лечения некоторых вирусных инфекций. Эти препараты предотвращают размножение вирусов, подавляя важные стадии цикла репликации вируса в инфицированных клетках. Противовирусные препараты используются для лечения ВИЧ, гепатит Б, гепатит С, грипп, вирусы герпеса включая вирус ветряной оспы, цитомегаловирус и Вирус Эпштейна-Барра. С каждым вирусом некоторые штаммы становятся устойчивыми к введенным лекарствам.[102]
Противовирусные препараты обычно нацелены на ключевые компоненты репродукции вируса; Например, осельтамивир нацелен на грипп нейраминидаза, а аналоги гуанозина ингибируют вирусную ДНК-полимеразу. Таким образом, устойчивость к противовирусным препаратам приобретается за счет мутаций в генах, кодирующих белки-мишени лекарств.
Устойчивость к противовирусным препаратам ВИЧ представляет собой проблему, и даже появились штаммы с множественной лекарственной устойчивостью.[103] Одним из источников устойчивости является то, что многие современные препараты против ВИЧ, включая НИОТ и ННИОТ, нацелены на обратная транскриптаза; однако обратная транскриптаза ВИЧ-1 очень подвержена ошибкам, и поэтому мутации, придающие устойчивость, возникают быстро.[104] Резистентные штаммы вируса ВИЧ быстро появляются, если используется только один противовирусный препарат.[105] Одновременное употребление трех или более препаратов, называемых комбинированная терапия, помог справиться с этой проблемой, но необходимы новые лекарства из-за продолжающегося появления штаммов ВИЧ с лекарственной устойчивостью.[106]
Грибы
Инфекции грибами являются причиной высокой заболеваемости и смертности в с ослабленным иммунитетом люди, например, люди с ВИЧ / СПИДом, туберкулезом или получающие химиотерапия.[107] Грибы Candida, Криптококк neoformans и Aspergillus fumigatus вызывают большинство этих инфекций, и у всех возникает устойчивость к противогрибковым препаратам.[108] Множественная лекарственная устойчивость грибов возрастает из-за широкого использования противогрибковых препаратов для лечения инфекций у лиц с ослабленным иммунитетом.[109]
Особо следует отметить, Флуконазол Центры контроля заболеваний выделили устойчивые виды Candida как растущую проблему.[40] Более 20 видов Candida могут вызывать Кандидоз инфекция, наиболее распространенной из которых является грибковые микроорганизмы албиканс. Дрожжи Candida обычно обитают на коже и слизистых оболочках, не вызывая инфекций. Однако чрезмерный рост Candida может привести к кандидозу. Некоторые штаммы Candida становятся устойчивыми к препаратам первого и второго ряда. противогрибковые средства Такие как азолы и эхинокандины.[40]
Паразиты
В простейшие паразиты, вызывающие заболевания малярия, трипаносомоз, токсоплазмоз, криптоспоридиоз и лейшманиоз являются важными патогенами человека.[110]
Малярийные паразиты, устойчивые к лекарствам, которые в настоящее время доступны для инфекций, являются обычным явлением, и это привело к активизации усилий по разработке новых лекарств.[111] Устойчивость к недавно разработанным лекарствам, таким как артемизинин также не поступало. Проблема лекарственной устойчивости малярии побудила усилия по разработке вакцин.[112]
Трипаносомы паразитические простейшие, вызывающие Африканский трипаносомоз и Болезнь Шагаса (Американский трипаносомоз).[113][114] Вакцины для предотвращения этих инфекций отсутствуют, поэтому такие лекарства, как пентамидин и сурамин, бензнидазол и нифуртимокс используются для лечения инфекций. Эти препараты эффективны, но сообщалось об инфекциях, вызванных резистентными паразитами.[110]
Лейшманиоз вызывается простейшими и является важной проблемой общественного здравоохранения во всем мире, особенно в субтропических и тропических странах. Устойчивость к лекарствам стала «серьезной проблемой».[115]
История
Открытие пенициллина в 1928 году и других антибиотиков в 20 веке оказалось значительным медицинским достижением, спасшим миллионы жизней и значительно снизившим бремя инфекционных заболеваний.[116] 1950–1970-е годы были золотым веком открытия антибиотиков, когда были открыты бесчисленные новые классы антибиотиков для лечения ранее неизлечимых заболеваний, таких как туберкулез и сифилис.[117] Однако с того времени открытия новых классов антибиотиков практически не существовало, и это представляет собой ситуацию, которая особенно проблематична с учетом устойчивости бактерий.[118] показаны с течением времени и продолжающееся неправильное и чрезмерное использование антибиотиков в лечении.[119]
Феномен устойчивости к противомикробным препаратам, вызванный чрезмерным использованием антибиотиков, был предсказан еще в 1945 г. Александр Флеминг который сказал: «Может наступить время, когда пенициллин сможет купить кто угодно в магазинах. Тогда есть опасность, что невежественный человек может легко занизить дозу для себя и, подвергая свои микробы несмертельным дозам препарата, сделает их устойчивыми».[120][121] Без создания новых и более сильных антибиотиков эпоха, когда обычные инфекции и легкие травмы могут убить, а сложные процедуры, такие как хирургия и химиотерапия, становятся слишком рискованными, вполне реальна.[122] Устойчивость к противомикробным препаратам угрожает миру, каким мы его знаем, и может привести к эпидемиям огромных размеров, если не будут приняты профилактические меры. В наши дни текущая устойчивость к противомикробным препаратам приводит к более длительному пребыванию в больнице, более высоким медицинским расходам и повышенной смертности.[119]
Общество и культура
С середины 1980-х годов фармацевтические компании инвестировали в лекарства от рака или хронических заболеваний, которые имеют больший потенциал для заработка, и «снизили внимание к разработке антибиотиков или отказались от них».[123] 20 января 2016 г. Всемирный Экономический Форум в Давос, Швейцария более «80 фармацевтических и диагностических компаний» со всего мира призвали к «трансформационным коммерческим моделям» на глобальном уровне для стимулирования исследований и разработок антибиотиков и «более широкого использования диагностических тестов, которые могут быстро идентифицировать инфекционный организм».[123]
Правовая база
Некоторые исследователи глобального здравоохранения утверждали, что необходима глобальная правовая база для предотвращения и контроля устойчивости к противомикробным препаратам.[124][125][19][126] Например, обязательные глобальные политики могут использоваться для создания стандартов использования противомикробных препаратов, регулирования маркетинга антибиотиков и укрепления глобальных систем эпиднадзора.[19][124] Обеспечение соблюдения заинтересованными сторонами является сложной задачей.[19] Глобальная политика обеспечения устойчивости к противомикробным препаратам могла бы извлечь уроки из экологического сектора, приняв стратегии, которые обеспечили успех международных природоохранных соглашений в прошлом, такие как: санкции за несоблюдение, помощь в реализации, правила принятия решений большинством голосов, независимая научная группа и конкретные обязательства.[127]
Соединенные Штаты
Для Бюджет США на 2016 г., Президент США Барак Обама предложила почти вдвое увеличить объем федерального финансирования на «борьбу и предотвращение» устойчивости к антибиотикам до более чем 1,2 миллиарда долларов.[128] Многие международные финансовые агентства, такие как USAID, DFID, SIDA и Фонд Билла и Мелинды Гейтс пообещали выделить деньги на разработку стратегий противодействия устойчивости к противомикробным препаратам.
27 марта 2015 г. белый дом выпустила всеобъемлющий план, направленный на удовлетворение растущей потребности агентств в борьбе с ростом числа устойчивых к антибиотикам бактерий. Создана рабочая группа по борьбе с устойчивыми к антибиотикам бактериями. Национальный план действий по борьбе с устойчивыми к антибиотикам бактериями с намерением предоставить дорожную карту, которая поможет США в решении проблемы устойчивости к антибиотикам, и с надеждой на спасение многих жизней. В этом плане изложены шаги, предпринятые федеральным правительством в течение следующих пяти лет, необходимые для предотвращения и сдерживания вспышек устойчивых к антибиотикам инфекций; поддерживать эффективность уже имеющихся на рынке антибиотиков; и помочь в разработке будущих диагностических средств, антибиотиков и вакцин.[129]
План действий был разработан вокруг пяти целей с упором на укрепление здравоохранения, ветеринарную медицину, сельское хозяйство, безопасность пищевых продуктов и исследования, а также производство. Эти цели, перечисленные Белым домом, заключаются в следующем:
- Замедлить появление устойчивых бактерий и предотвратить распространение устойчивых инфекций
- Усиление национальных усилий по надзору за единым здоровьем для борьбы с резистентностью
- Прогрессивная разработка и использование быстрых и инновационных диагностических тестов для идентификации и характеристики резистентных бактерий
- Ускорение фундаментальных и прикладных исследований и разработок новых антибиотиков, других терапевтических средств и вакцин
- Улучшение международного сотрудничества и потенциала в области профилактики устойчивости к антибиотикам, надзора, контроля, а также исследований и разработок антибиотиков
К 2020 году поставлены следующие цели:[129]
- Создание антимикробных программ в больницах неотложной помощи
- Сокращение случаев ненадлежащего назначения и использования антибиотиков как минимум на 50% в амбулаторных условиях и на 20% в стационарных условиях.
- Создание государственных программ профилактики устойчивости к антибиотикам (АР) во всех 50 штатах
- Отказ от использования важных с медицинской точки зрения антибиотиков для стимуляции роста сельскохозяйственных животных.
объединенное Королевство
Общественное здравоохранение Англии сообщили, что общее количество устойчивых к антибиотикам инфекций в Англии выросло на 9% с 55 812 в 2017 году до 60 788 в 2018 году, но потребление антибиотиков упало на 9% с 20,0 до 18,2 установленных суточных доз на 1000 жителей в день в период с 2014 по 2018 год.[130]
Политики
В соответствии с Всемирная организация здоровья, лица, определяющие политику, могут помочь в борьбе с резистентностью, усилив отслеживание резистентности и лабораторный потенциал, а также регулируя и продвигая надлежащее использование лекарств.[23] Политики и промышленность могут помочь справиться с сопротивлением посредством: стимулирования инноваций и исследований и разработки новых инструментов; и содействие сотрудничеству и обмену информацией между всеми заинтересованными сторонами.[23]
Дальнейшие исследования
Неясно, влияет ли экспресс-тестирование на вирусы на использование антибиотиков у детей.[131]
Вакцина
Микроорганизмы не развивают устойчивости к вакцина потому что вакцина усиливает иммунную систему организма, тогда как антибиотик действует отдельно от нормальной защиты организма. Более того, если использование вакцин увеличится, есть свидетельства того, что количество устойчивых к антибиотикам штаммов патогенов уменьшится; потребность в антибиотиках естественным образом снизится, поскольку вакцины предотвращают инфекцию до ее возникновения.[132] Однако новые штаммы, избегающие иммунитета, вызванного вакцинами, могут эволюционировать; например, обновленный вакцина против гриппа требуется каждый год.
Хотя теоретически многообещающие антистафилококковые вакцины показали ограниченную эффективность из-за иммунологических различий между Стафилококк видов, и ограниченная продолжительность эффективности продуцируемых антител. В настоящее время ведутся разработки и испытания более эффективных вакцин.[133]
Альтернативная терапия
Альтернативная терапия - это предложенный метод, при котором два или три антибиотика принимают поочередно по сравнению с приемом только одного антибиотика, так что бактерии, устойчивые к одному антибиотику, погибают при приеме следующего антибиотика. Исследования показали, что этот метод снижает скорость появления устойчивых к антибиотикам бактерий in vitro по сравнению с одним лекарством в течение всего времени.[134]
Исследования показали, что бактерии, у которых развивается устойчивость к антибиотикам одной группы антибиотиков, могут стать более чувствительными к другим.[135] Это явление можно использовать для отбора устойчивых бактерий с использованием подхода, называемого циклическим циклом побочной чувствительности.[136] который недавно был признан актуальным при разработке стратегий лечения хронических инфекций, вызванных Синегнойная палочка.[137]
Разработка новых лекарств
С момента открытия антибиотиков, исследования и разработки (НИОКР) вовремя предоставили новые лекарства для лечения бактерий, которые стали устойчивыми к старым антибиотикам, но в 2000-х годах возникли опасения, что развитие настолько замедлилось, что у тяжелобольных людей могут закончиться варианты лечения.[138][139] Еще одна проблема заключается в том, что врачи могут неохотно проводить обычные операции из-за повышенного риска опасной инфекции.[140] Резервное лечение может иметь серьезные побочные эффекты; например, лечение туберкулез с множественной лекарственной устойчивостью может вызвать глухоту или психологическую инвалидность.[141] Возможный кризис - результат заметного сокращения отраслевых НИОКР.[142] Ситуация усугубляется нехваткой финансовых вложений в исследования антибиотиков.[143][142] Фармацевтическая промышленность не имеет большого стимула вкладывать средства в антибиотики из-за высокого риска и из-за того, что потенциальная финансовая прибыль с меньшей вероятностью покроет стоимость лечения. разработка чем для других фармацевтических препаратов.[144] В 2011, Pfizer, одна из последних крупных фармацевтических компаний, разрабатывающих новые антибиотики, свернула свои основные исследовательские работы, сославшись на низкую доходность акций по сравнению с лекарствами от хронических заболеваний.[145] Тем не менее, малые и средние фармацевтические компании все еще активно исследуют антибиотики.
В США фармацевтические компании и администрация президента Барак Обама предлагал изменить стандарты, по которым FDA утверждает антибиотики, нацеленные на резистентные организмы.[140][146]
18 сентября 2014 г. Обама подписал указ.[147] выполнить рекомендации, предложенные в отчете[148] посредством Совет советников президента по науке и технологиям (PCAST), в котором излагаются стратегии оптимизации клинических испытаний и ускорения исследований и разработок новых антибиотиков. Среди предложений:
- Создать «надежную, постоянно действующую национальную сеть клинических испытаний для тестирования антибиотиков», которая будет оперативно регистрировать пациентов, у которых будет установлено, что они страдают опасными бактериальными инфекциями. Сеть позволит одновременно тестировать несколько новых агентов от разных компаний на их безопасность и эффективность.
- Создать для FDA методику «специального медицинского использования» (SMU) для утверждения новых противомикробных препаратов для использования в ограниченных группах пациентов, сократить сроки утверждения нового лекарства, чтобы пациенты с тяжелыми инфекциями могли получить выгоду как можно быстрее.
- Обеспечить экономические стимулы, особенно для разработки новых классов антибиотиков, чтобы компенсировать высокие затраты на исследования и разработки, которые заставляют промышленность разрабатывать антибиотики.
Повторное открытие древних методов лечения
Подобно ситуации с терапией малярии, где были найдены успешные методы лечения, основанные на старинных рецептах,[149] уже был достигнут определенный успех в поиске и тестировании древних лекарств и других методов лечения, эффективных против бактерий AMR.[150]
Быстрая диагностика

Отличить инфекции, требующие антибиотиков, от инфекций, купирующихся самостоятельно, сложно. Для того, чтобы направлять надлежащее использование антибиотиков и предотвратить развитие и распространение устойчивости к противомикробным препаратам, необходимы диагностические тесты, которые предоставляют врачам своевременные и действенные результаты.
Острое лихорадочное заболевание - частая причина обращения за медицинской помощью во всем мире и основная причина заболеваемости и смертности. В районах со снижающейся заболеваемостью малярией многие пациенты с лихорадкой не получают надлежащего лечения от малярии, и в отсутствие простого диагностического теста для выявления альтернативных причин лихорадки клиницисты предполагают, что немалярийное лихорадочное заболевание, скорее всего, является бактериальной инфекцией, ведущей к ненадлежащее использование антибиотиков. Многочисленные исследования показали, что использование экспресс-тестов для диагностики малярии без надежных инструментов для выявления других причин лихорадки привело к увеличению использования антибиотиков.[151]
Тестирование на чувствительность к противомикробным препаратам (AST) может помочь практикующим врачам избежать назначения ненужных антибиотиков в стиле точная медицина,[152] и помочь им прописать эффективные антибиотики, но при традиционном подходе это может занять от 12 до 48 часов.[153] Быстрое тестирование, возможно от молекулярная диагностика инновации определяются как «осуществимые в течение 8-часовой рабочей смены».[153] Прогресс был медленным из-за ряда причин, включая стоимость и регулирование.[154]
Фаговая терапия
Фаговая терапия это терапевтический использование бактериофаги лечить патогенный бактериальные инфекции.[155] Фаговая терапия имеет множество потенциальных применений в медицине, стоматологии, ветеринарии и сельском хозяйстве.[156]
Фаговая терапия основана на использовании встречающихся в природе бактериофагов для заражения и лизиса бактерий в месте заражения хозяина. Благодаря современным достижениям в области генетики и биотехнологии эти бактериофаги, возможно, могут быть произведены для лечения конкретных инфекций.[157] Фаги могут быть биоинженерии для борьбы с бактериальными инфекциями с множественной лекарственной устойчивостью, и их использование включает в себя дополнительное преимущество, заключающееся в предотвращении уничтожения полезных бактерий в организме человека.[30] Фаги разрушают стенки и мембраны бактериальных клеток с помощью литических белков, которые убивают бактерии, проделывая множество отверстий изнутри.[158] Бактериофаги могут даже обладать способностью переваривать биопленку, которую образуют многие бактерии, которая защищает их от антибиотиков, чтобы эффективно заражать и убивать бактерии. Биоинженерия может сыграть роль в создании успешных бактериофагов.[158]
Понимание взаимных взаимодействий и эволюции популяций бактерий и фагов в среде организма человека или животного имеет важное значение для рациональной фаговой терапии.[159]
Бактериофаги используются против бактерий, устойчивых к антибиотикам, в Грузия (Институт Джорджа Элиавы ) и в одном институте в Вроцлав, Польша.[160][161] Коктейли с бактериофагами - распространенные лекарства, которые продаются без рецепта в аптеках восточных стран.[162][163]
Смотрите также
- Альянс за разумное использование антибиотиков
- Антибиотик широкого спектра действия
- Сопротивление колонизации
- Препарат последней инстанции
- Генная инженерия
- (KPC) ген антибактериальной устойчивости
- Грамотрицательные бактерии с множественной лекарственной устойчивостью
- Нью-Дели металло-бета-лактамаза 1
- Клетки-персистеры
- Надсемейство резистентность-клубенько-деление клеток (RND)
- Резистом
Рекомендации
- ^ Протокол теста дисковой восприимчивости к диффузии Кирби-Бауэра В архиве 26 июня 2011 г. Wayback Machine, Ян Худзицки, ASM
- ^ а б c «Информационный бюллетень по устойчивости к противомикробным препаратам № 194». who.int. Апрель 2014 г. В архиве из оригинала 10 марта 2015 г.. Получено 7 марта 2015.
- ^ А.-П. Магиоракос, А. Сринивасан, Р. Б. Кэри, Ю. Кармели, М. Э. Фалагас, К. Г. Гиске, С. Харбарт, Дж. Ф. Хинндлер и другие. Бактерии с множественной лекарственной устойчивостью, широкой лекарственной устойчивостью и устойчивостью к пандемиям .... Клиническая микробиология и инфекции, Том 8, Вып. 3 впервые опубликовано 27 июля 2011 г. [через онлайн-библиотеку Wiley]. Проверено 28 августа 2020 г.
- ^ «Общие сведения: об устойчивости к антибиотикам». www.tufts.edu. Архивировано из оригинал 23 октября 2015 г.. Получено 30 октября 2015.
- ^ а б «Об устойчивости к противомикробным препаратам». www.cdc.gov. 10 сентября 2018. В архиве из оригинала на 1 октября 2017 г.. Получено 30 октября 2015.
- ^ а б Шведская работа по сдерживанию устойчивости к антибиотикам - инструменты, методы и опыт (PDF). Стокгольм: Агентство общественного здравоохранения Швеции. 2014. С. 16–17, 121–128. ISBN 978-91-7603-011-0. В архиве (PDF) из оригинала 23 июля 2015 г.. Получено 23 июля 2015.
- ^ а б c d е «Продолжительность антибактериальной терапии и резистентность». NPS Medicinewise. Торговля National Prescribing Service Limited, Австралия. 13 июня 2013. Архивировано с оригинал 23 июля 2015 г.. Получено 22 июля 2015.
- ^ Гербер Дж. С., Росс Р. К., Брайан М., Локалио А. Р., Шимчак Дж. Э., Вассерман Р. и др. (Декабрь 2017 г.). «Связь антибиотиков широкого и узкого спектра действия с неэффективностью лечения, нежелательными явлениями и качеством жизни у детей с острыми инфекциями дыхательных путей». JAMA. 318 (23): 2325–2336. Дои:10.1001 / jama.2017.18715. ЧВК 5820700. PMID 29260224.
- ^ а б «Особенности CDC - Критически важная задача: предотвращение устойчивости к антибиотикам». www.cdc.gov. 4 апреля 2018. В архиве из оригинала 8 ноября 2017 г.. Получено 22 июля 2015.
- ^ Меняющиеся рынки. «ВЛИЯНИЕ ФАРМАЦЕВТИЧЕСКОГО ЗАГРЯЗНЕНИЯ НА СООБЩЕСТВА И ОКРУЖАЮЩУЮ СРЕДУ В ИНДИИ» (PDF). Nordea. Nordea. В архиве (PDF) с оригинала 20 мая 2017 г.. Получено 1 мая 2018.
- ^ Гуллберг Э., Цао С., Берг О.Г., Ильбек К., Сандегрен Л., Хьюз Д., Андерссон Д.И. (июль 2011 г.). «Отбор устойчивых бактерий при очень низких концентрациях антибиотиков». Патогены PLOS. 7 (7): e1002158. Дои:10.1371 / journal.ppat.1002158. ЧВК 3141051. PMID 21811410.
- ^ Кассир Н., Ролайн Дж. М., Бруки П. (2014). «Новая стратегия борьбы с устойчивостью к противомикробным препаратам: возрождение старых антибиотиков». Границы микробиологии. 5: 551. Дои:10.3389 / fmicb.2014.00551. ЧВК 4202707. PMID 25368610.
- ^ Образец I (26 марта 2018 г.). «Призывы к ограничению использования антибиотиков после исследования показывают, что во всем мире рост составляет 65%». Хранитель. В архиве из оригинала 8 апреля 2018 г.. Получено 28 марта 2018.
- ^ Драме, О., Леклер, Д., Пармли, Э. Дж. И др. Устойчивость к противомикробным препаратам Campylobacter у цыплят-бройлеров в пищевой цепи в Канаде. Патогены и болезни пищевого происхождения; 2020; 17 (8): 512-520. DOI: 10.1089 / fpd.2019.2752
- ^ ВОЗ (апрель 2014 г.). «Устойчивость к противомикробным препаратам: глобальный отчет по эпиднадзору 2014». ВОЗ. ВОЗ. В архиве с оригинала 15 мая 2015 г.. Получено 9 мая 2015.
- ^ О'Нил Дж (май 2016 г.). «Глобальная борьба с лекарственно-устойчивыми инфекциями: итоговый отчет и рекомендации» (PDF). amr-review.org/. В архиве (PDF) из оригинала 14 ноября 2017 г.. Получено 10 ноября 2017.
- ^ «Самая большая угроза устойчивости к антибиотикам в США» Центры по контролю и профилактике заболеваний. 6 ноября 2019 г.. Получено 15 ноября 2019.
- ^ Шанель, Шелдон; Доэрти, Бен (10 сентября 2020 г.). "'Ученый предупреждает, что супербактерии представляют собой гораздо больший риск, чем Covid в Тихом океане ". Хранитель. ISSN 0261-3077. Получено 14 сентября 2020.
- ^ а б c d Hoffman SJ, Outterson K, Røttingen JA, Cars O, Clift C, Rizvi Z и др. (Февраль 2015 г.). «Международная правовая база для борьбы с устойчивостью к противомикробным препаратам». Бюллетень Всемирной организации здравоохранения. 93 (2): 66. Дои:10.2471 / BLT.15.152710. ЧВК 4339972. PMID 25883395.
- ^ "Что такое лекарственная устойчивость?". www.niaid.nih.gov. В архиве из оригинала 27 июля 2015 г.. Получено 26 июля 2015.
- ^ "CDC: Станьте умнее: знайте, когда антибиотики работают". Cdc.gov. 29 мая 2018. В архиве из оригинала 29 апреля 2015 г.. Получено 12 июн 2013.
- ^ MacGowan A, Macnaughton E (1 октября 2017 г.). "Устойчивость к антибиотикам". Лекарство. 45 (10): 622–628. Дои:10.1016 / j.mpmed.2017.07.006.
- ^ а б c d е «Первый глобальный отчет ВОЗ об устойчивости к антибиотикам свидетельствует о серьезной угрозе общественному здоровью во всем мире» В архиве 2 мая 2014 г. Wayback Machine Дата обращения 2 мая 2014.
- ^ "Устойчивость к антибиотикам". www.who.int. Получено 16 марта 2020.
- ^ «Устойчивые к антибиотикам бактерии стали причиной более 33 000 смертей в Европе в 2015 году, - говорится в исследовании». Фармацевтический журнал. 7 ноября 2018 г.. Получено 16 декабря 2018.
- ^ «Устойчивость к противомикробным препаратам» Кембриджского медицинского журнала ». Получено 27 февраля 2020.
- ^ а б Холмс А.Х., Мур Л.С., Сундсфьорд А., Стейнбакк М., Регми С., Карки А. и др. (Январь 2016 г.). «Понимание механизмов и драйверов устойчивости к противомикробным препаратам». Ланцет. 387 (10014): 176–87. Дои:10.1016 / S0140-6736 (15) 00473-0. HDL:10044/1/32225. PMID 26603922. S2CID 1944665.
- ^ "Естественный отбор". evolution.berkeley.edu. Получено 10 марта 2020.
- ^ а б c Ферри М., Рануччи Э, Романьоли П., Джакконе В. (сентябрь 2017 г.). «Устойчивость к противомикробным препаратам: новая глобальная угроза для систем общественного здравоохранения». Критические обзоры в области пищевой науки и питания. 57 (13): 2857–2876. Дои:10.1080/10408398.2015.1077192. PMID 26464037. S2CID 24549694.
- ^ а б c d Скорее IA, Kim BC, Bajpai VK, Park YH (май 2017). «Самолечение и устойчивость к антибиотикам: кризис, текущие проблемы и профилактика». Саудовский журнал биологических наук. 24 (4): 808–812. Дои:10.1016 / j.sjbs.2017.01.004. ЧВК 5415144. PMID 28490950.
- ^ Аюкекбонг Дж. А., Нтемгва М., Атабе А. Н. (15 мая 2017 г.). «Угроза устойчивости к противомикробным препаратам в развивающихся странах: причины и стратегии борьбы». Устойчивость к противомикробным препаратам и инфекционный контроль. 6 (1): 47. Дои:10.1186 / s13756-017-0208-х. ЧВК 5433038. PMID 28515903.
- ^ Ventola CL (апрель 2015 г.). «Кризис устойчивости к антибиотикам: часть 1: причины и угрозы». P&T. 40 (4): 277–83. ЧВК 4378521. PMID 25859123.
- ^ Strachan, Cameron R .; Дэвис, Джулиан (1 февраля 2017 г.). «Причины и причины устойчивости к антибиотикам». Перспективы Колд-Спринг-Харбор в медицине. 7 (2): a025171. Дои:10.1101 / cshperspect.a025171. ISSN 2157-1422. ЧВК 5287056. PMID 27793964.
- ^ Харрис А., Чандрамохан С., Авали Р.А., Гревал М., Тиллотсон Г., Чопра Т. (август 2019 г.). «Отношение и знания врачей относительно использования антибиотиков и устойчивости к ним в амбулаторных условиях». Американский журнал инфекционного контроля. 47 (8): 864–868. Дои:10.1016 / j.ajic.2019.02.009. PMID 30926215.
- ^ Ахмад, Акрам (июнь 2017 г.). «Фармацевтические отходы и устойчивость к противомикробным препаратам». Ланцет. 17 (6): 578–579. Дои:10.1016 / S1473-3099 (17) 30268-2. PMID 28555576. Получено 7 октября 2020.
- ^ Тан К.Л., Кэффри Н.П., Нобрега Д.Б., Корк С.К., Ронксли П.Е., Баркема Х.В. и др. (Ноябрь 2017 г.). «Ограничение использования антибиотиков у сельскохозяйственных животных и его связь с устойчивостью к антибиотикам у сельскохозяйственных животных и людей: систематический обзор и метаанализ». Ланцет. Планетарное здоровье. 1 (8): e316 – e327. Дои:10.1016 / S2542-5196 (17) 30141-9. ЧВК 5785333. PMID 29387833.
- ^ а б Иннес Г.К., Рандад П.Р., Коринек А., Дэвис М.Ф., Прайс Л.Б., Со А.Д., Хини CD (апрель 2020 г.). «Внешние социальные издержки устойчивости к противомикробным препаратам у людей, связанные с использованием противомикробных препаратов в животноводстве». Ежегодный обзор общественного здравоохранения. 41 (1): 141–157. Дои:10.1146 / annurev-publhealth-040218-043954. ЧВК 7199423. PMID 31910712.
- ^ Агентство по охране окружающей среды США, OCSPP (15 марта 2013 г.). "Что такое антимикробные пестициды?". Агентство по охране окружающей среды США. Получено 28 февраля 2020.
- ^ Рамакришнан Б., Венкатешварлу К., Сетунатан Н., Мегарадж М. (март 2019 г.). «Местные применения, но глобальные последствия: могут ли пестициды побуждать микроорганизмы к развитию устойчивости к противомикробным препаратам?». Наука об окружающей среде в целом. 654: 177–189. Bibcode:2019ScTEn.654..177R. Дои:10.1016 / j.scitotenv.2018.11.041. PMID 30445319.
- ^ а б c «Наибольшие угрозы - устойчивость к антибиотикам / противомикробным препаратам - CDC». www.cdc.gov. 10 сентября 2018. В архиве из оригинала 12 сентября 2017 г.. Получено 5 мая 2016.
- ^ «Сопротивление HealthMap». HealthMap.org Бостонская детская больница. В архиве с оригинала 15 ноября 2017 г.. Получено 15 ноября 2017.
- ^ Весы Д. «Составление карты устойчивости к антибиотикам: узнайте о микробах в вашем районе». WBUR. Национальное общественное радио. В архиве из оригинала 8 декабря 2015 г.. Получено 8 декабря 2015.
- ^ "ResistanceMap". Центр динамики, экономики и политики заболеваний. В архиве из оригинала 14 ноября 2017 г.. Получено 14 ноября 2017.
- ^ Баур Д., Гладстон Б. П., Буркерт Ф, Каррара Э, Фоши Ф, Дёбеле С., Такконелли Э (сентябрь 2017 г.). «Влияние рационального использования антибиотиков на частоту инфицирования и колонизации устойчивыми к антибиотикам бактериями и инфекцией Clostridium difficile: систематический обзор и метаанализ». Ланцет. Инфекционные заболевания. 17 (9): 990–1001. Дои:10.1016 / S1473-3099 (17) 30325-0. PMID 28629876.
- ^ Gallagher JC, Justo JA, Chahine EB, Bookstaver PB, Scheetz M, Suda KJ, et al. (Август 2018 г.). «Предотвращение постантибиотической эры путем обучения будущих фармацевтов в качестве распорядителей антимикробных препаратов». Американский журнал фармацевтического образования. 82 (6): 6770. Дои:10.5688 / ajpe6770. ЧВК 6116871. PMID 30181677.
- ^ Андерссон Д.И., Хьюз Д. (сентябрь 2011 г.). «Сохранение устойчивости к антибиотикам в бактериальных популяциях». Обзор микробиологии FEMS. 35 (5): 901–11. Дои:10.1111 / j.1574-6976.2011.00289.x. PMID 21707669.
- ^ Гилберг К., Лаури М., Уэйд С., Исонака С. (2003). «Анализ моделей использования лекарств: очевидное чрезмерное употребление антибиотиков и недостаточное использование рецептурных лекарств от астмы, депрессии и ЗСН». Журнал управляемой аптеки. 9 (3): 232–7. Дои:10.18553 / jmcp.2003.9.3.232. PMID 14613466. S2CID 25457069.
- ^ Ллор С., Бьеррум Л. (декабрь 2014 г.). «Устойчивость к противомикробным препаратам: риск, связанный с чрезмерным использованием антибиотиков, и инициативы по уменьшению этой проблемы». Терапевтические достижения в области безопасности лекарственных средств. 5 (6): 229–41. Дои:10.1177/2042098614554919. ЧВК 4232501. PMID 25436105.
- ^ Дорон С., Дэвидсон Л. Е. (ноябрь 2011 г.). «Антимикробное управление». Труды клиники Мэйо. 86 (11): 1113–23. Дои:10.4065 / mcp.2011.0358. ЧВК 3203003. PMID 22033257.
- ^ Дэйви П., Марвик К.А., Скотт К.Л., Чарани Е., Макнил К., Браун Е. и др. (Февраль 2017). «Вмешательства по улучшению практики назначения антибиотиков для стационарных больных». Кокрановская база данных систематических обзоров. 2: CD003543. Дои:10.1002 / 14651858.cd003543.pub4. ЧВК 6464541. PMID 28178770.
- ^ Agga GE, Schmidt JW, Arthur TM (декабрь 2016 г.). «Влияние хлортетрациклиновой профилактики в мясном скоте на здоровье животных и устойчивость к противомикробным препаратам Escherichia coli». Прикладная и экологическая микробиология. 82 (24): 7197–7204. Дои:10.1128 / AEM.01928-16. ЧВК 5118930. PMID 27736789.
- ^ а б Браун Э. Э., Купер А., Каррильо С., Блейс Б. (2019). «Выбор бактерий с множественной лекарственной устойчивостью в кормах для животных». Границы микробиологии. 10: 456. Дои:10.3389 / fmicb.2019.00456. ЧВК 6414793. PMID 30894847.
- ^ Маршалл Б.М., Леви С.Б. (октябрь 2011 г.). «Пищевые животные и противомикробные препараты: влияние на здоровье человека». Обзоры клинической микробиологии. 24 (4): 718–33. Дои:10.1128 / CMR.00002-11. ЧВК 3194830. PMID 21976606.
- ^ О'Салливан Дж. У., Харви Р. Т., Глаззиу П. П., Маккалоу А. (ноябрь 2016 г.). «Письменная информация для пациентов (или родителей детей-пациентов) по сокращению использования антибиотиков при острых инфекциях верхних дыхательных путей в первичной медико-санитарной помощи». Кокрановская база данных систематических обзоров. 11: CD011360. Дои:10.1002 / 14651858.CD011360.pub2. ЧВК 6464519. PMID 27886368.
- ^ «Пять прав приема лекарств». www.ihi.org. В архиве из оригинала 24 октября 2015 г.. Получено 30 октября 2015.
- ^ Лика С., Террелл С.Л., Эдсон Р.С. (февраль 2011 г.). «Общие принципы антимикробной терапии». Труды клиники Мэйо. 86 (2): 156–67. Дои:10.4065 / mcp.2010.0639. ЧВК 3031442. PMID 21282489.
- ^ Fleming-Dutra KE, Hersh AL, Shapiro DJ, Bartoces M, Enns EA, File TM и др. (Май 2016). «Распространенность неподходящих рецептов антибиотиков среди посещений амбулаторных служб США, 2010-2011 гг.». JAMA. 315 (17): 1864–73. Дои:10.1001 / jama.2016.4151. PMID 27139059.
- ^ «Показатель: назначение антибиотиков». QualityWatch. Nuffield Trust & Health Foundation. В архиве из оригинала 14 января 2015 г.. Получено 16 июля 2015.
- ^ а б c IACG (2018) Сократить непреднамеренное воздействие и потребность в противомикробных препаратах, а также оптимизировать их использование Документ для обсуждения IACG, Межведомственная координационная группа по устойчивости к противомикробным препаратам, процесс общественных консультаций в ВОЗ, Женева, Швейцария
- ^ а б c d е Арая П. (май 2016 г.). «Влияние воды и санитарии на бремя диарейных заболеваний и чрезмерное потребление анитбиотиков» (PDF). В архиве (PDF) из оригинала на 1 октября 2017 г.. Получено 12 ноября 2017.
- ^ Swoboda SM, Earsing K, Strauss K, Lane S, Lipsett PA (февраль 2004 г.). «Электронный мониторинг и голосовые подсказки улучшают гигиену рук и уменьшают количество нозокомиальных инфекций в отделении промежуточной помощи». Реанимационная медицина. 32 (2): 358–63. Дои:10.1097 / 01.CCM.0000108866.48795.0F. PMID 14758148. S2CID 9817602.CS1 maint: ref = harv (связь)(требуется подписка)
- ^ ВОЗ, ЮНИСЕФ (2015). Водоснабжение, санитария и гигиена в медицинских учреждениях - статус в странах с низким и средним уровнем доходов и дальнейшие шаги В архиве 12 сентября 2018 в Wayback Machine. Всемирная организация здравоохранения (ВОЗ), Женева, Швейцария, ISBN 978 92 4 150847 6
- ^ Casewell M, Friis C, Marco E, McMullin P, Phillips I (август 2003 г.). «Европейский запрет на антибиотики, способствующие росту, и новые последствия для здоровья человека и животных». Журнал антимикробной химиотерапии. 52 (2): 159–61. Дои:10.1093 / jac / dkg313. PMID 12837737.
- ^ Castanon JI (ноябрь 2007 г.). «История использования антибиотиков в качестве стимуляторов роста в кормах для домашней птицы в Европе». Птицеводство. 86 (11): 2466–71. Дои:10.3382 / пс.2007-00249. PMID 17954599.CS1 maint: ref = harv (связь)(требуется подписка)
- ^ Бенгтссон Б., Виеруп М. (2006). «Устойчивость к противомикробным препаратам в Скандинавии после запрета противомикробных стимуляторов роста». Биотехнология животных. 17 (2): 147–56. Дои:10.1080/10495390600956920. PMID 17127526. S2CID 34602891.CS1 maint: ref = harv (связь)(требуется подписка)
- ^ Ангуло Ф.Дж., Бейкер Н.Л., Олсен С.Дж., Андерсон А., Барретт Т.Дж. (апрель 2004 г.). «Использование противомикробных препаратов в сельском хозяйстве: контроль передачи устойчивости к противомикробным препаратам людям». Семинары по детским инфекционным болезням. 15 (2): 78–85. Дои:10.1053 / j.spid.2004.01.010. PMID 15185190.
- ^ «GAO-11-801, Устойчивость к антибиотикам: агентства добились ограниченного прогресса в отношении использования антибиотиков у животных». gao.gov. В архиве из оригинала 5 ноября 2013 г.. Получено 25 января 2014.
- ^ Нельсон Дж. М., Чиллер TM, Пауэрс Дж. Х., Англо Ф. Дж. (Апрель 2007 г.). «Устойчивые к фторхинолонам виды Campylobacter и отказ от использования фторхинолонов в птицеводстве: история успеха общественного здравоохранения». Клинические инфекционные болезни. 44 (7): 977–80. Дои:10.1086/512369. PMID 17342653.CS1 maint: ref = harv (связь)
- ^ «РЭНД Европа фокусируется на устойчивости к противомикробным препаратам (УПП)». www.rand.org. В архиве из оригинала 21 апреля 2018 г.. Получено 23 апреля 2018.
- ^ ВОЗ. «ГЛОБАЛЬНЫЙ ПЛАН ДЕЙСТВИЙ ПО АНТИМИКРОБНОЙ УСТОЙЧИВОСТИ» (PDF). В архиве (PDF) из оригинала 31 октября 2017 г.. Получено 14 ноября 2017.
- ^ "Реагировать". В архиве из оригинала 16 ноября 2017 г.. Получено 16 ноября 2017.
- ^ «Устойчивость к антибиотикам: тихое цунами (видео на YouTube)». ReActTube. 6 марта 2017 г.. Получено 17 ноября 2017.
- ^ "Объяснение антибиотического апокалипсиса". Kurzgesagt - В двух словах. 16 марта 2016 г.. Получено 17 ноября 2017.
- ^ Департамент здравоохранения (DoH) (октябрь 2017 г.). «Национальный план действий Ирландии по устойчивости к противомикробным препаратам на 2017–2020 годы» - через Lenus (Ирландский репозиторий здоровья).
- ^ Группа, Работа по управлению противомикробными препаратами больниц ТОРИ (2009 г.). Рекомендации по применению антимикробных препаратов в больницах Ирландии. Дублин: Центр наблюдения за охраной здоровья (HPSC) HSE. ISBN 9780955123672.
- ^ «Принимать антибиотики от простуды и гриппа? Нет смысла». HSE.ie. Получено 11 января 2019.
- ^ Мерфи М., Брэдли С.П., Бирн С. (май 2012 г.). «Назначение антибиотиков в первичной медико-санитарной помощи, соблюдение руководящих принципов и ненужное назначение - ирландская точка зрения». Семейная практика BMC. 13: 43. Дои:10.1186/1471-2296-13-43. ЧВК 3430589. PMID 22640399.
- ^ «Всемирная неделя осведомленности об антибиотиках». Всемирная организация здоровья. В архиве из оригинала 20 ноября 2015 г.. Получено 20 ноября 2015.
- ^ «Всемирная неделя осведомленности об антибиотиках». ВОЗ. В архиве из оригинала 13 ноября 2017 г.. Получено 14 ноября 2017.
- ^ а б «ВОЗ | Межучрежденческая координационная группа ООН (IACG) по устойчивости к противомикробным препаратам». ВОЗ. Получено 7 августа 2019.
- ^ а б [Крисуэлл, Дэниел. «Эволюция» устойчивости к антибиотикам ». Институт креационных исследований. N.p., 2004. Web. 28 октября 2014 г.]
- ^ Connell SR, Tracz DM, Nierhaus KH, Taylor DE (декабрь 2003 г.). «Рибосомные защитные белки и их механизм устойчивости к тетрациклину». Противомикробные препараты и химиотерапия. 47 (12): 3675–81. Дои:10.1128 / AAC.47.12.3675-3681.2003. ЧВК 296194. PMID 14638464.
- ^ Генри Р.Дж. (декабрь 1943 г.). «Механизм действия сульфаниламидов». Бактериологические обзоры. 7 (4): 175–262. Дои:10.1128 / MMBR.7.4.175-262.1943. ЧВК 440870. PMID 16350088.
- ^ Ли XZ, Никайдо Х (август 2009 г.). «Опосредованная оттоком лекарственная устойчивость бактерий: обновленная информация». Наркотики. 69 (12): 1555–623. Дои:10.2165/11317030-000000000-00000. ЧВК 2847397. PMID 19678712.CS1 maint: ref = harv (связь)
- ^ Аминов Р.И., Маки Р.И. (июнь 2007 г.). «Эволюция и экология генов устойчивости к антибиотикам». Письма о микробиологии FEMS. 271 (2): 147–61. Дои:10.1111 / j.1574-6968.2007.00757.x. PMID 17490428.
- ^ Морита Ю., Кодама К., Сиота С., Майн Т., Катаока А., Мидзусима Т., Цучия Т. (июль 1998 г.). «NorM, предполагаемый белок оттока нескольких лекарственных препаратов, Vibrio parahaemolyticus и его гомолог в Escherichia coli». Противомикробные препараты и химиотерапия. 42 (7): 1778–82. Дои:10.1128 / AAC.42.7.1778. ЧВК 105682. PMID 9661020.CS1 maint: ref = harv (связь)
- ^ Duval M, Dar D, Carvalho F, Rocha EP, Sorek R, Cossart P (декабрь 2018 г.). «HflXr, гомолог фактора расщепления рибосом, опосредует устойчивость к антибиотикам». Труды Национальной академии наук Соединенных Штатов Америки. 115 (52): 13359–13364. Дои:10.1073 / pnas.1810555115. ЧВК 6310831. PMID 30545912.
- ^ Робичек А., Якоби Г.А., Хупер, округ Колумбия (октябрь 2006 г.). «Появление во всем мире плазмид-опосредованной устойчивости к хинолонам». Ланцет. Инфекционные заболевания. 6 (10): 629–40. Дои:10.1016 / S1473-3099 (06) 70599-0. PMID 17008172.CS1 maint: ref = harv (связь)
- ^ Очиай К., Яманака Т., Кимура К., Савада О. О. (1959). «Наследование лекарственной устойчивости (и ее передача) между штаммами Shigella и между штаммами Shigella и E.coli». Хихон Иджи Шимпор (на японском языке). 34: 1861.CS1 maint: ref = harv (связь)
- ^ Уотфорд S, Уоррингтон SJ (2018), «Бактериальные мутации ДНК», StatPearls, StatPearls Publishing, PMID 29083710, получено 21 января 2019
- ^ Левин Б.Р., Перро В., Уокер Н. (март 2000 г.). «Компенсаторные мутации, устойчивость к антибиотикам и популяционная генетика адаптивной эволюции бактерий». Генетика. 154 (3): 985–97. ЧВК 1460977. PMID 10757748.
- ^ Гочкис Р.Д. (1951). «Передача устойчивости к пенициллину в пневмококках дезоксирибонуклеатом, полученным из устойчивых культур». Симпозиумы Колд-Спринг-Харбор по количественной биологии. 16: 457–61. Дои:10.1101 / SQB.1951.016.01.032. PMID 14942755.
- ^ Убуката К., Конно М., Фуджи Р. (сентябрь 1975 г.). «Трансдукция лекарственной устойчивости к тетрациклину, хлорамфениколу, макролидам, линкомицину и клиндамицину с помощью фагов, индуцированных Streptococcus pyogenes». Журнал антибиотиков. 28 (9): 681–8. Дои:10.7164 / антибиотики. 28.681. PMID 1102514.
- ^ фон Винтерсдорф К.Дж., Пендерс Дж., ван Никерк Дж. М., Миллс Н.Д., Маджумдер С., ван Альфен Л. Б. и др. (19 февраля 2016 г.). «Распространение устойчивости к противомикробным препаратам в микробных экосистемах посредством горизонтального переноса генов». Границы микробиологии. 7: 173. Дои:10.3389 / fmicb.2016.00173. ЧВК 4759269. PMID 26925045.
- ^ Чан С.Х., Бейко Р.Г., Раган М.А. (август 2011 г.). «Боковой перенос генов и фрагментов генов у Staphylococcus выходит за рамки мобильных элементов». Журнал бактериологии. 193 (15): 3964–77. Дои:10.1128 / JB.01524-10. ЧВК 3147504. PMID 21622749.CS1 maint: ref = harv (связь)
- ^ Johansen TB, Scheffer L, Jensen VK, Bohlin J, Feruglio SL (июнь 2018 г.). «Секвенирование всего генома и устойчивость к противомикробным препаратам Brucella melitensis с норвежской точки зрения». Научные отчеты. 8 (1): 8538. Bibcode:2018НатСР ... 8.8538J. Дои:10.1038 / s41598-018-26906-3. ЧВК 5986768. PMID 29867163.
- ^ Тирумалай М.Р., Каруя Ф., Тран К., Степанов В.Г., Брюс Р.Дж., Отт М., Пирсон Д.Л., Fox GE (январь 2019 г.). «Оценка приобретенной устойчивости к антибиотикам в кишечная палочка подвергались длительному воздействию микрогравитации с низким сдвигом и фоновому воздействию антибиотиков ". мБио. 10 (e02637-18). Дои:10,1128 / мБио.02637-18. ЧВК 6336426. PMID 30647159.
- ^ Тирумалай М.Р., Каруя Ф., Тран К., Степанов В.Г., Брюс Р.Дж., Отт М., Пирсон Д.Л., Fox GE (май 2017 г.). "Адаптация кишечная палочка клетки, выращенные в условиях искусственной микрогравитации в течение длительного периода, являются фенотипическими и геномными ». NPJ Микрогравитация. 3 (15): 15. Дои:10.1038 / s41526-017-0020-1. ЧВК 5460176. PMID 28649637.
- ^ Диен С.М., Ролайн Дж.М. (сентябрь 2014 г.). «Гены карбапенемаз и генетические платформы в грамотрицательных палочках: виды Enterobacteriaceae, Pseudomonas и Acinetobacter». Клиническая микробиология и инфекции. 20 (9): 831–8. Дои:10.1111/1469-0691.12655. PMID 24766097.
- ^ Кумарасами К.К., Толеман М.А., Уолш Т.Р., Багария Дж., Батт Ф., Балакришнан Р. и др. (Сентябрь 2010 г.). «Появление нового механизма устойчивости к антибиотикам в Индии, Пакистане и Великобритании: молекулярное, биологическое и эпидемиологическое исследование». Ланцет. Инфекционные заболевания. 10 (9): 597–602. Дои:10.1016 / S1473-3099 (10) 70143-2. ЧВК 2933358. PMID 20705517.
- ^ Hudson CM, Bent ZW, Meagher RJ, Williams KP (7 июня 2014 г.). «Детерминанты устойчивости и мобильные генетические элементы штамма Klebsiella pneumoniae, кодирующего NDM-1». PLOS ONE. 9 (6): e99209. Bibcode:2014PLoSO ... 999209H. Дои:10.1371 / journal.pone.0099209. ЧВК 4048246. PMID 24905728.
- ^ Лу Зи, Сунь Й, Рао Зи (февраль 2014 г.). «Текущий прогресс в антивирусных стратегиях». Тенденции в фармакологических науках. 35 (2): 86–102. Дои:10.1016 / j.tips.2013.11.006. ЧВК 7112804. PMID 24439476.
- ^ Пеннингс PS (июнь 2013 г.). «Устойчивость к лекарствам от ВИЧ: проблемы и перспективы». Отчеты об инфекционных заболеваниях. 5 (Приложение 1): e5. Дои:10.4081 / idr.2013.s1.e5. ЧВК 3892620. PMID 24470969.
- ^ Дас К., Арнольд Э. (апрель 2013 г.). «Обратная транскриптаза ВИЧ-1 и устойчивость к противовирусным препаратам. Часть 1». Текущее мнение в области вирусологии. 3 (2): 111–8. Дои:10.1016 / j.coviro.2013.03.012. ЧВК 4097814. PMID 23602471.
- ^ Тон Кью, Френкель Л. (март 2013 г.). «Устойчивость к лекарствам ВИЧ у матерей и младенцев после использования антиретровирусных препаратов для предотвращения передачи от матери ребенку». Текущие исследования ВИЧ. 11 (2): 126–36. Дои:10.2174 / 1570162x11311020005. PMID 23432488.
- ^ Эбрахим О., Мазандерани А.Х. (июнь 2013 г.). «Последние изменения в лечении ВИЧ и их распространение в бедных странах». Отчеты об инфекционных заболеваниях. 5 (Приложение 1): e2. Дои:10.4081 / idr.2013.s1.e2. ЧВК 3892621. PMID 24470966.
- ^ Xie JL, Polvi EJ, Shekhar-Guturja T, Cowen LE (2014). «Выявление лекарственной устойчивости грибковых патогенов человека». Будущая микробиология. 9 (4): 523–42. Дои:10.2217 / fmb.14.18. PMID 24810351.
- ^ Сринивасан А., Лопес-Рибот JL, Рамасубраманян А.К. (март 2014 г.). «Преодоление противогрибковой устойчивости». Открытие наркотиков сегодня. Технологии. 11: 65–71. Дои:10.1016 / j.ddtec.2014.02.005. ЧВК 4031462. PMID 24847655.
- ^ Коста К., Диас П.Дж., Са-Коррейя I, Тейшейра М.С. (2014). "Множественные переносчики лекарств MFS в патогенных грибах: имеют ли они реальное клиническое воздействие?". Границы физиологии. 5: 197. Дои:10.3389 / fphys.2014.00197. ЧВК 4035561. PMID 24904431.
- ^ а б Эндрюс К.Т., Фишер Г., Скиннер-Адамс Т.С. (август 2014 г.). «Перепрофилирование лекарств и паразитарные простейшие болезни человека». Международный журнал паразитологии. Лекарства и лекарственная устойчивость. 4 (2): 95–111. Дои:10.1016 / j.ijpddr.2014.02.002. ЧВК 4095053. PMID 25057459.
- ^ Виссер Б.Дж., ван Вугт М., Гробуш депутат (октябрь 2014 г.). «Малярия: обновленная информация о современной химиотерапии». Мнение эксперта по фармакотерапии. 15 (15): 2219–54. Дои:10.1517/14656566.2014.944499. PMID 25110058. S2CID 34991324.
- ^ Чиа В.Н., Го Ю.С., Рения Л. (2014). «Новые подходы к идентификации кандидатов защитной вакцины против малярии». Границы микробиологии. 5: 586. Дои:10.3389 / fmicb.2014.00586. ЧВК 4233905. PMID 25452745.
- ^ Франко Дж. Р., Симарро П. П., Диарра А., Джаннин Дж. Г. (2014). «Эпидемиология африканского трипаносомоза человека». Клиническая эпидемиология. 6: 257–75. Дои:10.2147 / CLEP.S39728. ЧВК 4130665. PMID 25125985.
- ^ Эррера Л. (2014). «Trypanosoma cruzi, возбудитель болезни Шагаса: границы между диким и домашним циклами в Венесуэле». Границы общественного здравоохранения. 2: 259. Дои:10.3389 / fpubh.2014.00259. ЧВК 4246568. PMID 25506587.
- ^ Мансуето П., Сейдита А., Витале Г., Кашио А. (2014). «Лейшманиоз у путешественников: обзор литературы» (PDF). Медицина путешествий и инфекционные болезни. 12 (6 Pt A): 563–81. Дои:10.1016 / j.tmaid.2014.09.007. HDL:10447/101959. PMID 25287721.
- ^ Адедеджи, WA (декабрь 2016 г.). «Сокровище под названием антибиотики». Анналы аспирантуры Ибадана. 14 (2): 56–57. ЧВК 5354621. PMID 28337088.
- ^ Аминов Р.И. (2010). «Краткая история эпохи антибиотиков: извлеченные уроки и задачи на будущее». Границы микробиологии. 1: 134. Дои:10.3389 / fmicb.2010.00134. ЧВК 3109405. PMID 21687759.
- ^ Карвалью Дж., Форестье К., Матиас Дж. Д. (декабрь 2019 г.). «Устойчивость к антибиотикам: необходимая концепция для дополнения устойчивости к антибиотикам?». Ход работы. Биологические науки. 286 (1916): 20192408. Дои:10.1098 / rspb.2019.2408. ЧВК 6939251. PMID 31795866.
- ^ а б Организация, Всемирное здравоохранение (2014 г.). Устойчивость к противомикробным препаратам: глобальный отчет по эпиднадзору. Всемирная организация здоровья. Женева, Швейцария. ISBN 9789241564748. OCLC 880847527.
- ^ Амабиле-Куэвас CF, редактор. Устойчивость бактерий к противомикробным препаратам. Horizon Scientific Press; 2007 г.
- ^ Флеминг А. (11 декабря 1945 г.), "Пенициллин" (PDF), Нобелевская лекция, в архиве (PDF) с оригинала 31 марта 2018 г., получено 9 августа 2020
- ^ «ВОЗ | Глобальный план действий по устойчивости к противомикробным препаратам». ВОЗ. В архиве из оригинала 18 апреля 2018 г.. Получено 23 апреля 2018.
- ^ а б Поллак А (20 января 2016 г.). «Чтобы бороться с« супербактериями », производители лекарств призывают к стимулированию разработки антибиотиков». Нью-Йорк Таймс. Специальный отчет Давоса за 2016 год. Давос, Швейцария. В архиве из оригинала 24 апреля 2018 г.. Получено 24 января 2016.
- ^ а б Бехдинан А., Хоффман С.Дж., Пирси М. (2015). «Некоторые глобальные политики по устойчивости к антибиотикам зависят от юридически обязательных и подлежащих исполнению обязательств». Журнал права, медицины и этики. 43 Дополнение 3 (2): 68–73. Дои:10.1111 / jlme.12277. PMID 26243246. S2CID 7415203.
- ^ Хоффман SJ, Outterson K (2015). «Что потребуется для решения глобальной угрозы устойчивости к антибиотикам?». Журнал права, медицины и этики. 43 (2): 363–8. Дои:10.1111 / jlme.12253. PMID 26242959. S2CID 41987305.
- ^ Ризви З., Хоффман С.Дж. (2015). «Эффективные глобальные действия по борьбе с устойчивостью к антибиотикам требуют внимательного рассмотрения созыва форумов». Журнал права, медицины и этики. 43 Дополнение 3 (2): 74–8. Дои:10.1111 / jlme.12278. PMID 26243247. S2CID 24223063.
- ^ Андресен S, Хоффман SJ (2015). «Многое можно узнать о решении проблемы устойчивости к антибиотикам из многосторонних природоохранных соглашений». Журнал права, медицины и этики. 43 (2): 46–52.
- ^ Президентский бюджет на 2016 год предлагает исторические инвестиции в борьбу с устойчивыми к антибиотикам бактериями в целях защиты общественного здоровья В архиве 11 марта 2015 г. Wayback Machine Белый дом, офис пресс-секретаря, 27 января 2015 г.
- ^ а б «ФАКТИЧЕСКИЕ ДАННЫЕ: Администрация Обамы опубликовала Национальный план действий по борьбе с устойчивыми к антибиотикам бактериями». whitehouse.gov. 27 марта 2015 г. В архиве из оригинала 22 ноября 2015 г.. Получено 30 октября 2015.
- ^ «В 2018 году пациенты заражались 165 инфекциями, устойчивыми к антибиотикам, каждый день, - сообщает PHE».. Фармацевтический журнал. 31 октября 2019 г.. Получено 11 декабря 2019.
- ^ Доан К., Энарсон П., Киссун Н., Классен Т.П., Джонсон Д.В. (сентябрь 2014 г.). «Экспресс-вирусная диагностика острой фебрильной респираторной болезни у детей в отделении неотложной помощи». Кокрановская база данных систематических обзоров. 9 (9): CD006452. Дои:10.1002 / 14651858.CD006452.pub4. ЧВК 6718218. PMID 25222468.
- ^ Мишра Р.П., Овьедо-Орта Е., Прачи П., Раппуоли Р., Баньоли Ф. (октябрь 2012 г.). «Вакцины и устойчивость к антибиотикам». Текущее мнение в микробиологии. 15 (5): 596–602. Дои:10.1016 / j.mib.2012.08.002. PMID 22981392.
- ^ «Иммунитет, инфекционные заболевания и пандемии - что вы можете сделать». HomesteadSchools.com. В архиве из оригинала от 3 декабря 2013 г.. Получено 12 июн 2013.
- ^ Ким С., Либерман Т.Д., Кишони Р. (октябрь 2014 г.). «Альтернативное лечение антибиотиками ограничивает эволюционные пути к множественной лекарственной устойчивости». Труды Национальной академии наук Соединенных Штатов Америки. 111 (40): 14494–9. Bibcode:2014ПНАС..11114494K. Дои:10.1073 / pnas.1409800111. ЧВК 4210010. PMID 25246554.
- ^ Пал С., Папп Б., Лазар В. (июль 2015 г.). «Побочная чувствительность устойчивых к антибиотикам микробов». Тенденции в микробиологии. 23 (7): 401–7. Дои:10.1016 / j.tim.2015.02.009. ЧВК 5958998. PMID 25818802.
- ^ Имамович Л., Соммер МО (сентябрь 2013 г.). «Использование сетей сопутствующей чувствительности для разработки протоколов циклического обращения лекарств, предотвращающих развитие резистентности». Научная трансляционная медицина. 5 (204): 204ra132. Дои:10.1126 / scitranslmed.3006609. PMID 24068739.
- ^ Имамович Л., Эллабаан М.М., Дантас Мачадо А.М., Читтерио Л., Вульф Т., Молин С. и др. (Январь 2018). «Фенотипическая конвергенция, связанная с лекарствами, поддерживает рациональные стратегии лечения хронических инфекций». Клетка. 172 (1–2): 121–134.e14. Дои:10.1016 / j.cell.2017.12.012. ЧВК 5766827. PMID 29307490.
- ^ Лю Дж., Беделл Т.А., Вест Дж. Г., Соренсен Э. Дж. (Июнь 2016 г.). «Дизайн и синтез молекулярных каркасов с противоинфекционной активностью». Тетраэдр. 72 (25): 3579–3592. Дои:10.1016 / j.tet.2016.01.044. ЧВК 4894353. PMID 27284210.
- ^ «Годовой отчет главного врача - Инфекции и рост устойчивости к противомикробным препаратам» (PDF). UK NHS. 2011. Архивировано с оригинал (PDF) 30 октября 2013 г.
- ^ а б «Администрация Обамы стремится упростить процедуру утверждения антибиотиков». ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР. 4 июня 2013 г. В архиве из оригинала 13 марта 2015 г.. Получено 7 августа 2016.
- ^ «Молдова пытается решить, изолировать ли больных туберкулезом». ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР. 4 июня 2013 г. В архиве из оригинала от 3 августа 2016 г.. Получено 7 августа 2016.
- ^ а б Уолш Ф. (11 марта 2013 г.). «BBC News - Устойчивость к антибиотикам - такой же большой риск, как терроризм» - главный врач ». Новости BBC. Bbc.co.uk. В архиве с оригинала 8 августа 2018 г.. Получено 12 марта 2013.
- ^ Хор М (18 мая 2014 г.). «Почему антибиотики становятся бесполезными во всем мире?». Настоящие новости. В архиве из оригинала 18 мая 2014 г.. Получено 18 мая 2014.
- ^ Нордрум А (2015). «Устойчивость к антибиотикам: почему фармацевтические компании не разрабатывают новые лекарства, чтобы остановить супербактерии?». International Business Times.
- ^ Гевер Дж. (4 февраля 2011 г.). «Pfizer закрывает глаза на новые антибиотики». MedPage сегодня. В архиве из оригинала 14 декабря 2013 г.. Получено 12 марта 2013.
- ^ Ледфорд Х (декабрь 2012 г.). «FDA находится под давлением, чтобы смягчить правила в отношении лекарств». Природа. 492 (7427): 19. Bibcode:2012Натура 492 ... 19л. Дои:10.1038 / 492019a. PMID 23222585.
- ^ Офис пресс-секретаря (18 сентября 2014 г.). «Исполнительный приказ - Борьба с устойчивыми к антибиотикам бактериями». Белый дом. В архиве из оригинала 22 сентября 2014 г.. Получено 22 сентября 2014.
- ^ Совет советников президента по науке и технологиям (сентябрь 2014 г.). «Отчет Президенту о борьбе с устойчивостью к антибиотикам» (PDF). PCAST. В архиве (PDF) из оригинала 22 сентября 2014 г.. Получено 22 сентября 2014.
- ^ Коннелли, Эрин (18 апреля 2017 г.). «Средневековые медицинские книги могли содержать рецепт новых антибиотиков». Разговор.
- ^ «AncientBiotics - средневековое средство от современных супербактерий?» (Пресс-релиз). Ноттингемский университет. 30 марта 2015 г.
- ^ Hopkins H, Bruxvoort KJ, Cairns ME, Chandler CI, Leurent B, Ansah EK, et al. (Март 2017 г.). «Влияние внедрения экспресс-тестов для диагностики малярии на назначение антибиотиков: анализ наблюдательных и рандомизированных исследований в государственных и частных медицинских учреждениях». BMJ. 356: j1054. Дои:10.1136 / bmj.j1054. ЧВК 5370398. PMID 28356302.
- ^ «Диагностика помогает бороться с устойчивостью к противомикробным препаратам, но требуется дополнительная работа». MDDI Online. 20 ноября 2018 г.. Получено 2 декабря 2018.
- ^ а б van Belkum A, Bachmann TT, Lüdke G, Lisby JG, Kahlmeter G, Mohess A, et al. (Январь 2019). «Дорожная карта развития систем тестирования чувствительности к противомикробным препаратам». Обзоры природы. Микробиология. 17 (1): 51–62. Дои:10.1038 / s41579-018-0098-9. HDL:2445/132505. ЧВК 7138758. PMID 30333569.
- ^ «Прогресс в области устойчивости к антибиотикам». Природа. 562 (7727): 307. Октябрь 2018. Bibcode:2018Натура.562Кв.307.. Дои:10.1038 / d41586-018-07031-7. PMID 30333595.
- ^ "Тихие убийцы: фантастические фаги?". В архиве из оригинала 10 февраля 2013 г.. Получено 14 ноября 2017.
- ^ McAuliffe и др. (2007). «Новая биология фагов: от геномики к приложениям» (введение) ». В McGrath S, van Sinderen D (ред.). Бактериофаг: генетика и молекулярная биология. Caister Academic Press. ISBN 978-1-904455-14-1.
- ^ Лин Д.М., Коскелла Б., Линь Х.С. (август 2017 г.). «Фаговая терапия: альтернатива антибиотикам в эпоху множественной лекарственной устойчивости». Всемирный журнал желудочно-кишечной фармакологии и терапии. 8 (3): 162–173. Дои:10.4292 / wjgpt.v8.i3.162. ЧВК 5547374. PMID 28828194.
- ^ а б Salmond GP, Fineran PC (декабрь 2015 г.). «Век фага: прошлое, настоящее и будущее». Обзоры природы. Микробиология. 13 (12): 777–86. Дои:10.1038 / nrmicro3564. PMID 26548913. S2CID 8635034.
- ^ Летаров А.В., Голомидова А.К., Тарасян К.К. (апрель 2010 г.). «Экологические основы рациональной фаготерапии». Acta Naturae. 2 (1): 60–72. Дои:10.32607/20758251-2010-2-1-60-71. ЧВК 3347537. PMID 22649629.
- ^ Парфит Т. (июнь 2005 г.). «Грузия: маловероятный оплот бактериофаготерапии». Ланцет. 365 (9478): 2166–7. Дои:10.1016 / S0140-6736 (05) 66759-1. PMID 15986542. S2CID 28089251.
- ^ Голкар З., Багасра О, Пейс Д.Г. (февраль 2014 г.). «Бактериофаговая терапия: возможное решение кризиса устойчивости к антибиотикам». Журнал инфекций в развивающихся странах. 8 (2): 129–36. Дои:10.3855 / jidc.3573. PMID 24518621.
- ^ МакКаллин С., Алам Саркер С., Барретто С., Султана С., Бергер Б., Хук С. и др. (Сентябрь 2013). «Анализ безопасности российского коктейля фагов: от метагеномного анализа до перорального применения у здоровых людей». Вирусология. 443 (2): 187–96. Дои:10.1016 / j.virol.2013.05.022. PMID 23755967.
- ^ Абедон С.Т., Кул С.Дж., Бласдел Б.Г., Куттер Е.М. (март 2011 г.). «Фаговое лечение инфекций человека». Бактериофаг. 1 (2): 66–85. Дои:10.4161 / bact.1.2.15845. ЧВК 3278644. PMID 22334863.
Книги
- Колдуэлл Р., Линдберг Д., ред. (2011). «Понимание эволюции» [Мутации случайны]. Музей палеонтологии Калифорнийского университета.CS1 maint: ref = harv (связь)
- Рейнольдс Л.А.; Танси Э.М., ред. (2008). Супербактерии и суперпрепараты: история MRSA: стенограмма семинара для свидетелей, проведенного Wellcome Trust Center for the History of Medicine в UCL, Лондон, 11 июля 2006 г.. Лондон: Центр истории медицины Wellcome Trust при UCL. ISBN 978-0-85484-114-1.
- ОЭСР (2018), Остановить волну супербактерий: еще несколько долларов, исследования ОЭСР в области политики здравоохранения, Издательство ОЭСР, Париж, https://doi.org/10.1787/9789264307599-en.
Журналы
- Аномалия J (2017). «Антибиотики и государственная политика» (PDF). Издательство Джорджтаунского университета.
- Ариас Калифорния, Мюррей BE (январь 2009 г.). «Устойчивые к антибиотикам клопы в 21 веке - клиническая супер-задача». Медицинский журнал Новой Англии. 360 (5): 439–43. Дои:10.1056 / NEJMp0804651. PMID 19179312. S2CID 205104375.CS1 maint: ref = harv (связь)
- «Специальный выпуск: этика и устойчивость к противомикробным препаратам». Биоэтика. 365 (33). 2019.
- Goossens H, Ferech M, Vander Stichele R, Elseviers M (2005). Проект Esac. «Амбулаторное использование антибиотиков в Европе и связь с устойчивостью: исследование базы данных из разных стран». Ланцет. Группа Esac Project. 365 (9459): 579–87. Дои:10.1016 / S0140-6736 (05) 17907-0. PMID 15708101. S2CID 23782228.CS1 maint: ref = harv (связь)
- Хоки PM, Джонс AM (сентябрь 2009 г.). «Меняющаяся эпидемиология устойчивости» (PDF). Журнал антимикробной химиотерапии. 64 Дополнение 1: i3-10. Дои:10.1093 / jac / dkp256. PMID 19675017.CS1 maint: ref = harv (связь)
- Soulsby EJ (ноябрь 2005 г.). «Устойчивость к противомикробным препаратам у людей и животных». BMJ. 331 (7527): 1219–20. Дои:10.1136 / bmj.331.7527.1219. ЧВК 1289307. PMID 16308360.CS1 maint: ref = harv (связь)
- «Альтернативы антибиотикам уменьшают заболеваемость животных». Организация Содружества научных и промышленных исследований. 9 января 2006 г.CS1 maint: ref = harv (связь)
- Кук П., Рис-Робертс Д. (2017). ЛОВИТЬ. 16-минутный фильм о постантибиотическом мире. Рассмотрение: Sansom C (март 2017 г.). «Media Watch: интимная семейная история в мире без антибиотиков». Ланцет Инфекция Дис. 17 (3): 274. Дои:10.1016 / S1473-3099 (17) 30067-1.
внешняя ссылка
- Устойчивость к противомикробным препаратам в Керли
- Анимация устойчивости к антибиотикам
- Рекомендации CDC «Управление микроорганизмами с множественной лекарственной устойчивостью в медицинских учреждениях, 2006 г.»
- Проект управления противомикробными препаратами, на Центр исследований и политики в области инфекционных заболеваний (CIDRAP), Университет Миннесоты
- AMR Industry Alliance, "представители крупных научно-исследовательских фармацевтических компаний, производителей дженериков, биотехнологических и диагностических компаний"
